Вопросы для самоконтроля:
1. Способы получения металлов из руд.
2. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов.
3. Объясните, почему в атмосферных условиях цинк корродирует, а золото нет? Ответ подтвердите расчетами.
4. Почему в железной бочке можно хранить концентрированную и нельзя хранить разбавленную серную кислоту?
5. Виды коррозии металлов. Способы защиты металлов от коррозии.
Тема 11. Неметаллы.
Самостоятельное изучение теоретического материала: Материалы, используемые в отрасли.
Вопросы для самоконтроля:
1. Нахождение неметаллов в природе.
2. Какую низшую и высшую степень окисления проявляют углерод, хлор, азот, фосфор, сера и йод? Почему? Укажите возможные степени окисления. Приведите примеры соединений этих элементов в различных степенях окисления.
3. Какая из галогеноводородных кислот - наиболее сильный восстановитель? По-
чему?
4. Приведите электронные структуры атомов азота, серы, мышьяка, кремния, хлора, криптона. К какому электронному семейству относятся эти элементы?
Тема 12. Полимеры.
Самостоятельное изучение теоретического материала: Структура макромолекул: линейные, разветвленные, сетчатые.
Вопросы для самоконтроля:
1. Реакции полимеризации. Приведите примеры полимеров, получаемых реакциями полимеризации.
2. Реакции поликонденсации. Приведите примеры полимеров, получаемых реакциями поликонденсации.
3. Состав и применение лакокрасочных материалов.
4. Состав и применение пластмасс.
5. Состав и применение материалов на основе синтетических каучуков. Вулканизация каучука. Резины.
6. Состав и применение полимерного стекла.
4. Рекомендации по изучению дисциплины
4.1 Рекомендации по изучению дисциплины для студентов очной и очно-заочной форм обучения
Изучение дисциплины осуществляется в течение одного семестра.
При изучении дисциплины «Химия» студентам целесообразно выполнять следующие рекомендации:
1. Изучение курса должно вестись систематически и сопровождаться составлением подробного конспекта. В конспект рекомендуется включать все виды учебной работы: материалы лекций, практических занятий, самостоятельную проработку учебников и рекомендуемых источников;
2. После изучения какого-либо раздела по учебнику или материалам лекций, практических занятий, рекомендуется по памяти воспроизвести основные термины, определения, понятия;
3. Особое внимание следует уделить выполнению практических занятий и лабораторных работ, поскольку это способствует лучшему пониманию и закреплению теоретических знаний; перед выполнением практических занятий и лабораторных работ следует изучить необходимый теоретический материал;
4. Тематика вопросов, изучаемых самостоятельно, задается преподавателем на лекциях, практических занятиях, им же даются источники для более детального понимания вопросов.
4.2. Рекомендации по изучению дисциплины и выполнению контрольных работ для студентов заочной формы обучения
Изучение дисциплины «Химия» студентами заочной формы обучения состоит из цикла установочных лекций, лабораторных и практических занятий, выполнения контрольной работы в межсессионный период и сдачи зачета.
Начинать самостоятельной изучение дисциплины в межсессионный период необходимо анализа рабочей программы курса и подбора рекомендуемой литературы. После изучения каждой темы рекомендуется составлять краткий конспект. При записи формул приводить принятые обозначения и размерности, входящих в расчетные формулы величин.
Усвоив основные теоретические положения отдельных тем курса, студент может переходить к решению задач и выполнению контрольной работы.
Контрольная работа выполняется каждым студентом в отдельности в соответствии с вариантом, выданным преподавателем в период установочной сессии. В контрольную работу включены задания по основным темам дисциплины.
При решении каждой задачи следует внимательно прочесть текст, переписать условие задачи, привести ход решения со всеми математическими преобразованиями. Решение задачи должно сопровождаться краткими пояснениями.
Контрольная работа оформляется либо в рукописном варианте аккуратным и разборчивым почерком в ученических тетрадях в клетку или в печатном варианте на листах формата А4. Работа должна содержать титульный лист (приложение А), иметь поля для замечаний преподавателя, рецензирующего контрольную работу.
Выполненная контрольная работа регистрируется в деканате ВПО, передается для проверки преподавателю деканатом. При необходимости, работа возвращается студенту на доработку вновь через деканат.
Контрольная работа с отметкой «зачтено» сохраняется у преподавателя до проведения зачета.
4.3 Советы по подготовке к зачету и порядок проведения зачета
При подготовке к зачету следует внимательно изучить теоретический материал, просмотреть отчеты по практическим занятиям и лабораторным занятиям по дисциплине.
Зачет устанавливается как форма итоговой аттестации по дисциплине. Зачет охватывает содержание дисциплины, изучаемой в течение семестра. Сроки и место проведения зачета планируется расписанием экзаменационной сессии.
Зачет по дисциплине «Химия» может быть выставлен по итогам проведенного текущего контроля, при выполнении и успешной защите заданий практических занятий и лабораторных работ, а также заданий, выданных преподавателем для самостоятельной работы.
При недостаточном охвате всех модулей дисциплины предыдущим контролем во время зачёта может проводиться дополнительный контроль в форме собеседования.
Результат сдачи зачёта оценивается в режиме «зачтено» и «не зачтено». Запись «зачтено» заносится в экзаменационную ведомость и зачётную книжку студента, запись «не зачтено» выставляется только в экзаменационную ведомость.
Типовые вопросы для подготовки к зачету по дисциплине
1. Предмет химии. Значение химии в изучении природы и развитии техники. Роль химии для данной специальности.
2. Важнейшие классы неорганических соединений: оксиды, кислоты, основания, соли. Классификация, номенклатура, получение, свойства. Комплексные соединения: строение, номенклатура.
3. Квантово-механические представления об электронной структуре атомов.
4. Периодический закон и периодическая система Д.И.Менделеева в свете учения о строении атома.
5. Зависимость свойств элементов и их соединений от строения атома.
6. Ионная связь, образование соединений с ионной связью.
7. Ковалентная связь, способы образования ковалентной связи. Метод валентных связей.
8. Пространственная структура молекулярного явления гибридизации.
9. Водородная связь, агрегатное состояние веществ.
10. Металлическая связь. Физические и химические свойства металлов.
11. Водородная связь, образование водородной связи.
12. Аморфное и кристаллическое состояние твёрдых тел. Строение твёрдого тела. Классификация кристаллов по характеру химической связи.
13. Энергетика химических процессов. Внутренняя энергия и энтальпия.
14. Энтропия, ее изменение при химических реакциях.
15. Энергия Гиббса и направленность химических процессов.
16. Скорость гомогенных и гетерогенных химических реакций. Закон действия масс.
17. Факторы, влияющие на скорость химической реакции.
18. Энергия активации. Уравнение Аррениуса.
19. Каталитические системы и катализаторы. Механизмы гомогенного и гетерогенного катализа.
20. Химическое равновесие. Константа химического равновесия и её связь с термодинамическими функциями. Смещение равновесия. Принцип Ле-Шателье.
21. Растворы. Классификация растворов. Способы выражения концентрации растворов. Дисперсные системы.
22. Теория электролитической диссоциации. Диссоциация сильных и слабых электролитов. Закон разбавления Оствальда.
23. Ионные уравнения реакций.
24. Ионное произведение воды. Водородный показатель среды.
25. Окислительно-восстановительные процессы. Степень окисления. Составление уравнений ОВР ионно-электронным методом с учетом рН среды.
26. Электрохимические процессы. Уравнение Нернста.
27. Гальванический элемент. Анодные и катодные процессы. Условная схема гальванического элемента, ЭДС и ее измерение.
28. Электролиз растворов и расплавов электролитов. Применение электролиза.
29. Физические и химические свойства металлов. Взаимодействие металлов с кислотами: соляной, серной, азотной.
30. Основные виды коррозии металлов. Кислородная и водородная деполяризация. Термодинамика коррозионных процессов. Методы защиты от коррозии: легирование, электрохимическая защита, защитные покрытия.
31. Физические и химические свойства неметаллов.
32. Материалы, используемые в отрасли. Их состав и свойства.
33. Органические полимерные материалы. Получение полимеров. Свойства полимеров: химические, механические, электрические.
34. Применение полимеров в отрасли.
5. Варианты контрольных работ для студентов заочной формы обучения
Основные законы химии
1. Какова масса 5,6 л. (н.у.) углекислого газа? Сколько молекул содержится в этом объеме газа?
2. Каков объем 128 г. сернистого газа при н. у.? Сколько молекул содержится в 128 г. этого газа?
3. Найдите массу кислорода, содержащегося в баллоне объемом 50 л. при температуре 25ºС и давлении 790 кПа.
4. При нормальных условиях 22,4 л. чистого воздуха имеют массу 29 г. Эта масса условно считается средней молярной массой воздуха. Рассчитайте относительную плотность по воздуху следующих газов: водорода 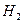 , азота
, азота 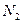 , угарного газа СО, пропана
, угарного газа СО, пропана 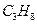 , бутана
, бутана 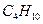 .
.
5. Какой объем займет 1 кг воздуха при 17 ºС и давлении 101,3 кПа?
6. Сколько водорода выделится при взаимодействии 56 г. цинка с соляной кислотой?
7. Сколько тепла необходимо в соответствии с термохимическим уравнением: FeO(к) + H2(г) = Fe(к) + H2O(г) , (ΔН = 23 кДж) для получения 560 г Fe.
8. При 17ºС некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100ºС, если давление его останется неизменным?
9. При некоторой температуре давление газа, занимающего объем 3 л равно 93,3 кПа. Каким станет давление, если, не изменяя температуры, уменьшить объем газа до 2,8 л?
10. Приведите объем газа к нормальным условиям, если при температуре 373 К и давлении  Па его объем равен
Па его объем равен 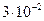 м³.
м³.
11. Газовая смесь приготовлена из 0,03 м³ метана, 0,04 м³ водорода и 0,01 м³ окиси углерода (II). Исходные давления метана, водорода и окиси углерода (II) составили соответственно 96, 84, 108,8 кПа. Объем смеси равен 0,08 м³. Определить парциальные давления газов и общее давление газовой смеси.
12. Сухой воздух имеет примерно следующий состав: азот - 78,09%, кислород – 20,95%, аргон – 0,93%, углекислый газ – 0,03%. Определить массу 40 м³ сухого воздуха при нормальных условиях.
13. Плотность газа по воздуху равна 1,17. Определить молярную массу газа.
14. Определить объем, занимаемый 0,07 кг азота при 21 ºС и давлении 142 кПа.
15. Вычислить массу:
а) 2 л водорода при 15 ºС и давлении 100,7 кПа (755 мм рт. ст.);
б) 1 м³ азота при 10 ºС и давлении 102,9 кПа (772 мм рт. ст.);
в) 0,5 м³ хлора при 20 ºС и давлении 99,9 кПа (749,3 мм рт. ст.);
Дата: 2019-11-01, просмотров: 520.