Самостоятельное изучение теоретического материала: Сильные и слабые электролиты. Факторы, влияющие на процесс диссоциации.
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Электролитическая диссоциация».
Вопросы для самоконтроля:
1. Приведите примеры сильных и слабых электролитов. Какие параметры являются количественными характеристиками процесса диссоциации?
2. Вычислите рН растворов: а) 0,05М 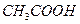 ; б) 0,05М
; б) 0,05М 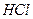 ; в) 0,05М КОН; г) 0,005М
; в) 0,05М КОН; г) 0,005М 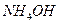 .
.
3. Поясните, как влияет температура растворов на процессы диссоциации сильных и слабых электролитов?
4. Поясните, как влияет концентрация растворов на процессы диссоциации сильных и слабых электролитов?
5. Какие из перечисленных солей подвергаются гидролизу: бромид цинка, сульфид калия, сульфат железа (III), сульфат калия, фосфат натрия, хлорид меди (II). Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза по каждой ступени, указать реакцию водного раствора соли.
6. Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01М растворе.
Тема 6. Концентрация растворов.
Самостоятельное изучение теоретического материала: Ненасыщенные, насыщенные и пересыщенные растворы.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Концентрация растворов».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Определение концентрации раствора карбоната натрия титриметрическим методом».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Какой объем серной кислоты (ρ = 1,84 г/см³) необходим для приготовления одного литра раствора с молярной концентрацией эквивалента равной 1моль/дм³?
Вопросы для самоконтроля:
1. Дайте определения и приведите математические формулы для расчета массовой доли вещества в растворе, молярной концентрации, молярной концентрации эквивалента, моляльной концентрации.
2. Как рассчитывается молярная масса эквивалента вещества для кислотно-основных и окислительно-восстановительных реакций?
3. Что такое фактор эквивалентности?
4. В 250 г воды растворено 50 г кристаллогидрата 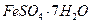 . Вычислить массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
. Вычислить массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
5. Плотность 40% раствора азотной кислоты равна 1,25 г/см³. Рассчитать молярную и моляльную концентрации раствора азотной кислоты.
6. Рассчитать молярную и нормальную концентрации 15% раствора серной кислоты, плотность раствора 1,10 г/см³
Дата: 2019-11-01, просмотров: 289.