Лысьвенский филиал
Кафедра технических дисциплин
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ
«ХИМИЯ»
основной образовательной программы подготовки бакалавров
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
По организации, выполнению и контролю
самостоятельной работы студентов
Лысьва 2017 г.
Методические указания по организации, выполнению и контролю самостоятельной работы студентов составлены на основании рабочих программ дисциплины «Химия» для студентов всех форм обучения направлений: 08.03.01 «Строительство», 13.03.02 «Электроэнергетика и электротехника», 15.03.05 «Конструкторско-технологическое обеспечение машиностроительных производств», 23.03.03 «Эксплуатация транспортно-технологических машин и комплексов», 44.03.04 «Профессиональное обучение (по отраслям)».
Разработчик-составитель методических указаний: доцент кафедры технических дисциплин С.Н. Ваганова, ЛФ ПНИПУ, 2017 год.
Методические указания по организации, выполнению и контролю самостоятельной работы студентов утверждены на заседании кафедры технических дисциплин «___» ________ 2017 года, протокол № ___
Содержание
1. Общие положения 4
2. Виды самостоятельной работы студентов по дисциплине 5
3. Рекомендации по организации самостоятельной работы студентов
по темам дисциплины 7
4. Рекомендации по изучению дисциплины 14
5. Варианты контрольных работ для студентов заочной формы обучения 17
6. Список рекомендуемой литературы 33
Приложение А - Образец титульного листа контрольной работы 34
Приложение Б - Образец задания на выполнение контрольной работы 35
Общие положения
Цель дисциплины: развитие и углубление знаний по химическим законам и теориям как составной части подготовки студентов по фундаментальным наукам; формирование у студентов целостного естественнонаучного мировоззрения; формирование осознанной необходимости химических знаний при решении профессиональных и экологических задач в условиях обострения отношений человек – окружающая среда.
Задачи дисциплины:
- изучение основополагающих химических понятий, теорий, законов, закономерностей протекания химических реакций, химической терминологии и символики;
- формирование умения производить расчеты по химическим формулам и уравнениям, давать их качественную или количественную оценку;
- формирование умения получать справочную информацию, необходимую для решения конкретных химических задач, с помощью различных источников, включая электронные ресурсы;
- освоение основных методов научного познания, используемых в химии: наблюдение, описание, измерение, эксперимент, формирование способности применять методы познания при решении практических задач;
- формирование умения обрабатывать, объяснять результаты и делать выводы на основании проведенных опытов и экспериментов;
- овладение правилами техники безопасности при использовании химических веществ;
- формирование химически грамотного поведения в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
- формирование умения использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
- формирование чувства гордости, уважения к истории и достижениям отечественной химии.
Место учебной дисциплины в структуре образовательной программы
Дисциплина «Химия» относится к базовой части дисциплин блока 1 «Дисциплины (модули)» при освоении ОПОП по направлениям подготовки: 08.03.01 «Строительство», 13.03.02 «Электроэнергетика и электротехника», 15.03.05 «Конструкторско-технологическое обеспечение машиностроительных производств», 23.03.03 «Эксплуатация транспортно-технологических машин и комплексов», 44.03.04 «Профессиональное обучение (по отраслям)».
В результате изучения дисциплины студент должен демонстрировать следующие планируемые результаты обучения:
Знать:
– основные химические законы и теории, общие закономерности протекания химических процессов;
– строение и состав веществ, химическую связь в них;
– классификацию и свойства химических элементов, веществ и соединений;
– назначение и области применения основных химических веществ и соединений.
Уметь:
– использовать основные элементарные методы химического исследования веществ и соединений, проводить измерения, обрабатывать и представлять результаты эксперимента;
– составлять и анализировать химические уравнения;
– соблюдать меры безопасности при работе с химическими реактивами;
– применять химические законы для решения практических задач.
Предметом освоения дисциплины являются:
– вещество, его строение, свойства, превращение, идентификация и анализ;
– химические процессы и общие закономерности их протекания;
– химические системы и смещение равновесия в них.
2. Виды самостоятельной работы студентов по дисциплине
Изучение дисциплины «Химия» предусматривает самостоятельную проработку части программного материала по материалам учебников и рекомендованной литературе, а также подготовку к практическим занятиям, лабораторным работам, оформление отчетов по практическим занятиям и лабораторным работам, выполнение индивидуальных заданий, а также выполнение контрольных работ (для студентов заочной формы обучения).
2.1. Виды самостоятельной работы студентов
Очная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 2 | Самостоятельное изучение теоретического материала | 2 |
| Выполнение индивидуального задания | 2 | |
| 3 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 6 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 7 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическим занятиям и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 9 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 10 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 11 | Самостоятельное изучение теоретического материала | 2 |
| 12 | Самостоятельное изучение теоретического материала | 2 |
| Итого в ч / в ЗЕ | 54/1,5 |
Очно-заочная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 5,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 2 | Самостоятельное изучение теоретического материала | 2,5 |
| Выполнение индивидуального задания | 2 | |
| 3 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 1,5 |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| 6 | Самостоятельное изучение теоретического материала | 1,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 7 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 9 | Самостоятельное изучение теоретического материала | 6 |
| 10 | Самостоятельное изучение теоретического материала | 6 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 11 | Самостоятельное изучение теоретического материала | 2,5 |
| 12 | Самостоятельное изучение теоретического материала | 3,5 |
| Итого в ч / в ЗЕ | 81/2,25 |
Заочная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 9 |
| 2 | Самостоятельное изучение теоретического материала | 4,5 |
| 3 | Самостоятельное изучение теоретического материала | 7,5 |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 8,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 6 |
| 6 | Самостоятельное изучение теоретического материала | 10,5 |
| 7 | Самостоятельное изучение теоретического материала | 12 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 9,5 |
| 9 | Самостоятельное изучение теоретического материала | 5,5 |
| 10 | Самостоятельное изучение теоретического материала | 10,5 |
| 11 | Самостоятельное изучение теоретического материала | 1,5 |
| 12 | Самостоятельное изучение теоретического материала | 3 |
| Итого в ч / в ЗЕ | 94/2,6 |
3. Рекомендации по организации самостоятельной работы студентов
по темам дисциплины
Приступая к изучению дисциплины, студенты должны иметь рекомендованную учебную литературу.
Раздел 3. Растворы.
Тема 8. Электролиз.
Самостоятельное изучение теоретического материала: Химическая и концентрационная поляризация. Перенапряжение водорода.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Электрохимические процессы».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Написать схему электролиза растворов: сульфата натрия, сульфата алюминия и сульфата меди (II).
Вопросы для самоконтроля:
1. Каковы закономерности электролиза катионов металлов в водных растворах в зависимости от их положения в ряду напряжений?
2. Каковы закономерности электролиза анионов бескислородных и кислородосодержащих кислотных остатков в водных растворах?
3. Какие окислительно-восстановительные процессы протекают при электролизе водных растворов в случае активного анода.
4. Что служит материалом для инертных анодов?
5. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора и расплава гидроксида натрия.
6. Написать уравнения электродных процессов, протекающих при электролизе водных растворов хлорида железа (III) и нитрата кальция c инертным анодом.
7. Применение электролиза. Ответ поясните на конкретных примерах.
Тема 9. Металлы.
Самостоятельное изучение теоретического материала: Кристаллическое строение металлов.
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Взаимодействие металлов с кислотами».
Вопросы для самоконтроля:
1. Почему при опускании стальных образцов в раствор, содержащий ионы меди, на образцах осаждается медь?
2. Объясните причину нахождения некоторых металлов в природе в свободном состоянии.
3. Если в руде массовая доля халькопирита ( 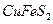 ) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
4. Какие примеси перейдут в раствор, а какие в анодный шлам при электрохимическом рафинировании меди, содержащей марганец, цинк и золото?
5. Напишите реакции восстановления оксида хрома (III) алюминием и хлорида титана (IY) магнием.
Тема 10. Коррозия металлов.
Самостоятельное изучение теоретического материала: Способы защиты металлов от коррозии.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Термодинамика электрохимической коррозии».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Коррозия металлов».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Тема 11. Неметаллы.
Самостоятельное изучение теоретического материала: Материалы, используемые в отрасли.
Вопросы для самоконтроля:
1. Нахождение неметаллов в природе.
2. Какую низшую и высшую степень окисления проявляют углерод, хлор, азот, фосфор, сера и йод? Почему? Укажите возможные степени окисления. Приведите примеры соединений этих элементов в различных степенях окисления.
3. Какая из галогеноводородных кислот - наиболее сильный восстановитель? По-
чему?
4. Приведите электронные структуры атомов азота, серы, мышьяка, кремния, хлора, криптона. К какому электронному семейству относятся эти элементы?
Тема 12. Полимеры.
Самостоятельное изучение теоретического материала: Структура макромолекул: линейные, разветвленные, сетчатые.
Вопросы для самоконтроля:
1. Реакции полимеризации. Приведите примеры полимеров, получаемых реакциями полимеризации.
2. Реакции поликонденсации. Приведите примеры полимеров, получаемых реакциями поликонденсации.
3. Состав и применение лакокрасочных материалов.
4. Состав и применение пластмасс.
5. Состав и применение материалов на основе синтетических каучуков. Вулканизация каучука. Резины.
6. Состав и применение полимерного стекла.
4. Рекомендации по изучению дисциплины
4.1 Рекомендации по изучению дисциплины для студентов очной и очно-заочной форм обучения
Изучение дисциплины осуществляется в течение одного семестра.
При изучении дисциплины «Химия» студентам целесообразно выполнять следующие рекомендации:
1. Изучение курса должно вестись систематически и сопровождаться составлением подробного конспекта. В конспект рекомендуется включать все виды учебной работы: материалы лекций, практических занятий, самостоятельную проработку учебников и рекомендуемых источников;
2. После изучения какого-либо раздела по учебнику или материалам лекций, практических занятий, рекомендуется по памяти воспроизвести основные термины, определения, понятия;
3. Особое внимание следует уделить выполнению практических занятий и лабораторных работ, поскольку это способствует лучшему пониманию и закреплению теоретических знаний; перед выполнением практических занятий и лабораторных работ следует изучить необходимый теоретический материал;
4. Тематика вопросов, изучаемых самостоятельно, задается преподавателем на лекциях, практических занятиях, им же даются источники для более детального понимания вопросов.
4.2. Рекомендации по изучению дисциплины и выполнению контрольных работ для студентов заочной формы обучения
Изучение дисциплины «Химия» студентами заочной формы обучения состоит из цикла установочных лекций, лабораторных и практических занятий, выполнения контрольной работы в межсессионный период и сдачи зачета.
Начинать самостоятельной изучение дисциплины в межсессионный период необходимо анализа рабочей программы курса и подбора рекомендуемой литературы. После изучения каждой темы рекомендуется составлять краткий конспект. При записи формул приводить принятые обозначения и размерности, входящих в расчетные формулы величин.
Усвоив основные теоретические положения отдельных тем курса, студент может переходить к решению задач и выполнению контрольной работы.
Контрольная работа выполняется каждым студентом в отдельности в соответствии с вариантом, выданным преподавателем в период установочной сессии. В контрольную работу включены задания по основным темам дисциплины.
При решении каждой задачи следует внимательно прочесть текст, переписать условие задачи, привести ход решения со всеми математическими преобразованиями. Решение задачи должно сопровождаться краткими пояснениями.
Контрольная работа оформляется либо в рукописном варианте аккуратным и разборчивым почерком в ученических тетрадях в клетку или в печатном варианте на листах формата А4. Работа должна содержать титульный лист (приложение А), иметь поля для замечаний преподавателя, рецензирующего контрольную работу.
Выполненная контрольная работа регистрируется в деканате ВПО, передается для проверки преподавателю деканатом. При необходимости, работа возвращается студенту на доработку вновь через деканат.
Контрольная работа с отметкой «зачтено» сохраняется у преподавателя до проведения зачета.
4.3 Советы по подготовке к зачету и порядок проведения зачета
При подготовке к зачету следует внимательно изучить теоретический материал, просмотреть отчеты по практическим занятиям и лабораторным занятиям по дисциплине.
Зачет устанавливается как форма итоговой аттестации по дисциплине. Зачет охватывает содержание дисциплины, изучаемой в течение семестра. Сроки и место проведения зачета планируется расписанием экзаменационной сессии.
Зачет по дисциплине «Химия» может быть выставлен по итогам проведенного текущего контроля, при выполнении и успешной защите заданий практических занятий и лабораторных работ, а также заданий, выданных преподавателем для самостоятельной работы.
При недостаточном охвате всех модулей дисциплины предыдущим контролем во время зачёта может проводиться дополнительный контроль в форме собеседования.
Результат сдачи зачёта оценивается в режиме «зачтено» и «не зачтено». Запись «зачтено» заносится в экзаменационную ведомость и зачётную книжку студента, запись «не зачтено» выставляется только в экзаменационную ведомость.
Типовые вопросы для подготовки к зачету по дисциплине
1. Предмет химии. Значение химии в изучении природы и развитии техники. Роль химии для данной специальности.
2. Важнейшие классы неорганических соединений: оксиды, кислоты, основания, соли. Классификация, номенклатура, получение, свойства. Комплексные соединения: строение, номенклатура.
3. Квантово-механические представления об электронной структуре атомов.
4. Периодический закон и периодическая система Д.И.Менделеева в свете учения о строении атома.
5. Зависимость свойств элементов и их соединений от строения атома.
6. Ионная связь, образование соединений с ионной связью.
7. Ковалентная связь, способы образования ковалентной связи. Метод валентных связей.
8. Пространственная структура молекулярного явления гибридизации.
9. Водородная связь, агрегатное состояние веществ.
10. Металлическая связь. Физические и химические свойства металлов.
11. Водородная связь, образование водородной связи.
12. Аморфное и кристаллическое состояние твёрдых тел. Строение твёрдого тела. Классификация кристаллов по характеру химической связи.
13. Энергетика химических процессов. Внутренняя энергия и энтальпия.
14. Энтропия, ее изменение при химических реакциях.
15. Энергия Гиббса и направленность химических процессов.
16. Скорость гомогенных и гетерогенных химических реакций. Закон действия масс.
17. Факторы, влияющие на скорость химической реакции.
18. Энергия активации. Уравнение Аррениуса.
19. Каталитические системы и катализаторы. Механизмы гомогенного и гетерогенного катализа.
20. Химическое равновесие. Константа химического равновесия и её связь с термодинамическими функциями. Смещение равновесия. Принцип Ле-Шателье.
21. Растворы. Классификация растворов. Способы выражения концентрации растворов. Дисперсные системы.
22. Теория электролитической диссоциации. Диссоциация сильных и слабых электролитов. Закон разбавления Оствальда.
23. Ионные уравнения реакций.
24. Ионное произведение воды. Водородный показатель среды.
25. Окислительно-восстановительные процессы. Степень окисления. Составление уравнений ОВР ионно-электронным методом с учетом рН среды.
26. Электрохимические процессы. Уравнение Нернста.
27. Гальванический элемент. Анодные и катодные процессы. Условная схема гальванического элемента, ЭДС и ее измерение.
28. Электролиз растворов и расплавов электролитов. Применение электролиза.
29. Физические и химические свойства металлов. Взаимодействие металлов с кислотами: соляной, серной, азотной.
30. Основные виды коррозии металлов. Кислородная и водородная деполяризация. Термодинамика коррозионных процессов. Методы защиты от коррозии: легирование, электрохимическая защита, защитные покрытия.
31. Физические и химические свойства неметаллов.
32. Материалы, используемые в отрасли. Их состав и свойства.
33. Органические полимерные материалы. Получение полимеров. Свойства полимеров: химические, механические, электрические.
34. Применение полимеров в отрасли.
5. Варианты контрольных работ для студентов заочной формы обучения
Основные законы химии
1. Какова масса 5,6 л. (н.у.) углекислого газа? Сколько молекул содержится в этом объеме газа?
2. Каков объем 128 г. сернистого газа при н. у.? Сколько молекул содержится в 128 г. этого газа?
3. Найдите массу кислорода, содержащегося в баллоне объемом 50 л. при температуре 25ºС и давлении 790 кПа.
4. При нормальных условиях 22,4 л. чистого воздуха имеют массу 29 г. Эта масса условно считается средней молярной массой воздуха. Рассчитайте относительную плотность по воздуху следующих газов: водорода 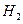 , азота
, азота 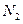 , угарного газа СО, пропана
, угарного газа СО, пропана 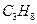 , бутана
, бутана 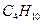 .
.
5. Какой объем займет 1 кг воздуха при 17 ºС и давлении 101,3 кПа?
6. Сколько водорода выделится при взаимодействии 56 г. цинка с соляной кислотой?
7. Сколько тепла необходимо в соответствии с термохимическим уравнением: FeO(к) + H2(г) = Fe(к) + H2O(г) , (ΔН = 23 кДж) для получения 560 г Fe.
8. При 17ºС некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 100ºС, если давление его останется неизменным?
9. При некоторой температуре давление газа, занимающего объем 3 л равно 93,3 кПа. Каким станет давление, если, не изменяя температуры, уменьшить объем газа до 2,8 л?
10. Приведите объем газа к нормальным условиям, если при температуре 373 К и давлении  Па его объем равен
Па его объем равен 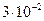 м³.
м³.
11. Газовая смесь приготовлена из 0,03 м³ метана, 0,04 м³ водорода и 0,01 м³ окиси углерода (II). Исходные давления метана, водорода и окиси углерода (II) составили соответственно 96, 84, 108,8 кПа. Объем смеси равен 0,08 м³. Определить парциальные давления газов и общее давление газовой смеси.
12. Сухой воздух имеет примерно следующий состав: азот - 78,09%, кислород – 20,95%, аргон – 0,93%, углекислый газ – 0,03%. Определить массу 40 м³ сухого воздуха при нормальных условиях.
13. Плотность газа по воздуху равна 1,17. Определить молярную массу газа.
14. Определить объем, занимаемый 0,07 кг азота при 21 ºС и давлении 142 кПа.
15. Вычислить массу:
а) 2 л водорода при 15 ºС и давлении 100,7 кПа (755 мм рт. ст.);
б) 1 м³ азота при 10 ºС и давлении 102,9 кПа (772 мм рт. ст.);
в) 0,5 м³ хлора при 20 ºС и давлении 99,9 кПа (749,3 мм рт. ст.);
Строение атома
Задание 1.
Запишите электронную конфигурацию элементов с порядковыми номерами:
| № варианта | Задание |
| 1 | 8, 19, 39 |
| 2 | 9, 20, 40 |
| 3 | 10, 37, 41 |
| 4 | 11, 32, 42 |
| 5 | 12, 33, 43 |
| 6 | 13, 37, 44 |
| 7 | 14, 38, 45 |
| 8 | 4, 31, 46 |
| 9 | 15, 47, 55 |
| 10 | 16, 26, 37 |
| 11 | 17, 27, 38 |
| 12 | 12, 34, 48 |
| 13 | 19, 25, 50 |
| 14 | 20, 35, 51 |
| 15 | 18, 30, 38 |
Задание 2.
1. Укажите положение в Периодической таблице элементов с порядковыми номерами № 21, 32, 44 (период, группа, подгруппа).
2. Покажите распределение электронов по ячейкам для атома Si и иона Si2+. Подсчитайте для них ковалентность.
3. Что характеризует магнитное квантовое число? Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 2? l = 3? Ответ поясните.
4. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n = 4? Ответ поясните.
5. Покажите распределение электронов по ячейкам для атома Mn и иона Mn2+. Подсчитайте для них ковалентность.
6. Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
7. Перечислить электронные аналоги элементов 6 группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов.
8. У элементов каких периодов электроны валентного слоя характеризуются значениями n + l = 5? Ответ поясните.
9. Сколько неспаренных электронов содержат невозбужденные атомы бора, серы, мышьяка, хрома, ртути? Напишите электронные формулы и графические схемы электронного строения атомов элементов.
10. Сколько электронов может разместиться на s -, p -, d - и f -подуровнях. Ответ обоснуйте с точки зрения квантовых чисел.
11. Составить электронную формулу атома кремния и графическую схему заполнения электронами валентных орбиталей этого атома в нормальном и в возбужденном состояниях.
12. Какой подуровень будет заполняться вслед за подуровнем 4 s? Ответ обоснуйте в соответствии с правилом Клечковского.
13. Укажите положение в Периодической таблице элементов с порядковыми номерами № 17, 38, 69 (период, группа, подгруппа).
14. У какого элемента начинает заполняться подуровень 4 f ? У какого элемента завершается заполнение этого подуровня? К какому электронному семейству относятся эти элементы, какое название они имеют?
15. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны, ответ поясните.
1) 1s22s22p53s1
2) 1s22s22p6
3) 1s22s22p63s23p63d4
4) 1s22s22p63s23p64s2
Химическая связь
1. Указать тип и образование химической связи в молекулах хлорида калия, хлора, иодоводорода.
2. Указать тип и образование химической связи в молекулах иодида натрия, воды, азота.
3. Определите пространственную структуру молекул С H 4 и BH 3. Ответ поясните графическими схемами.
4. Указать тип и образование химической связи в молекулах сероводорода, углекислого газа, четыреххлористого углерода.
5. Приведите два примера соединений с тетраэдрическим строением молекул, укажите тип гибридизации атомных орбиталей. Ответ поясните.
6. Приведите два примера соединений с линейным строением молекул, укажите тип гибридизации атомных орбиталей. Ответ поясните.
7. Приведите два примера соединений со строением молекул в виде треугольника с углом между связями 120º, укажите тип гибридизации атомных орбиталей. Ответ поясните.
8. Какой характер имеют связи в молекулах NCl 3 , CS 2, NF 3, OF 2, CO 2? Указать для каждой из них направление смещения общей электронной пары.
9. Составить валентную схему молекулы хлороформа СНС l 3 и указать:
а) какая связь наиболее полярна;
б) в каком направлении смещено электронное облако этой связи.
10. Указать тип химической связи в молекуле воды. Почему молекулы воды полярны? Какими уникальными свойствами обладают молекулы воды?
11. Чем обусловлена металлическая связь? Какими свойствами обладают металлы благодаря металлической связи?
12. Описать пространственное строение молекулы хлорида бериллия. Какие атомные орбитали участвуют в образовании связей Ве – Cl?
13. Указать тип гибридизации атомных орбиталей кремния в молекулах SiH 4 и SiF 4. . Ответ поясните графическими схемами.
14. Как с точки зрения существования водородных связей объясняется жидкое агрегатное состояние вещества?
15. Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов. А не в виде отдельных молекул. Приведите примеры соединений, образованных ионной связью.
Химическая термодинамика
1. Не производя вычислений, определить знак изменения энтропии в следующих реакциях, ответ обоснуйте:
NH 4 NO 3(к) ═ N 2 O (г) + 2 H 2 O (г)
2 H 2(г) + O 2(г) ═ 2 H 2 O (г)
2 H 2(г) + O 2(г) ═ 2 H 2 O (ж)
2. Рассчитать ∆Gо298 химической реакции: Fe 2 O 3(к) + 3 H 2(г) ═ 2 Fe (к) + 3 H 2 O (г) и определить, выше какой температуры возможен прямой процесс.
3. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
NiO (к) + Pb (к) = Ni (к) + PbO (к)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
4. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
СаСО3(к) = СаО(к) + СО2(г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
5. Не производя вычислений, определить знак изменения энтропии в следующих реакциях, ответ обоснуйте:
2 H 2 S (г) + 3 O 2(г) = 2 H 2 O (ж) + 2 SO 2(г)
4 H С l (г) + О2(г) = 2С l 2(г) + 2 H 2 O (г)
2 CH 3 OH (г) + 3 O 2(г) = 4 H 2 O (г) + 2 CO 2(г)
6. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
2 NO (г) + O 2(г) = 2 NO (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
7. Вычислите, сколько теплоты выделится при сгорании 165 л. (н.у.) ацетилена, если продуктами сгорания являются диоксид углерода и вода.
8. Определить возможность протекания реакции при стандартных условиях и рассчитать температуру начала реакции: 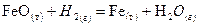
9. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
2 H 2 S (г) + 3 O 2(г) = 2 S О2(г) + 2 H 2 O (ж)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
10. Вычислите ΔGº298, ΔHº298 и ΔSº298 для реакции:
С2Н4 (г) + 3О2 = 2СО2 (г) + 2Н2О (г).
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Рассчитайте тепловой эффект сгорания 5 л. этилена.
11. Восстановление Fe3O4 оксидом углерода протекает по уравнению:
Fe 3 O 4 (к) + СО (г) = 3 FeO (к) + СО2 (г)
Вычислите ΔGº298 и сделайте вывод о возможности самопроизвольного протекания этого процесса при стандартных условиях. При какой температуре начнется реакция восстановления Fe3O4?
12. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
TiO 2 (к) + 2 C (к) = Ti (к) + 2СО (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Возможна ли реакция восстановления TiO2 углеродом при 1000 и 3000К?
13. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
4 NH 3 (г) + 5 O 2 (г) = 4 NO (г) + 6 H 2 O (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Возможна ли данная реакция при 250ºС?
14. Не производя вычислений, установить знак ΔSº298 процесса, ответ обоснуйте:
MgO (к) + H 2(г) = Mg (к) + H 2 O (ж)
С(графит) + СО2(г) = 2СО(г)
4 H С l (г) + О2(г) = 2С l 2(г) + 2 H 2 O (г)
15. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
Al2O3 (k) + 3SO3( г ) = Al2(SO4)3 (k)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Рассчитайте температуру начала реакции.
Скорость химических реакций
1. В газовой фазе протекает обратимая реакция: 2СО + О 2 = 2СО 2 + Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс и определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 4 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия реакции, если равновесные концентрации равны (моль/л): [СО] = 0,2; [О 2 ] = 0,1; [СО 2 ] = 0,3.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
2. Температурный коэффициент скорости реакции равен 2. Рассчитайте, как изменится скорость реакции, если:
а) увеличить температуру в системе с 10ºС до 40ºС;
б) уменьшить температуру в системе с 50ºС до 10ºС?
3. При повышении температуры скорость химической реакции увеличилась в 8 раз, температурный коэффициент данной реакции равен 2. На сколько градусов повысили температуру в системе?
4. Как изменится скорость реакции 2 NO (г) + Cl 2(г) ↔ 2 NOCl (г) , если:
а) увеличить давление в реакционном сосуде в два раза;
б) уменьшить объём сосуда в 4 раза?
5. Равновесие гомогенной системы 2S O 2 + O 2 = 2 SO 3 установилось при концентрациях реагирующих веществ (моль/дм³): [S O 2 ] = 0,2; [ O 2 ] = 0,1; [S O 3 ] = 0,5. Рассчитайте константу равновесия и исходные концентрации S O 2 и O 2.
6. Напишите уравнение константы равновесия гетерогенной реакции:
SiO 2 (к) +2 H 2 (г) = Si (к) +2 H 2 O (г)
7. Реакция между веществами А и В выражается уравнением 2А + В → С. Начальная концентрация вещества А равна 3,2 моль/л, а вещества В – 1,6 моль/л. Константа скорости реакции 0,75. Какова скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,5 моль/л?
8. В газовой фазе протекает обратимая реакция: СО + 2Н2 = СН3ОН - Q .
Напишите уравнение для скорости прямой реакции согласно закону действующих масс и определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия, если равновесные концентрации равны (моль/л): [СО]=[Н2]=0,1; [СН3ОН]=0,5.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
9. Температурный коэффициент реакции равен 2. Как изменится скорость реакции, если:
а) увеличить температуру в системе с 20ºС до 40ºС;
б) уменьшить температуру в системе с 50ºС до 30ºС?
10. В какую сторону сместится химическое равновесие в системе
CaCO 3(к) ↔ CaO (к) + CO 2(г) ; ∆ H =178,4 кДж/моль
а) при введении в систему углекислого газа;
б) при введении в систему оксида кальция;
в) при увеличении температуры?
11. В газовой фазе протекает обратимая реакция: N 2 + 3 H 2 = 2 NH 3 + Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс. Определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия и первоначальные концентрации исходных веществ, если равновесные концентрации равны (моль/л): [ N 2 ] = 0,1; [ H 2 ] = 0,3; [ NH 3 ] = 0,5.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
12. Температурный коэффициент реакции равен 2. На сколько градусов следует понизить температуру, чтобы уменьшить скорость реакции в 16 раз.
13. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастёт скорость реакции при увеличении температуры в реакционном сосуде с 15 до 38оС?
14. За какое время закончится реакции при 30ºС, если при 10ºС она заканчивается через 20 минут, коэффициент скорости реакции равен 2.
15. В газовой фазе протекает обратимая реакция: 2 N Н3 = N 2 + 3Н2 - Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс. Определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 4 раза
Рассчитайте константу равновесия и первоначальные концентрации исходных веществ, если равновесные концентрации равны (моль/л): [ N Н3] = 0,2; [ N 2 ] = 0,1; [Н2] = 0,3.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
Электролиз растворов
1. Напишите уравнения электролиза следующих солей: хлорид свинца (II), сульфат калия, нитрат серебра.
2. Электролиз раствора иодида натрия проводили при силе тока 6А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде.
3. Электролиз раствора CuSO 4 проводили в течение 4 часов при силе тока 50А. При этом выделилось 224 г. меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на инертных электродах.
4. Напишите уравнения электролиза следующих солей: сульфит натрия, хлорид меди (II), сульфат цинка.
5. Рассчитайте объем выделившегося на аноде хлора при нормальных условиях из раствора хлорида натрия за 10 ч при токе 30 А и выходе хлора по току 90%. Какой процесс протекает при этом на катоде?
6. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях?
7. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов хлорида алюминия, сульфата никеля. В обоих случаях анод угольный.
8. При электролизе раствора сульфата меди (II) на аноде выделилось 168 см³ кислорода, измеренного при нормальных условиях. Сколько граммов меди выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах.
9. Написать уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и нитрата свинца (II) c инертными электродами.
10. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди? Ответ поясните.
11. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 минут.
12. За 10 мин из раствора платиновой соли при токе силой 5 А выделилось 1,517 г платины. Определить молярную массу эквивалента платины.
13. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
14. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора и расплава гидроксида калия.
15. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите молярную массу эквивалента металла. Составьте электронные уравнения процессов, происходящих на электродах.
Гальванический элемент
1. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. Вычислите ЭДС полученных элементов.
2. Рассчитайте ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их сульфатов с концентрацией 0,01 моль/л.
3. Рассчитайте ЭДС гальванического элемента Mg | Mg ( NO 3 )2|| Al ( SO 4 )3| Al, если концентрация ионов магния и алюминия в растворах равны 0,01 моль/л и 0,001 моль/л соответственно.
4. Составить схемы двух гальванических элементов, в одном из которых железо служило бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
5. Определить ЭДС гальванического элемента: А g |А gNO 3 (0,001М)|| А gNO 3 (0,1М)| А g . В каком направлении будут перемещаться электроны во внешней цепи при работе этого элемента?
6. Рассчитать электродные потенциалы Mg в растворе его соли при концентрациях иона 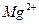 0,1моль/л; 0,01 моль/л и 0,001 моль/л.
0,1моль/л; 0,01 моль/л и 0,001 моль/л.
7. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли ЭДС, если взять 0,001 М растворы? Ответ обосновать.
8. Магниевую пластинку опустили в раствор его соли, при этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния в моль/л.
9. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) нитрата серебра, б) сульфата цинка, в) сульфата никеля. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
10. Составить схемы двух гальванических элементов, в одном из которых олово служило бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
11. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
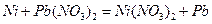
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если 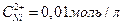 ,
, 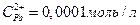 .
.
12. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на катоде и на аноде.
13. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией 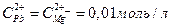 . Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
14. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией 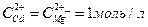 . Изменится ли величина ЭДС этого элемента, если концентрацию каждого из ионов понизить до 0,01 моль/л?
. Изменится ли величина ЭДС этого элемента, если концентрацию каждого из ионов понизить до 0,01 моль/л?
15. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Металлы
1. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: 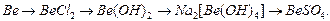
2. Напишите уравнение реакции натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
3. Являясь сильными восстановителями, магний, кальций и барий применяются в металлотермии для получения металлов из их оксидов. Составьте электронные и молекулярные уравнения реакций кальция: а) с CaS 04; б) с V 2 O 5 . В каждой из этих реакций окислитель восстанавливается максимально.
4. Осуществите следующие превращения:
Bi → Bi ( NO 3 )3 → NaBiO 3 → Bi 2 ( SO 4 )3 → Bi, имея реактивы: KNO 3 , MnSO 4 , HNO 3 , H 2 SO 4 , Zn , NaOH .
5. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Ca → CaH 2 → Ca ( OH )2 → CaCO 3 → Ca ( HCO 3 )2.
6. Как изменяются химические свойства металлов главной подгруппы II группы элементов с увеличением порядкового номера? В чем заключаются эти изменения и чем они обусловлены?
7. Приведите электронные конфигурации железа и марганца. Укажите возможные степени окисления и приведите примеры соединений. Как ведут себя Fe и М n по отношению к разбавленным растворам кислот H 2 SO 4 и HNO 3?
8. Составьте уравнение взаимодействия К2С r 2 О7 и концентрированной соляной кислоты. Какой объем раствора соляной кислоты (C – 36%, 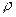 = 1180 кг/м3), необходим для получения 11,2 л Cl2?
= 1180 кг/м3), необходим для получения 11,2 л Cl2?
9. Как влияет повышение степени окисления марганца на свойства его оксидов и гидроксидов? Какие свойства проявляют гидроксид марганца (+4)?
10. Осуществите превращения: Pb → Pb ( NO 3 )2 → Pb ( OH )2 → Na 2 [ Pb ( OH )4] → PbO 2 → PbSO 4 .
11. Осуществите следующие превращения: Sn → SnCl 2 → SnCl 4 → Na 2 [ Sn ( OH )6] → SnCl 4
12. Олово растворяется в концентрированной соляной кислоте, тогда как растворение свинца в соляной кислоте идет с трудом. Чем это можно объяснить? Составьте уравнения реакций растворения свинца в концентрированном растворе NaOH, а олова в концентрированной азотной кислоте. Для последней реакции рассчитайте ЭДС.
13. Приведите электронные конфигурации С r и Мо. Укажите возможные степени окисления элементов и приведите примеры соединений. Какие степени окисления устойчивы для С r и Мо? Как ведут себя С r и Мо по отношению к концентрированным соляной и азотным кислотам? Почему молибден легче всего взаимодействует со смесью кислот HF и HNO 3? Составьте уравнения реакций.
14. Закончите равнения реакций:
Fe + H 2 SO 4 (разб.) →
Fe ( OH )3 + HCl (конц.) →
Fe + HNO 3 (разб.) →
15. Осуществите следующие превращения:
ZnSO 4

Zn → Na 2 [ Zn ( OH )4] → ZnCl 2 → Zn
 |
Zn ( NO 3 )2
Коррозия металлов
1. Каков состав продукта коррозии оцинкованного железа в сернокислой среде при нарушении покрытия? Ответ поясните.
Неметаллы
1. Какие вещества образуются при пропускании через раствор аммиака следующих газов: СО2, NO , NO 2 , SO 2 , SO 3 ?
2. Напишите электронные структуры атомов N и С. Укажите возможные степени окисления элементов. Приведите примеры соединений в разных степенях окисления.
3. Сравните кислотные свойства азотистой и угольной кислот. Определите степень диссоциации 0,01 М растворов и рН растворов. Диссоциацией угольной кислоты по второй стадии пренебречь.
4. Осуществите следующие превращения: H 2 S → S → Na 2 SO 3 → Na 2 S 2 O 3 → Na 2 S 4 O 6, имея следующие реактивы: H 2 O , NaOH , KMnO 4 , S , I 2 .
5. Напишите электронные структуры атомов N и Р. Укажите возможные степени окисления. Приведите примеры соединений в различных степенях окисления.
6. Осуществите следующие превращения: PH 3 → H 3 PO 3 → H 3 PO 4 → PH 3, имея следующие реактивы: K 2 Cr 2 O 7 , Mg , H 2 SO 4 , O 2 .
7. Осуществите следующие превращения:
S → H2S → SO2 → Na2SO3
 |  |
Na2S2O3 Na2SO4
Назовите соединения, определите степень окисления серы.
8. Закончите уравнения реакций:
I 2 + Cl 2 + H 2 O →
KI + KNO 2 + H 2 SO 4 →
I 2 + HNO 3 →
I 2 + H 2 O →
9. Приведите электронные структуры атомов F и В r . Укажите возможные степени окисления. Приведите примеры соединений в различных степенях окисления.
10. Дайте сравнительную характеристику кислотных свойств бромноватистой, бромноватой и бромной кислот. Определите рН для 0,01 М растворов бромноватистой и бромноватой кислот.
11. Осуществите следующие превращения: KBr → Br 2 → K В rO 3 → Br 2 → KBrO , имея реактивы: H 2 O , KOH , H 2 SO 4 , KMnO 4 , HBr .
12. Как получают фтористый водород? Почему раствор HF в воде является значительно более слабой кислотой, чем остальные галогеноводородные кислоты? Почему нельзя сохранять плавиковую кислоту в стеклянных сосудах? Составьте уравнения соответствующих реакций.
13. Осуществите следующие превращения:
FeS 2 → SO 2 → SO 2 Cl 2 → H 2 SO 4
SO 3 → H 2 SO 4
14. Чем объяснить восстановительные свойства сероводорода? Составьте электронные и молекулярные уравнения реакций сероводорода:
а) с хлором;
б) с HIO3.
15. Напишите электронные структуры атомов C и Si. Укажите возможные степени окисления. Приведите примеры соединений в различных степенях окисления.
Полимеры
1. Относительная молекулярная масса бутадиенового каучука равна 80 000 – 450 000. Определите степень полимеризации бутадиенового каучука.
2. Полиэтилен высокого давления имеет относительную молекулярную массу 45 000, а полиэтилен низкого давления – 300 000. Определите степень полимеризации полиэтилена.
3. Нитрон или акрилон - синтетическое волокно, заменяющее шерсть, получают из акрилонитрила СН2=СН-СN. Составьте схему получения полиакрилонитрила.
4. Полиамидное волокно энант, отличающееся от капрона большей светостойкостью, получается из продукта поликонденсации аминоэнантовой кислоты, формула которой H2N – (CH2)6 – COOH. Составьте уравнение поликонденсации этой кислоты.
5. Полимеризацией хлорпрена CH2=CH – C = CH2 получают хлоропреновый
|
Cl
каучук, характеризующийся высокой устойчивостью к действию света, теплоты и растворителей. Составьте уравнение полимеризации хлоропрена и формулу структурного звена полимера.
6. Совместной полимеризацией бутадиена–1,3 и стирола получают бутадиен-стирольный каучук, обладающий высокой механической прочностью. Составьте уравнение реакции полимеризации.
7. Относительная молекулярная масса бутадиенового каучука равна 80 000 – 450 000. Определите степень полимеризации бутадиенового каучука.
8. Вычислите степень полимеризации полипропилена, приняв среднюю молекулярную массу его равную 100 000.
9. Одной из важнейших пластмасс является полистирол, который используют для изготовления одноразовой посуды и упаковки пищевых продуктов. Исходным мономером для его получения служит стирол (винилбензол). Напишите уравнение реакции получения полистирола. Как называется этот процесс?
10. Распределите на группы высокомолекулярные соединения в соответствии с предложенной классификацией: изопреновый каучук, натуральный шелк, полиэтилен, вискоза, натуральная шерсть, хлопок, поливинилхлорид, бутадиеновый каучук, ацетатный шелк, каучук, полистирол, поливинилхлорид.
| Классификационные характеристики | Полимеры |
| Полученные реакциями полимеризации | |
| Полученные реакциями поликонденсации | |
| Синтетические | |
| Природные |
11. Сравните крахмал и целлюлозу по их происхождению и свойствам. Значение этих углеводов для человека.
12. Какие реакции лежат в основе получения полимеров? Приведите примеры полимеров, получаемых этими способами.
13. Какие материалы называют пластмассами? На какие группы они делятся по способу получения и по отношению к нагреванию. Приведите примеры пластмасс и кратко охарактеризуйте области их применения.
14. Какие полимерные материалы называют волокнами? Какие группы волокон по происхождению вы знаете? Приведите примеры волокон различных групп, кратко охарактеризуйте области их применения.
15. Как объяснить отсутствие летучести у высокомолекулярных соединений? Ответ поясните на конкретных примерах.
Список рекомендуемой литературы
Основная литература
1. Коровин, Н.В. Общая химия: учебник для вызов /Н.В. Коровин. - М.: Высшая школа», 1998. – 559 с.: ил.
2. Коровин, Н.В. Общая химия: учебник для вузов /Н.В. Коровин. 2-е изд. - М.: Высшая школа, 2000. – 559 с.: ил.
3. Ахметов Н.С. Общая и неорганическая химия: учебник для вызов / Н.С. Ахметов - М.: Высшая школа, 1998. – 743 с.: ил.
Дополнительная литература
Вольхин В.В. Общая химия. Книга 1. Основной курс: учеб. пособие в 3х кн. / В.В. Вольхин. – Пермь: ПГТУ, 2006. – 464.
Электронные ресурсы
Гельфман М.И. Химия: учебник/М.И. Гельфман, В.П. Юстратов. – Москва: Лань, 2008. – Режим доступа: http://elib.pstu.ru/vufind/Record/4030
Приложение А – Образец титульного листа контрольной работы
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Пермский национальный исследовательский политехнический университет»
Лысьвенский филиал
Направление:
КОНТРОЛЬНАЯ РАБОТА
по дисциплине: «Химия»
Вариант № ______
Выполнил:
студент группы ___________________
шифр ____________________________
Ф.И.О. студента ___________________
«____» ______________ 20___ г.
_________________________________
(подпись студента)
Проверил:
Ф.И.О. преподавателя _____________
Оценка __________________________
_________________________________
(подпись преподавателя)
«___» ____________ 20___ г.
Лысьва 20___ г.
Приложение Б – Образец задания на выполнение контрольной работы
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Пермский национальный исследовательский политехнический университет»
Лысьвенский филиал
Направление:
Задание на выполнение контрольной работы
по дисциплине «Химия»
Ф.И.О. студента ______________________________________
Курс _____________ Группа № ______________
Вариант контрольной работы № ________
Рецензия на выполненную студентом контрольную работу:
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка: __________________
Зачет/незачет
Подпись преподавателя: _______________ (__________________)
Дата проверки: «___» _________ 20___ г.
Лысьвенский филиал
Кафедра технических дисциплин
УЧЕБНО-МЕТОДИЧЕСКИЙ КОМПЛЕКС ДИСЦИПЛИНЫ
«ХИМИЯ»
основной образовательной программы подготовки бакалавров
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по организации, выполнению и контролю
самостоятельной работы студентов
Лысьва 2017 г.
Методические указания по организации, выполнению и контролю самостоятельной работы студентов составлены на основании рабочих программ дисциплины «Химия» для студентов всех форм обучения направлений: 08.03.01 «Строительство», 13.03.02 «Электроэнергетика и электротехника», 15.03.05 «Конструкторско-технологическое обеспечение машиностроительных производств», 23.03.03 «Эксплуатация транспортно-технологических машин и комплексов», 44.03.04 «Профессиональное обучение (по отраслям)».
Разработчик-составитель методических указаний: доцент кафедры технических дисциплин С.Н. Ваганова, ЛФ ПНИПУ, 2017 год.
Методические указания по организации, выполнению и контролю самостоятельной работы студентов утверждены на заседании кафедры технических дисциплин «___» ________ 2017 года, протокол № ___
Содержание
1. Общие положения 4
2. Виды самостоятельной работы студентов по дисциплине 5
3. Рекомендации по организации самостоятельной работы студентов
по темам дисциплины 7
4. Рекомендации по изучению дисциплины 14
5. Варианты контрольных работ для студентов заочной формы обучения 17
6. Список рекомендуемой литературы 33
Приложение А - Образец титульного листа контрольной работы 34
Приложение Б - Образец задания на выполнение контрольной работы 35
Общие положения
Цель дисциплины: развитие и углубление знаний по химическим законам и теориям как составной части подготовки студентов по фундаментальным наукам; формирование у студентов целостного естественнонаучного мировоззрения; формирование осознанной необходимости химических знаний при решении профессиональных и экологических задач в условиях обострения отношений человек – окружающая среда.
Задачи дисциплины:
- изучение основополагающих химических понятий, теорий, законов, закономерностей протекания химических реакций, химической терминологии и символики;
- формирование умения производить расчеты по химическим формулам и уравнениям, давать их качественную или количественную оценку;
- формирование умения получать справочную информацию, необходимую для решения конкретных химических задач, с помощью различных источников, включая электронные ресурсы;
- освоение основных методов научного познания, используемых в химии: наблюдение, описание, измерение, эксперимент, формирование способности применять методы познания при решении практических задач;
- формирование умения обрабатывать, объяснять результаты и делать выводы на основании проведенных опытов и экспериментов;
- овладение правилами техники безопасности при использовании химических веществ;
- формирование химически грамотного поведения в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
- формирование умения использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
- формирование чувства гордости, уважения к истории и достижениям отечественной химии.
Место учебной дисциплины в структуре образовательной программы
Дисциплина «Химия» относится к базовой части дисциплин блока 1 «Дисциплины (модули)» при освоении ОПОП по направлениям подготовки: 08.03.01 «Строительство», 13.03.02 «Электроэнергетика и электротехника», 15.03.05 «Конструкторско-технологическое обеспечение машиностроительных производств», 23.03.03 «Эксплуатация транспортно-технологических машин и комплексов», 44.03.04 «Профессиональное обучение (по отраслям)».
В результате изучения дисциплины студент должен демонстрировать следующие планируемые результаты обучения:
Знать:
– основные химические законы и теории, общие закономерности протекания химических процессов;
– строение и состав веществ, химическую связь в них;
– классификацию и свойства химических элементов, веществ и соединений;
– назначение и области применения основных химических веществ и соединений.
Уметь:
– использовать основные элементарные методы химического исследования веществ и соединений, проводить измерения, обрабатывать и представлять результаты эксперимента;
– составлять и анализировать химические уравнения;
– соблюдать меры безопасности при работе с химическими реактивами;
– применять химические законы для решения практических задач.
Предметом освоения дисциплины являются:
– вещество, его строение, свойства, превращение, идентификация и анализ;
– химические процессы и общие закономерности их протекания;
– химические системы и смещение равновесия в них.
2. Виды самостоятельной работы студентов по дисциплине
Изучение дисциплины «Химия» предусматривает самостоятельную проработку части программного материала по материалам учебников и рекомендованной литературе, а также подготовку к практическим занятиям, лабораторным работам, оформление отчетов по практическим занятиям и лабораторным работам, выполнение индивидуальных заданий, а также выполнение контрольных работ (для студентов заочной формы обучения).
2.1. Виды самостоятельной работы студентов
Очная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 2 | Самостоятельное изучение теоретического материала | 2 |
| Выполнение индивидуального задания | 2 | |
| 3 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 6 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 7 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическим занятиям и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 9 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| 10 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 1 | |
| Подготовка к лабораторной работе и оформление отчета | 1 | |
| Выполнение индивидуального задания | 2 | |
| 11 | Самостоятельное изучение теоретического материала | 2 |
| 12 | Самостоятельное изучение теоретического материала | 2 |
| Итого в ч / в ЗЕ | 54/1,5 |
Очно-заочная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 5,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 2 | Самостоятельное изучение теоретического материала | 2,5 |
| Выполнение индивидуального задания | 2 | |
| 3 | Самостоятельное изучение теоретического материала | 2 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 1,5 |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| 6 | Самостоятельное изучение теоретического материала | 1,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 7 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 4 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 9 | Самостоятельное изучение теоретического материала | 6 |
| 10 | Самостоятельное изучение теоретического материала | 6 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| Выполнение индивидуального задания | 2 | |
| 11 | Самостоятельное изучение теоретического материала | 2,5 |
| 12 | Самостоятельное изучение теоретического материала | 3,5 |
| Итого в ч / в ЗЕ | 81/2,25 |
Заочная форма обучения
| Номер темы (раздела) дисциплины | Вид самостоятельной работы студентов | Трудоёмкость, часов |
| 1 | 2 | 3 |
| 1 | Самостоятельное изучение теоретического материала | 9 |
| 2 | Самостоятельное изучение теоретического материала | 4,5 |
| 3 | Самостоятельное изучение теоретического материала | 7,5 |
| Подготовка к лабораторной работе и оформление отчета | 2 | |
| 4 | Самостоятельное изучение теоретического материала | 8,5 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 5 | Самостоятельное изучение теоретического материала | 6 |
| 6 | Самостоятельное изучение теоретического материала | 10,5 |
| 7 | Самостоятельное изучение теоретического материала | 12 |
| Подготовка к практическому занятию и оформление отчета | 2 | |
| 8 | Самостоятельное изучение теоретического материала | 9,5 |
| 9 | Самостоятельное изучение теоретического материала | 5,5 |
| 10 | Самостоятельное изучение теоретического материала | 10,5 |
| 11 | Самостоятельное изучение теоретического материала | 1,5 |
| 12 | Самостоятельное изучение теоретического материала | 3 |
| Итого в ч / в ЗЕ | 94/2,6 |
3. Рекомендации по организации самостоятельной работы студентов
по темам дисциплины
Приступая к изучению дисциплины, студенты должны иметь рекомендованную учебную литературу.
Дата: 2019-11-01, просмотров: 651.