Задание 1
Назовите следующие соединения:
| № варианта | Задание |
| 1 | H2SO4, Al(OH) С l2 , CaO, Fe SO4, NaNO3 |
| 2 | C а HPO4, K2Cr2O7, BaO, K2 SO4, BaCl2 |
| 3 | HCl, Ca(OH)2, FeO, KCl, NaNO2 |
| 4 | HNO2, Ba(OH) С l, N2O3, Ca SO3, NaCl |
| 5 | HNO3, Al(OH)3, Na2O, Fe( ОН )Cl, K2SO3 |
| 6 | H2SO3, Fe(OH)3, SO2, K2НPO4, Na2SO4 |
| 7 | H2SO4, KOH, CaO, NaNO3, Fe2 (SO4)3 |
| 8 | H3PO4, NaOH, BaO, K2 SO4, BaCl2 |
| 9 | КН SO 4, Са( OH )2, Н NO 2, Na 3 РО4, Fe Cl 3 |
| 10 | H3PO3, N О 2, CO, Na2 НРО 4, (CH3COO)2Ba |
| 11 | HBr, Fe(OH)2, Na2S, NaHCO3, Pb(NO3)2 |
| 12 | HNO3, Fe(OH)3, N2O5, Al(OH)SO3, CH3COONa |
| 13 | FeO, P2O5, Al(OH)SO4, ВаО , NH4NO2 |
| 14 | KOH, Ca(HCO3)2, Cu(NO3)2, Pb(OH)2, H2SO3 |
| 15 | Cu 2 O , Al ( OH )2С l , СаСО3, КМ n О4, Sr ( OH )2 |
Задание 2
Напишите формулы следующих соединений:
| № варианта | Задание |
| 1 | карбонат кальция, перманганат калия, азотистая кислота, хлорид натрия, гидрофосфат натрия |
| 2 | оксид серы ( III ), угольная кислота, гидроксид калия, серная кислота, гидрокарбонат калия |
| 3 | оксид азота ( II ), гидроксид железа ( II ), азотная кислота, карбонат калия, гидроксохлорид магния |
| 4 | оксид азота ( III ), сульфат натрия, гидроксид алюминия, хлорид железа ( II ), дигидроксобромид алюминия |
| 5 | оксид углерода ( II ), карбонат натрия, гидроксид железа ( III ), сернистая кислота, гидросульфат калия |
| 6 | оксид углерода ( IY ), нитрит калия, гидроксид магния, соляная кислота, гидрокарбонат натрия |
| 7 | оксид азота ( II ), карбонат бария, гидроксид натрия, азотная кислота, дигидроксохлорид алюминия |
| 8 | оксид серы ( III ), уксусная кислота, гидроксид кальция, ацетат аммония, нитрат свинца ( II ) |
| 9 | оксид марганца ( II ), хлорид меди ( II ), гидроксид железа ( III ), азотистая кислота, гидроксофторид алюминия |
| 10 | оксид серы ( III ), сульфат меди ( II ), гидроксид алюминия, фосфористая кислота, гидроксохлорид железа ( II ) |
| 11 | оксид серы ( II ), нитрат натрия, хлорид натрия, фосфорная кислота, дигидрофосфат натрия |
| 12 | серная кислота, оксид азота ( Y ), гидрофосфат натрия, сульфид железа ( II ), карбонат калия |
| 13 | гидросульфат натрия, дихромат калия, аммиак, фосфорная кислота, гидроксонитрит магния |
| 14 | нитрат кальция, сернистая кислота, перманганат калия, оксид фосфора ( III ), гидросульфид калия |
| 15 | оксид углерода ( II ), гидросульфит натрия, манганат калия, сероводород, нитрит меди ( II ) |
Строение атома
Задание 1.
Запишите электронную конфигурацию элементов с порядковыми номерами:
| № варианта | Задание |
| 1 | 8, 19, 39 |
| 2 | 9, 20, 40 |
| 3 | 10, 37, 41 |
| 4 | 11, 32, 42 |
| 5 | 12, 33, 43 |
| 6 | 13, 37, 44 |
| 7 | 14, 38, 45 |
| 8 | 4, 31, 46 |
| 9 | 15, 47, 55 |
| 10 | 16, 26, 37 |
| 11 | 17, 27, 38 |
| 12 | 12, 34, 48 |
| 13 | 19, 25, 50 |
| 14 | 20, 35, 51 |
| 15 | 18, 30, 38 |
Задание 2.
1. Укажите положение в Периодической таблице элементов с порядковыми номерами № 21, 32, 44 (период, группа, подгруппа).
2. Покажите распределение электронов по ячейкам для атома Si и иона Si2+. Подсчитайте для них ковалентность.
3. Что характеризует магнитное квантовое число? Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 2? l = 3? Ответ поясните.
4. Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n = 4? Ответ поясните.
5. Покажите распределение электронов по ячейкам для атома Mn и иона Mn2+. Подсчитайте для них ковалентность.
6. Указать особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов?
7. Перечислить электронные аналоги элементов 6 группы периодической системы элементов. Написать в общем виде электронные формулы валентных электронных подуровней атомов этих элементов.
8. У элементов каких периодов электроны валентного слоя характеризуются значениями n + l = 5? Ответ поясните.
9. Сколько неспаренных электронов содержат невозбужденные атомы бора, серы, мышьяка, хрома, ртути? Напишите электронные формулы и графические схемы электронного строения атомов элементов.
10. Сколько электронов может разместиться на s -, p -, d - и f -подуровнях. Ответ обоснуйте с точки зрения квантовых чисел.
11. Составить электронную формулу атома кремния и графическую схему заполнения электронами валентных орбиталей этого атома в нормальном и в возбужденном состояниях.
12. Какой подуровень будет заполняться вслед за подуровнем 4 s? Ответ обоснуйте в соответствии с правилом Клечковского.
13. Укажите положение в Периодической таблице элементов с порядковыми номерами № 17, 38, 69 (период, группа, подгруппа).
14. У какого элемента начинает заполняться подуровень 4 f ? У какого элемента завершается заполнение этого подуровня? К какому электронному семейству относятся эти элементы, какое название они имеют?
15. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны, ответ поясните.
1) 1s22s22p53s1
2) 1s22s22p6
3) 1s22s22p63s23p63d4
4) 1s22s22p63s23p64s2
Химическая связь
1. Указать тип и образование химической связи в молекулах хлорида калия, хлора, иодоводорода.
2. Указать тип и образование химической связи в молекулах иодида натрия, воды, азота.
3. Определите пространственную структуру молекул С H 4 и BH 3. Ответ поясните графическими схемами.
4. Указать тип и образование химической связи в молекулах сероводорода, углекислого газа, четыреххлористого углерода.
5. Приведите два примера соединений с тетраэдрическим строением молекул, укажите тип гибридизации атомных орбиталей. Ответ поясните.
6. Приведите два примера соединений с линейным строением молекул, укажите тип гибридизации атомных орбиталей. Ответ поясните.
7. Приведите два примера соединений со строением молекул в виде треугольника с углом между связями 120º, укажите тип гибридизации атомных орбиталей. Ответ поясните.
8. Какой характер имеют связи в молекулах NCl 3 , CS 2, NF 3, OF 2, CO 2? Указать для каждой из них направление смещения общей электронной пары.
9. Составить валентную схему молекулы хлороформа СНС l 3 и указать:
а) какая связь наиболее полярна;
б) в каком направлении смещено электронное облако этой связи.
10. Указать тип химической связи в молекуле воды. Почему молекулы воды полярны? Какими уникальными свойствами обладают молекулы воды?
11. Чем обусловлена металлическая связь? Какими свойствами обладают металлы благодаря металлической связи?
12. Описать пространственное строение молекулы хлорида бериллия. Какие атомные орбитали участвуют в образовании связей Ве – Cl?
13. Указать тип гибридизации атомных орбиталей кремния в молекулах SiH 4 и SiF 4. . Ответ поясните графическими схемами.
14. Как с точки зрения существования водородных связей объясняется жидкое агрегатное состояние вещества?
15. Исходя из представлений о природе ионной связи, объяснить, почему при обычных условиях ионные соединения существуют в виде ионных кристаллов. А не в виде отдельных молекул. Приведите примеры соединений, образованных ионной связью.
Химическая термодинамика
1. Не производя вычислений, определить знак изменения энтропии в следующих реакциях, ответ обоснуйте:
NH 4 NO 3(к) ═ N 2 O (г) + 2 H 2 O (г)
2 H 2(г) + O 2(г) ═ 2 H 2 O (г)
2 H 2(г) + O 2(г) ═ 2 H 2 O (ж)
2. Рассчитать ∆Gо298 химической реакции: Fe 2 O 3(к) + 3 H 2(г) ═ 2 Fe (к) + 3 H 2 O (г) и определить, выше какой температуры возможен прямой процесс.
3. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
NiO (к) + Pb (к) = Ni (к) + PbO (к)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
4. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
СаСО3(к) = СаО(к) + СО2(г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
5. Не производя вычислений, определить знак изменения энтропии в следующих реакциях, ответ обоснуйте:
2 H 2 S (г) + 3 O 2(г) = 2 H 2 O (ж) + 2 SO 2(г)
4 H С l (г) + О2(г) = 2С l 2(г) + 2 H 2 O (г)
2 CH 3 OH (г) + 3 O 2(г) = 4 H 2 O (г) + 2 CO 2(г)
6. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
2 NO (г) + O 2(г) = 2 NO (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
7. Вычислите, сколько теплоты выделится при сгорании 165 л. (н.у.) ацетилена, если продуктами сгорания являются диоксид углерода и вода.
8. Определить возможность протекания реакции при стандартных условиях и рассчитать температуру начала реакции: 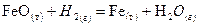
9. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
2 H 2 S (г) + 3 O 2(г) = 2 S О2(г) + 2 H 2 O (ж)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях.
10. Вычислите ΔGº298, ΔHº298 и ΔSº298 для реакции:
С2Н4 (г) + 3О2 = 2СО2 (г) + 2Н2О (г).
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Рассчитайте тепловой эффект сгорания 5 л. этилена.
11. Восстановление Fe3O4 оксидом углерода протекает по уравнению:
Fe 3 O 4 (к) + СО (г) = 3 FeO (к) + СО2 (г)
Вычислите ΔGº298 и сделайте вывод о возможности самопроизвольного протекания этого процесса при стандартных условиях. При какой температуре начнется реакция восстановления Fe3O4?
12. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
TiO 2 (к) + 2 C (к) = Ti (к) + 2СО (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Возможна ли реакция восстановления TiO2 углеродом при 1000 и 3000К?
13. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
4 NH 3 (г) + 5 O 2 (г) = 4 NO (г) + 6 H 2 O (г)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Возможна ли данная реакция при 250ºС?
14. Не производя вычислений, установить знак ΔSº298 процесса, ответ обоснуйте:
MgO (к) + H 2(г) = Mg (к) + H 2 O (ж)
С(графит) + СО2(г) = 2СО(г)
4 H С l (г) + О2(г) = 2С l 2(г) + 2 H 2 O (г)
15. Определите значения ΔGº298, ΔHº298 и ΔSº298 для реакции:
Al2O3 (k) + 3SO3( г ) = Al2(SO4)3 (k)
Сделайте вывод о тепловом эффекте реакции и возможности протекания реакции при стандартных условиях. Рассчитайте температуру начала реакции.
Скорость химических реакций
1. В газовой фазе протекает обратимая реакция: 2СО + О 2 = 2СО 2 + Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс и определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 4 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия реакции, если равновесные концентрации равны (моль/л): [СО] = 0,2; [О 2 ] = 0,1; [СО 2 ] = 0,3.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
2. Температурный коэффициент скорости реакции равен 2. Рассчитайте, как изменится скорость реакции, если:
а) увеличить температуру в системе с 10ºС до 40ºС;
б) уменьшить температуру в системе с 50ºС до 10ºС?
3. При повышении температуры скорость химической реакции увеличилась в 8 раз, температурный коэффициент данной реакции равен 2. На сколько градусов повысили температуру в системе?
4. Как изменится скорость реакции 2 NO (г) + Cl 2(г) ↔ 2 NOCl (г) , если:
а) увеличить давление в реакционном сосуде в два раза;
б) уменьшить объём сосуда в 4 раза?
5. Равновесие гомогенной системы 2S O 2 + O 2 = 2 SO 3 установилось при концентрациях реагирующих веществ (моль/дм³): [S O 2 ] = 0,2; [ O 2 ] = 0,1; [S O 3 ] = 0,5. Рассчитайте константу равновесия и исходные концентрации S O 2 и O 2.
6. Напишите уравнение константы равновесия гетерогенной реакции:
SiO 2 (к) +2 H 2 (г) = Si (к) +2 H 2 O (г)
7. Реакция между веществами А и В выражается уравнением 2А + В → С. Начальная концентрация вещества А равна 3,2 моль/л, а вещества В – 1,6 моль/л. Константа скорости реакции 0,75. Какова скорость реакции в начальный момент и по истечении некоторого времени, когда концентрация вещества А уменьшилась на 0,5 моль/л?
8. В газовой фазе протекает обратимая реакция: СО + 2Н2 = СН3ОН - Q .
Напишите уравнение для скорости прямой реакции согласно закону действующих масс и определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия, если равновесные концентрации равны (моль/л): [СО]=[Н2]=0,1; [СН3ОН]=0,5.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
9. Температурный коэффициент реакции равен 2. Как изменится скорость реакции, если:
а) увеличить температуру в системе с 20ºС до 40ºС;
б) уменьшить температуру в системе с 50ºС до 30ºС?
10. В какую сторону сместится химическое равновесие в системе
CaCO 3(к) ↔ CaO (к) + CO 2(г) ; ∆ H =178,4 кДж/моль
а) при введении в систему углекислого газа;
б) при введении в систему оксида кальция;
в) при увеличении температуры?
11. В газовой фазе протекает обратимая реакция: N 2 + 3 H 2 = 2 NH 3 + Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс. Определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 3 раза
Рассчитайте константу равновесия и первоначальные концентрации исходных веществ, если равновесные концентрации равны (моль/л): [ N 2 ] = 0,1; [ H 2 ] = 0,3; [ NH 3 ] = 0,5.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
12. Температурный коэффициент реакции равен 2. На сколько градусов следует понизить температуру, чтобы уменьшить скорость реакции в 16 раз.
13. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастёт скорость реакции при увеличении температуры в реакционном сосуде с 15 до 38оС?
14. За какое время закончится реакции при 30ºС, если при 10ºС она заканчивается через 20 минут, коэффициент скорости реакции равен 2.
15. В газовой фазе протекает обратимая реакция: 2 N Н3 = N 2 + 3Н2 - Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс. Определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 2 раза;
б) объем исходных веществ увеличить в 4 раза
Рассчитайте константу равновесия и первоначальные концентрации исходных веществ, если равновесные концентрации равны (моль/л): [ N Н3] = 0,2; [ N 2 ] = 0,1; [Н2] = 0,3.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
Дата: 2019-11-01, просмотров: 306.