ЧАСТНАЯ МИКРОБИОЛОГИЯ
МОДУЛЬ
Микробиологическая диагностика бактериальных острых кишечных инфекций
Острые кишечные инфекции продолжают оставаться одной из самых широко распространенных форм инфекционной патологии. Главные из них: эшерихиозы, дизентерия, сальмонеллезы, в том числе брюшной тиф и паратифы, а также пищевые токсикоинфекции несальмонеллезной природы.
По частоте встречаемости возбудителей острых кишечных инфекций среди них выделяют различные уровни приоритетности, что необходимо учитывать при проведении лабораторной диагностики этих инфекций.
Так, например, Salmonella typhi, Salmonella paratyphi, Shigella, Vibrio cholerae серогруппа О1, нехолерные вибрионы, Aeromonas, Plesiomonas относятся к патогенам высокого уровня приоритетности, а не относящиеся к возбудителю брюшного тифа сальмонеллы и эдвардсиеллы, Yersinia enterocolitica, Campylobacter jejuni, Clostridium difficile – к патогенам среднего уровня приоритетности.
Патогены низкого уровня приоритетности – это энтеропатогенные, энтеротоксигенные, энтероинвазивные и энтерогеморрагические Escherichia coli.
Исследование на наличие патогенных энтеробактерий проводится не только с диагностической целью, но и при обследовании лиц определенных контингентов, предусмотренных нормативными документами Минздрава РФ, а также по эпидемиологическим показаниям в целях выявления носителей − источников инфекции.
Для микробиологической диагностики острых кишечных инфекций могут использоваться:
1)бактериологический метод − основной метод при большинстве инфекций;
2)серодиагностика − чаще ретроспективно (дизентерия, пищевые токсикоинфекции, эшерихиозы), но могут использоваться для серодиагностики тифо-паратифозного заболевания, иерсиниозов - реакции агглютинации (РПГА,латекс-агглютинации);
3)иммуноиндикация − для ориентировочной экспресс-диагностики –чаще для диагностики эшерихиозов, сальмонеллезов, дизентерии – реакция иммунофлюоресценции, РПГА с антительным шигеллезным диагностикумом, реакция ко-агглютинации с реагентом на сальмонеллы группы В (при пищевой токсикоинфекции).
ШИГЕЛЛЕЗЫ (БАКТЕРИАЛЬНАЯ ДИЗЕНТЕРИЯ)
Таксономия
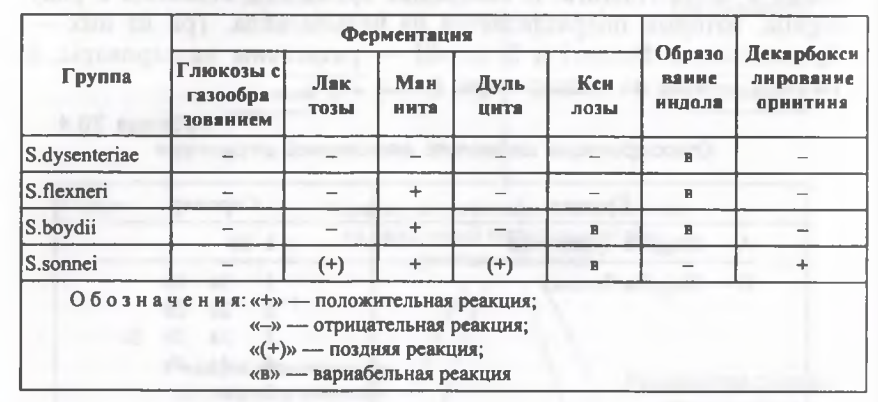
Семейство Enterobacteriaceae, род Shigella. Классификация шигелл основана на биохимических свойствах
(ферментация маннита и лактозы) и антигенном строении. Род Shigella включает 4 вида:
Ø S. dysenteriae - 12 сероваров (ГРУППА А);
Ø S. flexneri - 9 сероваров (ГРУППА Б);
Ø S. Boydii - 18 сероваров (ГРУППА С);
Ø S. sonnei - 1 серовар (антигенно однородны) (ГРУППА Д).
Shigella dysenteriae не ферментируют манит и лактозу, представители групп В, С и D манитпозитивны, а S.sonnei медленно (в течение 2 суток) могут сбраживать лактозу.
Морфология
Неподвижные (жгутиков нет) мелкие, короткие, прямые грамотрицательные палочки с закругленными концами размером 0,5-0,7x2-3 мкм, спор и капсулу не образуют. Многие штаммы имеют пили.
Культуральные свойства
Факультативные анаэробы. Хорошо растут на простых питательных средах. На мясо-пептонном агаре образуют круглые, выпуклые, средней величины, полупрозрачные, бесцветные колонии. В жидкой среде вызывают диффузное помутнение.На плотных средах при выделении из организма больного образуются,как правило, S-формы колоний.
На среде Эндо образуют бесцветные колонии. Жидкой средой обогащения является селенитовый бульон. У S. sonnei отмечена при росте на плотных средах S-(1 фаза), R-(2 фаза) диссоциация. Бактерии 1 фазы при пересевах образуют оба типа колоний.
Биохимические свойства
 Шигеллы обладают слабой биохимической активностью по сравнению с родами Escherihia и Salmonella.
Шигеллы обладают слабой биохимической активностью по сравнению с родами Escherihia и Salmonella.
• не образуют газ при ферментации глюкозы;
• не расщепляют лактозу и сахарозу(за искл. S. Sonnei) ;
• не продуцируют сероводород.
S. dysenteriae не расщепляет маннитол. S. sonnei способен ферментировать лактозу медленно, в течение 72 ч; является наиболее биохимически активным видом, от других видов шигелл S. sonnei можно отличить по биохимическим свойствам, по биохимической активности подразделяется на хемовары.
Шигеллы ферментируют углеводы, с образованием кислоты без газа. Не ферментируют лактозу (только шигеллы Зонне медленно, на 3-5 день расщепляют этот углевод).
Резистентность
Шигеллы плохоустойчивы к воздействию физических, химических и биологических факторов окружающей среды. В воде, почве, пищевых продуктах, на предметах, посуде, овощах, фруктах шигеллы живут в течение 5–14 дней.
Выживаемость шигелл во внешней среде - от нескольких дней до нескольких месяцев. Наиболее неустойчив во внешней среде вид S. dysenteriae. Шигеллы хорошо переносят высушивание, низкие температуры, но быстро погибают под воздействием прямых солнечных лучей и нагревании (при 60 С - через 30 мин, при 100С мгновенно).
Благоприятной средой для шигелл являются пищевые продукты. S. sonnei в молоке и молочных продуктах способны не только длительно переживать, но и размножаться, обусловливая развитие пищевой токсикоинфекции. Дезинфицирующие средства (гипохлориты, хлорамин, лизол и др.) в обычных концентрациях убивают шигеллы. У S. dysenteriae, отмечен переход в некультивируемую форму.
При отсутствии солнечного света, повышенной влажности и умеренной температуре шигеллы сохраняют жизнеспособность в почве до 3 месяцев. В желудочном соке шигеллы могут выживать лишь несколько минут. В пробах кала шигеллы погибают от действия кислой реакции среды и бактерий-антагонистов через 6–10 часов. В высушенном или замороженном кале шигеллы жизнеспособны в течение нескольких месяцев.
Наиболее устойчивым к внешним воздействиям является вид шигеллShigella sonnei, наименее устойчивым — Shigella dysenteriae.
Антигенная структура
Все шигеллы обладают соматическим О-антигеном, в зависимости от строения которого происходит подразделение на серовары. S. flexneri внутри сероваров подразделяется на подсеровары, их серовароспецифические О-антигены детерминируются конвертирующими бактериофагами. S. sonnei обладает антигеном фазы 1, который является К-антигеном(так же имеют некоторые виды (шигеллы Флекснера)).
Антигенный комплекс шигелл включает 2 термостабильных АГ(типовые и групповые)и термолабильные. Термолабильный включает К-антиген. Определение антигенной структуры проводят для окончательной идентификации бактерий.
Факторы патогенности
Все виды шигелл инвазируют слизистую оболочку толстой кишки с последующим межклеточным распространением. Эта способность связана с функционированием крупной плазмиды инвазии, которая имеется у всех 4 видов шигелл.
1.Факторы, определяющие взаимодействие с эпителием слизистой оболочки(факторы адгезии и инвазии). Вирулентные штаммы шигелл обладают специфическими белками наружной мембраны, синтез которых детерминируется плазмидой. Эти белки взаимодействуют с рецепторами
плазмолемы эпителиальных клеток толстого кишечника и побуждают клетку к захвату шигелл.
2. Факторы, обеспечивающие устойчивость к гуморальным и клеточным механизмам защиты макроорганизма и способность шигелл размножаться в его клетках
3. Шига (ST)- и шигаподобные (SL-T) токсины. Шигатоксин продуцируется S. dysenteriae серовара 1, остальные шигеллы продуцируют шигаподобные токсины. Это белковые токсины, имеющих сродство к рецептору, который локализуется на мембранах эндотелия капилляров; проникнув в клетку, они необратимо блокируют синтез белка. Шига- и шигаподобные токсины накапливаются в периплазматическом пространстве клетки и выделяются в окружающую среду после гибели шигелл.
У шигелл, отличных от S. dysenteriae серовара 1, шигаподобных токсинов вырабатывается в 1000 раз меньше, поэтому ареал действия токсина ограничивается стенкой кишечника. У S. dysenteriae серовара 1 токсин попадает в кровь и наряду с эндотелием подслизистой оболочки поражает также гломерулы почки, вследствие чего, помимо кровавого поноса, развивается гемолитический уремический синдром с почечной недостаточностью.
Эндотоксин защищает шигеллы от действия низких значений рН и желчи.
Все известные виды шигелл синтезируют цитотоксический энтеротоксин, синтез которого детерминирован хромосомными генами. Наиболее выражена способность к продукции этого токсина у S.dysenteriae, 1 (шигелл Григорьева-Шига).
Эпидемиология (этиология)
Шигеллы вызывают заболевания, называемые шигеллезами (старое название - бактериальная дизентерия), которые являются антропонозными инфекциями.
Способ заражения - фекально-оральный.
Путь передачи:
¨ водный – преобладает у шигелл Флекснера;
¨ пищевой – через продукты,преобладает у шигелл Зонне;
¨ контактно-бытовой – особенно для S. dysenteriae
С приобретением S. dysenteriae 1 плазмид, обусловивших множественную лекарственную устойчивость и повышенную вирулентгость). В отличие от других шигелл, S. dysenteriae вызывает длительные эпидемии шигеллеза. Заболевание протекает с тяжелой клинической картиной и часто заканчивается летально. К тому же отмечено более быстрое формирование антибиотикорезистентности, чем у других видов шигелл.
В развивающихся странах наиболее частыми возбудителями являются S. flexneri и S. dysenteriae серовара 1.
S. sonnei вызывает шигеллез в легкой форме, часто в виде бактерионосительства. Передается в основном алиментарным путем через молочные продукты.
Осложнениями шигеллезов может быть развитие кишечного дисбактериоза. Летальность при шигеллезах достигает 0,3%.
Иммунитет
При дизентерии развивается местный и общий иммунитет. При местном иммунитете существенное значение имеют секреторные IgA, которые образуются в 1-ю неделю заболевания в лимфоидных клетках слизистой оболочки кишки. Покрывая слизистую оболочку кишки, эти антитела препятствуют прикреплению и пенетрации шигелл в эпителиальные клетки. Кроме того, в процессе инфекции нарастает титр сывороточных антител IgM, IgA, IgG, который достигает максимума на 2-й неделе заболевания. Наибольшее количество IgM обнаруживается в 1-ю неделю болезни. Наличие специфических сывороточных антител не является показа телем напряженности местного иммунитета.
Лечение
(Симптоматическое, этиотропное.)
Для лечения по эпидемическим показаниям используют бактериофаг орального применения, антибиотики (фторхинолоны,ципрафлоксацин) после определения антибиотикограммы. В случае возникновения дисбактериоза применяют пробиотики для коррекции микрофлоры.
Профилактика
Специфической профилактики дизентерии нет. Неспецифическая профилактика сводится к соблюдению санитарно-гигиенических правил приготовления, хранения и реализации пищевых продуктов, при водоснабжении, правил личной гигиены и других мероприятий, аналогичных таковым при кишечном эшерихиозе. Но по эпидемиологическим показателям можно использовать экстренную специфическую фагопрофилактику поливалентным дизентерийным бактериофагом. Антибиотиками не лечат, так как при дизентерии часто развивается дизбактериоз
Диагностика
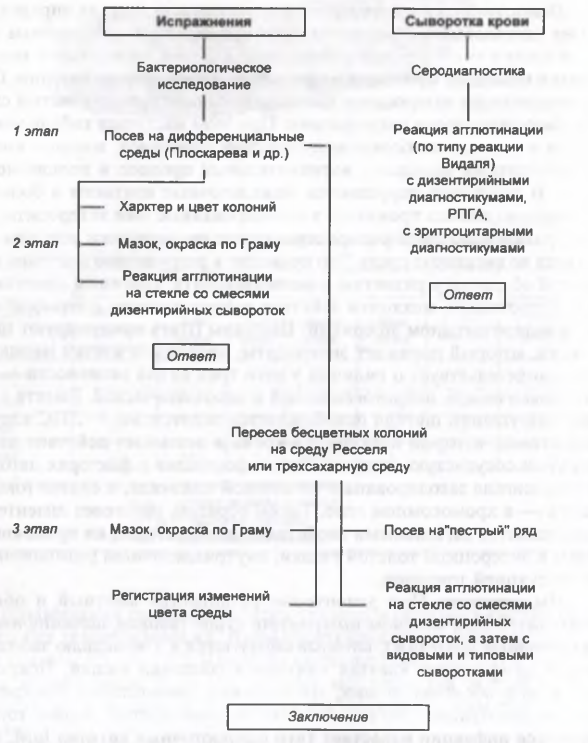 Основным методом является бактериологический, материалом для исследования служат испражнения. Для посева отбирают гнойно-слизисто-кровяные образования из средней порции кала, которые непосредственно высевают на ряд разных лактозосодержащих и других дифференциально-элективных плотных питательных сред. В случае выявления бактерионосителей посев испражнений обязательно проводится в селенитовый бульон с последующим выделением возбудителя на плотных дифференциально-элективных питательных средах. Среди выросших на этих средах колоний отбирают лактозоотрицательные, которые идентифицируют до вида и серовара, выделенные культуры S. flexneri - до подсероваров, а S. sonnei - до хемоваров. В качестве вспомогательного используют серологический метод с постановкой РНГА.
Основным методом является бактериологический, материалом для исследования служат испражнения. Для посева отбирают гнойно-слизисто-кровяные образования из средней порции кала, которые непосредственно высевают на ряд разных лактозосодержащих и других дифференциально-элективных плотных питательных сред. В случае выявления бактерионосителей посев испражнений обязательно проводится в селенитовый бульон с последующим выделением возбудителя на плотных дифференциально-элективных питательных средах. Среди выросших на этих средах колоний отбирают лактозоотрицательные, которые идентифицируют до вида и серовара, выделенные культуры S. flexneri - до подсероваров, а S. sonnei - до хемоваров. В качестве вспомогательного используют серологический метод с постановкой РНГА.
Процент положительных результатов довольно низкий, осо бенно при хронической дизентерии.
Основным методом микробиологической диагностики дизентерии является бактериологическое исследование фекалий. Возможно использование методов серодиагностики, иммуноиндикации и молекулярно-генетических.
САЛЬМОНЕЛЛЕЗЫ
Таксономия
Семейство Enterobacteriaceae, род Salmonella.
Т.к. по основным биохимическим свойствам представители рода Salmonella однотипны, дифференциация внутри рода проводится по антигенной структуре.
В основе старой классификации по Кауфману-Уайту лежит подразделение сальмонелл на серогруппы по строению О-антигена и на серовары внутри серогруппы по строению Н-антигена.
В настоящее время род Salmonella состоит из двух видов: S. enterica и S. bongori. S. enterica состоит из 6 подвидов: enterica (к нему относится серовар S. typhi), palamae, arizonae, diarizonae, hoitanae, indica. В него включены все сальмонеллы, являющиеся возбудителями человека и теплокровных животных. Вид S. bongori подразделяется на 21 серовар и включает в себя сальмонеллы, выделенные из холоднокровных животных.
В соответствии с содержанием тех или иных О-антигенов все известные сальмонеллы разделены на 65 серогрупп, обозначенных прописными буквами латинского алфавита (A, B, C, D, и т.д.). Они представлены в схеме Кауфмана-Уайта, где О-антигены обозначены цифрами. Все сальмонеллы разделены на группы. В каждую серогруппу включены сальмонеллы с идентичным одним или несколькими О-антигенами. Например, серогруппа В содержит сальмонеллы с О-антигенами 1,4,12; из них специфичным для группы является антиген 4. Для сальмонелл группы D характерен О-антиген 9.
Дифференциация сальмонелл внутри серогруппы проводится по специфичности Н-антигенов, котрые существуют в 2-х фазах: 1-ая обозначается маленькими буквами латинского алфавита, 2-ая – арабскими цифрами.
Каждый серовар сальмонелл имеет наименование. Часто оно присваивается по названию места открытия (S. dublin); по автору, описавшему серовар (S. schottmullri); по основному симптому болезни (S. typhy).
По признаку патогенности для человека сальмонеллы делятся на две группы: патогенные только для человека и патогенные для человека и животных. Представители первой группы вызывают брюшной тиф и паратифы, представители второй - сальмонеллезы.
Морфология
Подвижные (есть и неподвижные) мелкие грамотрицательные палочки с закругленными концами размером 0,7-1,5x2-5 мкм. Окружены микрокапсулой. Капсулу и спор не образуют. У подвижных жгутики расположены перитрихиально.
Культуральные свойства
Факультативные анаэробы. Хорошо растут на простых питательных и желчесодержащих средах. На плотных средах могут образовывать колонии в R- и S-формах, на жидких - диффузное помутнение. Колонии в S-форме средних размеров, гладкие, блестящие, полупрозрачные с голубоватым оттенком; серовар S. Schottmuelleri (S. Paratyphi B) при росте на плотных средах образует слизистые валики.
Жидкими средами обогащения при посеве крови являются триптозосоевый бульон, бульон с сердечно-мозговой вытяжкой, желчный бульон, при посеве содержащие дополнительную флору материалов (фекалии, желчь, мочу, пищевые продукты) - селенитовый бульон, тетратионатовый бульон, среда Раппопорт-Василиади (последняя не используется для выделения S. Typhi).
На лактозосодержащих дифференциальных средах образуют бесцветные колонии, на висмут-сульфитном агаре – колонии черного цвета, на среде BGA – розовые колонии.
Биохимические свойства
Обладают выраженной биохимической активностью. Основные биохимические свойства, необходимые для идентификации:
1. ферментация глюкозы до кислоты и газа (S. Typhi не продуцируют газ);
2. отсутствие ферментации лактозы(диагностический признак);
3. продукция сероводорода (за исключением S. Paratyphi A);
4. отсутствие индолообразования;
5. декарбоксилирование лизина (за исключением S. Paratyphi A);
6. отсутствие расщепления мочевины;
7. отрицательный тест Фогеса-Проскауэра.
Резистентность
Сальмонеллы устойчивы к воздействию факторов внешней среды. Выдерживают рН 4,0-9,0, хорошо переносят низкие температуры. В водоемах, сточных водах, почве сохраняют жизнеспособность до 3 мес, в комнатной пыли – от 80 до 550 дней; в колбасе – 3 мес, в замороженном мясе и яйцах – до 1 года; на овощах и фруктах – 5-10 дней. При нагревании до 56 °С гибнут в течение 45-60 мин, при
100 °С погибают мгновенно. Дез. растоворы (5% фенол, 3% хлорамин, 3% лизол) убивают сальмонеллы в течение 2-3 мин. При неблагоприятных условиях сальмонеллы могут переходить в некультивируемую форму.
Антигенная структура
Сальмонеллы обладают соматическим О-антигеном, жгутиковым Н-антигеном, некоторые – К-антигеном. О-антиген (термостабилен) состоит из R-ядра и боковой S-цепи, к которой присоединяются сахара (по общности конечного сахара сальмонеллы объединяют в серогруппы). Н-антиген является двухфазным(1 фаза-специфическая,2 фаза-групповая), т.к. его синтез кодируется двумя независимыми генами, работа одного из которых исключает работу другого. Поэтому в каждой клетке может быть синтезирован только один белок (фаза). По строению Н-антигена сальмонеллы делятся на серовары внутри серогруппы.
Некоторые серовары сальмонелл, в частности S. Typhi, S. Paratyphi С имеют полисахаридный Vi-антиген (разновидность К-антигена, по хим.стуктуре – полимер N-ацетилгалактозоаминоуроновой кислоты, может придавать бактериям явление О-инагглютинабельности). Этот антиген является рецептором для бактериофагов, по спектру чувствительности к набору Vi-фагов устанавливается фаговар S. Typhi, который необходим для эпидемиологического анализа вспышек брюшного тифа с целью определения источника инфекции.
Факторы патогенности
Патогенность сальмонелл – это свойство сальмонелл связано со способностью проникать в макрофаги и размножаться в них. После разрушения макрофагов микроорганизмы попадают в лимфу, кровь – происходит генерализация процесса.
Все сальмонеллы обладают эндотоксином, который вызывает в случае бактериемии развитие лихорадки. При достижении критической концентрации в тканях кишечника эндотоксин приводит к нарушению водно-солевого баланса кишечника и развитию диареи.
В зависимости от источника инфекции, путей передачи, особенностей патогенеза и форм проявления инфекционного процесса среди заболеваний, вызываемых сальмонеллами, различают системные инфекции (брюшной тиф и паратифы), сальмонеллезные гастроэнтериты и госпитальный (нозоко- миальный) сальмонеллез.
Брюшной тиф и паратифы
Этиология
Брюшной тиф – острое антропонозное инфекционное заболевание с фекально-оральным механизмом передачи. Протекает в генерализованной форме с поражением лимфатического аппарата кишечника, мезентериальных лимфоузлов, паренхиматозных органов, с бактериемией. Характеризуется циклическим течением. Клинически проявляется выраженной интоксикацией с лихорадкой, развитием гепатолиенального синдрома, в ряде случаев розеолезной сыпью и энтеритом.
Паратифы А и В сходны по характеру и клиническим проявлениям с брюшным тифом, но протекают более легко.
Возбудители брюшного тифа и паратифов принадлежат к виду S. enterica, подвиду enterica, сероварам S. Typhi, S. Paratyphi А, S. Paratyphi В (S. Schottmuelleri), S. Paratyphi С
Брюшной тиф, паратиф А и паратиф В вызывают серовары сальмонелл, строго адаптированные к паразитизму в организме человека - S.typhi, S.paratyphi A и S.paratyphi B. Существенные патогенетические особенности инфекционного процесса, вызванного этими сальмонеллами, служат основанием для выделения самостоятельной нозологической формы - тифо-паратифозное заболевание (брюшной тиф, паратифы А и В).
Факторы патогенности
а) токсины: эндотоксин (липополисахаридопротеиновый комплекс), образуют микроорганизмы в S- форме, высвобождается при массовой гибели возбудителей; играет основную роль в патогенезе брюшного тифа;
б) ферменты патогенности: гиалуронидаза, фибринолизин, лецитиназа;
в) структурные элементы клеток: фимбрии, микрокапсула (у некоторых штаммов), за счет ее возбудители прикрепляются к клеткам эпителия тонкого кишечника;
г) важная биологическая особенность сальмонелл -способность проникать в макрофаги и противостоять фагоцитозу, а после их гибели попадать в кровь, обусловливая генерализацию инфекционного процесса;
д) пили I порядка выполняют адгезивную функцию.
Биохимические свойства
В основном типичны для рода Salmonella. Отличительные особенности: отсутствие газообразования при ферментации S. Typhi, неспособность S. Paratyphi A продуцировать сероводород и декарбоксилировать лизин.
Эпидемиология
Источником инфекции являются больной или бактерионоситель, которые выделяют возбудитель во внешнюю среду с испражнениями, мочой, слюной. Возбудители этих инфекций, как и другие сальмонеллы, устойчивы во внешней среде, S. Typhi может переходить в некультивируемую форму. Естественная восприимчивость людей к этим инфекциям высокая.
Иммунитет
Напряженный и длительный. Ведущая роль принадлежит активированным макрофагам. Антитела к О-антигену появляются первыми к концу 1-й нед заболевания, достигают максимальных титров к разгару заболевания, а потом исчезают. Антитела к Н-антигену появляются в период реконвалесценции, а также у привитых лиц и длительно сохраняются. Антитела к Vi-антигену обнаруживают у бактерионосителей брюшного тифа.
При брюшном тифе в результате гуморального иммунного ответа в сыворотке крови появляются различные антитела
(агглютинины, связывающие комплемент и др.), которые обеспечивают напряженный иммунитет. Кроме того, секреторные иммуноглобулины SIgA, покрывая слизистую тонкой кишки обеспечивают местный иммунитет. Полагают, что при брюшном тифе имеет место и клеточный иммунный ответ в результате образования Т-эффекторов ГЗТ в пейеровых бляшках.
- Лечение
Проводят этиотропную антибиотикотерапию (хлорамфеникол и др.антибиотики,действующие на Гр- бактерий).
Профилактика
Брюшнотифозную сорбированную и брюшнотифозную спиртовую, обогащенную Vi-антигеном вакцины используют для специфической профилактики брюшного тифа.
Брюшнотифозный бактериофаг назначают для профилактики по эпидемиологическим показаниям лицам, которые проживают совместно с больным и которые употребляли продукты и воду, подозрительно зараженные S. Typhi.
Неспецифическая профилактика включает санитарнобактериологический контроль за системами водоснабжения, соблюдение санитарно-гигиенических правил при приготовлении пищи, выявление бактерионосителей среди работников пищеблоков, торговли, своевременное выявление и изоляцию больных.
Диагностика
Учитывая цикличность течения заболеваний, материал для исследования и метод исследования определяются стадией течения болезни.
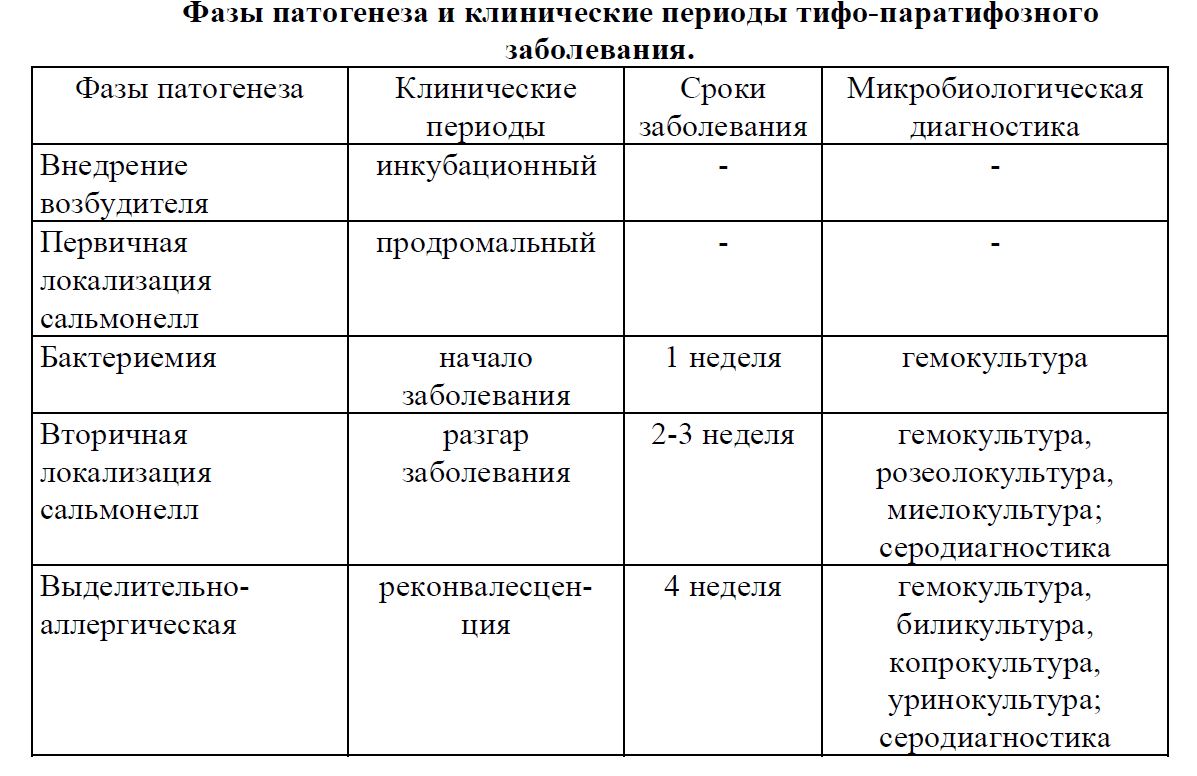 На 1-й нед заболевания и в течение всего лихорадочного периода возбудителей выделяют из крови. С конца 2-й нед заболевания производят выделение копро-, били- и уринокультур, а также соскоб с розеол. В 90% случаев возбудитель удается выделить из костного мозга даже тогда, когда из других материалов для исследования выделить возбудителя не удается, особенно если больной принимает антибиотики.
На 1-й нед заболевания и в течение всего лихорадочного периода возбудителей выделяют из крови. С конца 2-й нед заболевания производят выделение копро-, били- и уринокультур, а также соскоб с розеол. В 90% случаев возбудитель удается выделить из костного мозга даже тогда, когда из других материалов для исследования выделить возбудителя не удается, особенно если больной принимает антибиотики.
Посев крови осуществляют в соотношении 1:10 в желчный бульон или другие жидкие среды обогащения с последующим пересевом на плотные дифференциально-элективные среды (Эндо, Плоскирева, Мак-Конки), остальные материалы для исследования высевают непосредственно на плотные дифференциально-элективные среды. Выделенную культуру возбудителя идентифицируют по биохимическим свойствам и антигенной структуре, а выделенную культуру S. Typhi типируют Vi-фагами для определения источника инфекции.
Начиная со 2-й нед заболевания проводят серологическое исследование для определения наличия и типа антител с помощью РНГА с О-, Н- и Vi-диагностикумами. Положительным считают диагностический титр 1:200. В эндемичных по брюшному тифу регионах исследование рекомендуется проводить с использованием парных сывороток.
\
Сальмонеллез
Этиология
Сальмонеллез – острая кишечная зооантропонозная инфекция, характеризующаяся преимущественным поражением ЖКТ и протекающая чаще в виде локальной инфекции в форме гастроэнтерита, реже в виде генерализованных форм – тифоподобной или септикопиемической.
Возбудители – различные серовары S. enterica подвида enterica (чаще всего), за исключением сероваров S. Typhi, S. Paratyphi A, B, C. Наиболее часто возбудителями у человека являются серовары S. Typhimurium, S. Dublin, S. Choleraesuis, доминирующим в настоящее время является серовар S. Enteritidis. Они относятся к 4 серогруппам: А,В,С,Д. По морфологическим и культуральным свойствам они не отличаются от других представителей данного рода сальмонелл.
Факторы патогенности: белки наружной мембраны, играющие роль адгезинов; микрокапсула, эндотоксин (ЛПС); некоторые сальмонеллы выделяют экзотоксин.
Эпидемиология
Основным резервуаром возбудителей в природе являются сельскохозяйственные животные. У крупного и мелкого рогатого скота, свиней сальмонеллез протекает в форме клинически выраженной системной инфекции или бактерионосительства, при этом животные выделяют возбудителя с мочой, испражнениями, молоком, околоплодными водами. Резервуаром являются также птицы (водоплавающие) и куры, у которых происходит трансовариальная передача возбудителя. Основные факторы передачи - молоко, мясо, яйца, субпродукты, особенно печень свиней и крупного рогатого скота, а также вода. Источником инфекции может быть также больной человек и носитель. Пути передачи: алиментарный, водный, фекально-оральный, контактно-бытовой.
Иммунитет
Постинфекционный, гуморальный и клеточный, ненапряженный и недлительный (в отличие от брюшного тифа), серовароспецифический, опосредованный секреторным IgA. В крови могут определяться антитела, которые являются свидетелями инфекционного процесса.
Лечение
Проводится патогенетическая терапия, направленная на нормализацию водно-солевого обмена, при системных формах - этиотропная антибиотикотерапия.
Профилактика
Основную роль играет специфическая профилактика среди сельскохозяйственных животных и птиц. Большое значение имеет неспецифическая профилактика, включающая проведение ветеринарно-санитарных мероприятий, направленных на предупреждение распространения возбудителей среди сельскохозяйственных животных и птиц, а также соблюдение санитарно-гигиенических правил на мясоперерабатывающих предприятиях, при хранении мяса и мясных продуктов, приготовлении пищи, правильная кулинарная и термическая обработка пищевых продуктов.
Специфическая профилактика не разработана.
Диагностика
Бактериологическому исследованию подвергают испражнения, рвотные массы, промывные воды желудка, желчь, костный мозг, кровь (при системных формах заболевания).
Серологическое исследование включает РПГА и ИФА. Важное диагностическое значение имеет нарастание титра антител в динамике заболевания.
Этиология
Возбудителями внутрибольничного сальмонеллеза являются полиантибиотикорезистентные штаммы различных сероваров S. enterica, среди которых наиболее часто встречаются S. Typhimutium, S. Enteritidis, S. Virhov, S. Infants, S. Haife.
Госпитальные штаммы сальмонелл представляют собой особую биологическую разновидность. Для них характерны наличие криптической плазмиды с характерной для определенного серовара молекулярной массой, отсутствие типируемости типовыми бактериофагами, изменение биохимических свойств, повышенная инвазивная способность.
Эпидемиология
Источником инфекции и основным резервуаром возбудителей являются дети и взрослые (больные и бактерионосители), находящиеся или поступающие в стационар. В эпидемический процесс вовлекаются прежде всего дети в возрасте до 1 года, особенно новорожденные, а также взрослые пациенты хирургических и реанимационных отделений, перенесшие обширные оперативные вмешательства, лица пожилого и старческого возраста, больные с тяжелой соматической патологией, сопровождающейся иммунодефицитом.
Передача сальмонелл при внутрибольничном сальмонеллезе осуществляется воздушно-пылевым, контактно-бытовым, алиментарным путями.
Клиническое течение характеризуется длительным инкубационным периодом - от 8 до 43 сут. Проявление болезни варьирует от бессимптомного носительства до выраженных кишечных расстройств с развитием системной инфекции, осложненной септикопиемией.
Иммунитет не формируется.
Профилактика осуществляется поливалентным бактериофагом. Проводят этиотропную антибиотикотерапию.
ЭШЕРИХИОЗЫ
Таксономия
Семейство Enterobacteriaceae, род Escherichia, вид Escherichia coli, который по биохимическим свойствам делится на 11 видов, из них наибольшее значение в патологии человека имеет вид E.coli. E.coli внутри вида делится на серогруппы и серовары, ферментовары, фаговары, колицино- и
колициногеновары.
По патогенным возможностям различают патогенные (или диареегенные) и условно-патогенные E.coli.
Морфология
Прямые грамотрицательные палочки с закругленными концами размером 0,4-0,6x2-6 мкм, подвижные за счет перитрихиально расположенных жгутиков. Для некоторых характерно наличие микрокапсулы, построенной из гомополимера сиаловой кислоты; такие штаммы обозначаются как К+.Среди кишечных палочек встречаются подвижные и неподвижные варианты. Некоторые штаммы имеют выраженную капсулу или микрокапсулу
Культуральные свойства
На плотных средах образуют колонии в R- и S-формах, колонии в S-формах гладкие, блестящие, полупрозрачные. На жидких средах образуют диффузное помутнение и придонный осадок. На среде Эндо ферментируют лактозу и образуют малиновые колонии с металлическим блеском. Факультативные анаэробы. E.coli не требовательны к питательным средам. На мясо-пептонном агаре образуют круглые, выпуклые, средней величины, полупрозрачные, бесцветные колонии.
Хорошо растет на обычных питательных средах при слабощелочной реакции среды и оптимальной
температуре 37°С. Рост и размножение бактерий возможны при довольно значительных колебаниях pH среды и температурного режима. На основной для эшерихий среде Эндо лактозоферментирующие кишечные палочки образуют интенсивно красные колонии с металлическим блеском, не ферментирующие - бледно- розовые или бесцветные колонии с более темным центром, на среде Плоскирева - красные с желтоватым оттенком, на среде Левина - темно- синие с металлическим блеском. Культуры, имеющие капсулу, растут в виде слизистых колоний.
Биохимические свойства
Обладает выраженной биохимической активностью. Биохимические свойства, составляющие основу дифференциальной диагностики при проведении бактериологического исследования, следующие:
Ø продукция кислоты и газа при ферментации глюкозы,
Ø ферментация лактозы,
Ø неспособность образовывать сероводород,
Ø продукция индола.
Антигенная структура
Имеет О-, К- и Н-антигены. О-антиген (более 170 разновидностей) определяет серогруппу. Поверхностный К-антиген может быть представлен тремя антигенами (А, В и L), отличающимися по чувствительности к температуре и химическим веществам. У эшерихий встречается более 97 разновидностей К-антигена, преимущественно В-типа. К-антиген обладает способностью маскировать О-антиген, вызывая феномен О-инагглютинабельности. В этом случае О-антиген можно выявить только после разрушения К-антигена кипячением. Н-антиген является типоспецифическим
антигеном, определяющим серовары, которых насчитывается более 57. Н-антигены имеются только у жгутиковых форм бактерий и состоят из белка флагеллина.
Резистентность
В течение нескольких месяцев сохраняется в воде и почве. Быстро размножаются в пищевых продуктах, особенно молочных. Погибают при нагревании при 55 °С в течение 1 ч, при 60 °С – в течение 15 мин. Эшерихии в окружающей среде способны переходить в некультивиру-
емую форму. E. coli довольно устойчивы. В почве и воде сохраняются до 2-3 мес, в молоке не только сохраняются, но и размножаются. Растворы дезинфицирующих веществ (3% хлорамин, раствор сулемы 1:1000 и др.) убивают их за 20-30 мин. Особенно чувствительны E. coli к действию бриллиантового зеленого.
Факторы патогенности
1. Факторы, обеспечивающие устойчивость бактерий к противомикробной резистентности макроорганизма. У патогенных E.coli это: антилизоцимный фактор, ЛПС, L-гемолизины.
2. Факторы, индуцирующие синтез цитокинов и медиаторов воспаления – бактериальные модулины. В качетве них могут выступать токсические продукты, ферменты.
3. Токсины и токсичекие продукты:
1) Энтеротоксины. Их синтез детерминируется плазмидой. Выделяют термолабильный LT-токсин (структурно и функционально связан с холерным токсином), стимулирующий аденилатциклазу и термостабильный ST-токсин – гуанилатциклазу.
2) Токсины, нарушающие цитоскелет клетки:
o цитолетальный дилятирующий токсин – вызывает увеличение клетки, фрагментацию ядра и гибель клетки в течение 96–120 суток
o цитотоксиннекротизирующий фактор – провоцирует репликацию ДНК без деления клетки, приводит к образованию нежизнеспособных многоядерных клеток.
3) Токсины, вызывающие гибель клетки: токсин Шига, шигаподобные токсины, энтерогемолизины.
4) Токсины, влияющие на НС кишечника посредством освобождения нейромедиаторов – трансмиттеров.
Выделяют условно-патогенные и патогенные эшерихии.
1. Условно-патогенные эшерихии (возбудители парэнтеральных эшерихиозов) – облигатные представители микрофлоры кишечника и влагалища человека. Являются антагонистами патогенных кишечных бактерий, гнилостных бактерий и грибов рода Candida, участвуют в синтезе витаминов В, Е и К, частично расщепляют клетчатку.
Условно-патогенные эшерихии активируются при снижении иммунитета, изменении места локализации, вызывают эндогенные гнойно-воспалительные процессы (пиелиты, циститы, холициститы и др.). Они делятся на патовары:
1) MENEC – менингеальные кишечные палочки - возбудители менингитов. Около 80% менингитов связаны с E. coli, которой новорожденный заражается при прохождении через родовые пути. E. coli, вызывающая менингит у новорожденных, обладает микрокапсулой, которая придает ей антифагоцитарные свойства.
2) SEPEC – септицимические КП – вызывают сепсис.
3) UPEC – уропатогенные КП – вызывают инфекции урогенитального тракта. Некоторые из них обладают гемолитическими свойствами.
2. Патогенные (диареегенные) эшерихии отличаются от условно-патогенных возможностью синтеза факторов патогенности. Они подразделяются на патовары ЭТКП, ЭИКП, ЭПКП, ЭГКП, ЭАГКП. Эти группы различаются по экологии, путям передачи, патогенезу и клиническим проявлениям заболевания, что обусловлено различиями в наличии факторов патогенности. Патогенные E.coli вызывают экзогенные коли-инфекции – эшерихиозы.
Эпидемиология
E.coli является основным представителем нормальной микрофлоры кишечника людей и жинотных и с испражнениями выделяется в окружающую среду. Поэтому ее используют как санитарно-показательный микроорганизм, по которому оценивают загрязнение воды фекалиями (коли-титр, коли-индекс). В воде и почве эшерихии выживают несколько недель и даже месяцев. Источником инфекции являются
До 70% всех ОКЗ раннего детского возраста (до двух лет) связано с ЭПКП.
Источники заболевания: больные люди и животные, бактерионосители.
Пути передачи: фекально-оральный, контактно-бытовой.
Восприимчивый коллектив: взрослые и дети.
Иммунитет
При кишечных эшерихиозах вырабатывается местный иммунитет, опосредованный секреторными IgA. У детей первого года жизни пассивный трансплацентарный иммунитет к ЭПКП обеспечивается проходящими через плаценту IgG. Естественный иммунитет детей первого года жизни обеспечивают бифидобактерии, которые колонизируют кишечник к 5-му дню жизни, и антитела, находящиеся в материнском молоке. Надежный иммунитет к возбудителям парентеральных эшерихиозов не вырабатывается.
При колибактериозах в случае эндогенных инфекций имеет место гуморальный иммунный ответ. Однако образующиеся антитела не обладают протективными свойствами и не способствуют выздоровлению. Вместе с тем иммунодефицит, обуславливающий эндогенные инфекции, способствует угнетению фагоцитоза и других неспецифических факторов защиты, что способствует
нарушению естественных барьеров и распространению возбудителя.
Аналогичная ситуация имеет место и при гнойных раневых инфекциях экзогенной природы.
Лечение
Симптоматическое, этиотропное. Для лечения больных детей раннего возраста используют бифидобактерии, лактобактерин — препараты, содержащие молочно-кислые бактерии, являющиеся антагонистами Е. coli. Из антибиотиков используют все препараты, действующие на
грамотрицательные бактерии хлорамфеникол, пенициллин и цефалоспорины последних поколений, а также фторхинолон. Терапия этиотропная – антибиотики, колипротейный фаг.
Профилактика
Специфическая профилактика не разработана.
Неспецифическая профилактика сводится к соблюдению санитарно-гигиенических правил, санитарному контролю за источниками водоснабжения, пищевыми предприятиями, продуктами питания.
Диагностика
Осуществляется бактериологическим методом. Материал для исследования при кишечных эшерихиозах - испражнения, при парентеральных - материал из соответствующего инфекционного очага (моча, отделяемое раны, кровь, ликвор). Исследуемый материал (кроме крови и ликвора) засевается на дифференциальные лактозосодержащие среды, после инкубации при 37 ?С в течение 18 ч отбираются колонии, агглютинирующиеся поливалентной ОВ-агглютинирующей сывороткой, которые подвергаются идентификации до вида по биохимическим тестам с последующим определением их серовара.
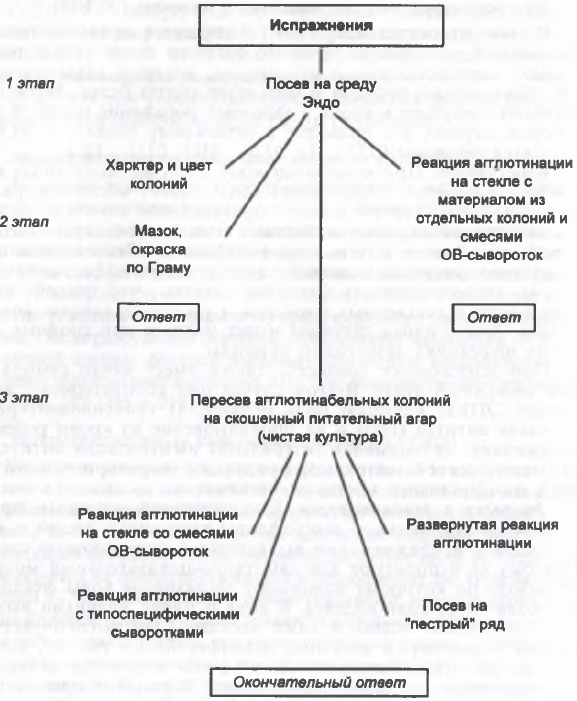 При кишечной коли-инфекции, а также при перитоните, септических и других состояниях
При кишечной коли-инфекции, а также при перитоните, септических и других состояниях
только на основании бактериологического исследования можно поставить окончательный диагноз заболевания. Идентификацию выделенной культуры проводят по морфологическим и биохимическим признакам и определению серовара возбудителя. Выделение чистой культуры сопряжено с определенными трудностями. Они связаны с наличием в исследуемом материале (фекалии) банальных эшерихий, представителей нормальной микрофлоры кишеника. Эти бактерии имеете с энтеропатогенными штаммами образуют однотипные колонии на дифференциально-диагностических средах. Идентификация выделенных эшерихий может быть произведена только на основании определения их принадлежности к определенной серогруппе, в реакциях агглютинации с диагностическими групповыми и типоспецифическими сыворотками.
Материалом для исследования при
-энтеральныхэшерихиозах являются фекалии,
-при парентеральных – гнойное отделяемое, при септических формах – кровь( в зависимости от локализации возбудителя.
Возможно использование методов иммуноиндикации и генной диагностики.
КАМПИЛОБАКТЕР
- Таксономия
Род Campylobacter (от греч. campylos — кривой, изогнутый). Известно около 18 видов возбудителя, из них наибольшее значение в патологии человека имеют С. jejuni, C. fetus, C. coli. Наибольшее значение в патологии человека имеет С. jejunii. Реже встречаются С. fetus и С. coli.
- Морфология
Кампилобактеры — грамотрицательные бактерии. Тонкие вибриоидные клетки, имеющие один или более витков спирали. Подвижные, совершают характерное винтовое движение с помощью одиночных жгутиков, расположенных на одном или обоих частях клетки. Капсулы и споры не образуют.
- Культуральные свойства
Микроаэро- и капнофилы. Растут на сложных питательных средах с добавлением крови, гемина, гидролизата белков, аминокислот, ростовых факторов и солей. Для подавления роста посторонней флоры в питательную среду добавляют антибиотики. Метаболизм дыхательного типа. Источником питания служат органические кислоты, в том числе аминокислоты. Хемоорганотрофы не требовательны к питательному субстрату.
В мазках из патологического материала часто располагаются попарно в виде ≪летящей чайки≫. При старении культуры переходят в кокковидную форму.
Кампилобактерии различаются по температуре культивирования: 37, 42 и, реже, 25 оС. Оптимальный для роста рН — 7,0.
Для культивирования используют сердечно-мозговой или шоколадный агар. Однако, даже на этих
высокопитательных средах видимый рост появляется на 6 сутки. Колонии круглые, мелкие, гладкие, выпуклые, блестящие.
- Биохимические свойства.
Не сбраживают углеводы. Оксидазоположительные и уреазоотрицательные. Пигментов не образуют.
Биохимические и ферментативные свойства выражены слабо. Проявляют оксидазную и каталазную активность, восстанавливают нитраты, образуют H2S.
- Резистентность
Резистентность кампилобактеров во внешней среде невысокая. Кампилобактерии чувствительны к действию высоких температур, однако достаточно долго сохраняются при низких температурах — из замороженного мяса их выделяют через несколько месяцев, на различных предметах при комнатной температуре они сохраняются до 2 нед. Невысокая. Чувствительны к факторам внешней среды,физическим и химическим факторам, в том числе к нагреванию и дезинфектантам. Устойчивы к целому ряду антибиотиков, но чувствительны к эритромицину и ципрофлоксацину.
- Антигенное строение.
Имеют О- и Н-антигены, по которым подразделяются на 60 сероваров. Облаают плазмидами, с которыми связана антибиотикоустойчивость. В настоящее время выделено свыше 50 О-серогрупп кампилобактеров.
- Факторы патогенности
Они обладают выраженной инвазивной активностью и способны к внутриклеточному размножению. Эндотоксин, связанный с ЛПС, а также продукция некоторыми штаммами холероподобного энтеротоксина и цитотоксина.
К факторам вирулентности относятся жгутики и муциназу, способствующие проникновению в слизистую оболочку тонкой кишки. Обладают умеренной пенетрационной активностью. Их токсичность связана с секрецией энтеротоксинов (функциональные блокаторы), нарушающими водно-солевой обмен через образование цАМФ, аналогично энтеротоксинам Е. coli и V. cholerae.
При разрушении кампилобактеров освобождается эндотоксин. Описаны цитотоксины, вызывающие гибель чувствительных клеток.
Основные факторы вирулентности:
- лейкоцидин, гемолизин, цитотоксины, тропизм к гепатоцитам.
- выраженная инвазивная активность,
-способность к внутриклеточному размножению;
-эндотоксин.
В зависимости от преобладания у данного штамма того или иного комплекса факторов вирулентности – будет наблюдаться та или иная форма клиники заболевания.
- Этиология.
Зооантропоноз. Источником инфекции являются сельско - хозяйственные животные и домашние птицы, редко человек., от которых кампилобактеры попадают в пищевые продукты (мясо, молоко) и воду.
В окружающей среде при 4°-10°С сохраняются около недели, (регистрированы пищевые, молочные и водные вспышки кампилобактериоза, чаще у детей). Естественная восприимчивость людей высокая. Кампилобактериоз распространен повсеместно и составляет 5–14% всех диарейных заболеваний. Механизм передачи — фекально-оральный
Пути передачи — пищевой, водный, контактно-бытовой или половой.
Случаи заболевания регистрируются в течение всего года, чаще в летне-осенние месяцы.
- Патогенез и клинические проявления
У человека кампилобактерии вызывают четыре группы заболеваний:
1) диарею (энтероколит), генерализованные поражения (сепсис);
2) локальные внекишечные инфекции (менингиты, энцефалиты, эндокардиты);
3) гнойно-воспалительные заболевания новорожденных;
4) заболевания ротовой полости - чаще всего вызывает C. Concаsus способствует возникновению гингивитов и стоматитов.
Гастроэнтерит возникает в результате действия энтеро- и цитотоксина, выделяемых некоторыми штаммами бактерий, размножающихся в ЖКТ.
Инкубационный период составляет, как правило, 2–3 дня. Болезнь начинается остро, с диспептических расстройств (диарея, рвота), интоксикации, повышения температуры; длится до 10 суток.
Наиболее частыми возбудителями диаррей являются C.coli, C.jejuni. Внекишечные формы кампилобактериозов обычно развиваются как осложнения кишечной, но могут возникать и как самостоятельное заболевание.
ЖКТ – форма;
1.Попав с пищей, водой, минует желудок и прикрепляется к эпителиальным клеткам тонкого кишечника.
2. Так как они способны к инвазии, проникают в эпителиальные клетки, способны к внутриклеточному паразитизму – вызывает let.клеток ( об этом косвенно говорит примесь слизи и свежей крови в испражнениях)
3. так как они ГРр (-), то выделяют эндотоксин, кроме того могут выделять экзо - эктеротоксигенные в 2-х субъединицах с холерогеном)
Инкубационный период длиться от 2-5 дней (иногда 10 дней).
Продромальный период – от нескольких часов до 2-3 суток; (в этот период на фоне общей интоксикации больные жалуются на миалгии и артралгии).
После этого наступает разгар заболевания, длится 3-10 дней
-появляется частый жидкий стул - слизеподобный с примесями свежей крови);
- реконвалесценция может продолжаться до 3-х недель. Долго держатся боли в брюшной полости;
- но если бактерии прорывает лимфатический барьер, то изгоняются в кровь вызывая различные внекишечные формы:
- менингит, перитонит,сепсис ,аппендицит
Иммунитет
При кампилобактериозе наблюдается гуморальный иммунный ответ. Однако образующиеся антитела не обладают выраженными протективными свойствами.
Лечение
Для лечения применяются фторхинолоны, аминогликозиды, хлорамфеникол (эритромицин или ципрофлоксацин).
Прифилактика
Вакцинопрофилактика не разработана. Проводятся противоэпидемические мероприятия, как при сальмонеллезах.
Лабораторная диагностика
Проводится бактериологическим методом с выделением чистой культуры возбудителя и ее идентификацией.
Основана на выделении чистой культуры возбудителя из испражнений, рвотных масс, промывных вод желудка посевом на кровяной или эритритный агар с железо-сульфитно-пируватными добавками. Для видовой дифференцировки культивируют при различных температурных режимах.
В мазках из фекалий определяют типичные по форме микробы в виде ≪летящей ласточки≫. Для серологической диагностики используют РИФ, РА, РПГА,РСК. Экспресс-диагностика — постановка РИФ со специфическими люминесцентными сыворотками.
ХОЛЕРА
Холера – антропонозная карантинная особо опасная инфекция с фекально-оральным механизмом передачи, характеризующаяся поражением тонкой кишки и нарушением водно-солевого и белкового обмена, обезвоживанием, токсикозом и гастроэнтеритом.
Таксономия
Возбудителем холеры являются бактерии семейства Vibrionaceae, рода Vibrio, вида Vibrio cholerae серогрупп О1 и О139.
Внутри вида Vibrio cholerae различают два основных биовара: биовар Сlassic и биовар El-Tor.
Этот вид включает многочисленных представителей, объединенных в один вид на основании морфологических, культуральных, биохимических свойств и данных геносистематики. Внутри вида они подразделяются по ферментативной активности, антигенному строению и патогенным возможностям. Возбудителями холеры являются патогенные представители данного вида (V.cholerae O1 и V.cholerae О139 Бенгал). Все другие холерные вибрионы являются условно-патогенными. Они могут вызывать у человека вибрионогенные диарреи.
Морфология
Холерный вибрион - грамотрицательная палочка в форме запятой, длиной 2-4 мкм, толщиной 0,5 мкм. Не образует спор и капсулы, монотрих, чрезвычайно подвижен.
Культуральные свойства
Аэроб или факультативный анаэроб. Является факультативным анаэробом, но предпочитает аэробные условия роста, поэтому на поверхности жидкой питательной среды образует пленку. Холерный вибрион неприхотлив в росте и может расти на простых средах. На плотных питательных средах образует мелкие, прозрачные, округлые колонии. Оптимальная температура роста 37 °С и рН 8,5-9,0, для оптимального роста требует присутствия в среде 0,5% натрия хлорида.
Средой накопления является 1% щелочная пептонная вода, на которой он образует пленку в течение 6-8 ч, и щелочной агар, на котором растут маслянистые голубоватые колонии.
Элективной средой является тиосульфат-цитратный сахарозо-желчесодержащий агар (TCBS-среда), на котором образует колонии желтого цвета.
Биохимические свойства
Биохимически активен:
1. Обладает протеолитическими и сахаролитическими свойствами: продуцирует индол и лизиндекарбоксилазу, разжижает в воронковидной форме желатин.
2. Ферментирует глюкозу, сахарозу, маннозу, крахмал, лактозу (медленно).
3. Не сбраживает рамнозу, арабинозу, дульцит, инозит, инулин.
4. Обладает нитратредуктазной активностью.
5. Продуцирует оксидазу.
Вибрионы относятся к хемоорганотрофам с окислительным и бродильным типами метаболизма.
Дифференциация среди биоваров возбудителей холеры проводится по биохимическим свойствам, а также по способности гемолизировать эритроциты барана, агглютинировать куриные эритроциты; чувствительности к полимиксину и чувствительности к бактериофагам. V. cholerae О139 по фенотипическим признакам относится к биовару El-Tor, который резистентен к полимиксину, агглютинирует куриные эритроциты и гемолизирует эритроциты барана, дает положительный результат в реакции Фогеса-Проскауэра и гексаминовом тесте.
Антигенная структура
Обладает термостабильным О- и Н-антигенами. В зависимости от строения О-антигена различают более 200 серогрупп, среди которых возбудителями холеры являются серогруппы О1 и О139. Внутри серогруппы О1 в зависимости от сочетания А-, В- и С-субъединиц происходит подразделение на серовары: Огава (АВ), Инаба (АС) и Гикошима (АВС). Н-антиген является общеродовым антигеном.
Холерные вибрионы имеют два антигена: О-антиген типоспецифический термолабильный и Н-антиген жгутиковый видоспецифический термостабильный. Возбудители холеры имеют 01-антиген Вибрионы, относящиеся к серогруппам 02, 03, 04 могут вызывать энтериты и гастроэнтериты. 01-антиген состоит из трех компонентов — А, В, С, разные сочетания которых образуют серовары Огава (АВ), Инаба (АС), Гикошима(АВС). Часто выделяются вибрионы, не агглютинирующиеся 01 антисывороткой. Их называют неагглютинирующимися НАГ-вибрионами.
Резистентность
Возбудители холеры чувствительны к УФ-лучам, высушиванию, дезинфектантам (за исключением четвертичных аминов), кислым значениям рН, нагреванию. Возбудитель холеры, особенно биовар Эль-Тор, способен к существованию в воде в симбиозе с гидробионтами, водорослями, в неблагоприятных условиях может переходить в некультивируемую форму. Эти свойства позволяют отнести холеру к антропонозно- сапронозным инфекциям.
Факторы патогенности
Факторы патогенности V. choleras:
1. Подвижность
2. Хемотаксис
3. Факторы адгезии и колонизации
4. Ферменты: муциназа, протеазы, нейроминидаза, лецитипеаза
5. Экзотоксин – холероген, который и обуславливает патогенез холеры
Молекула холерогена состоит из двух фрагментов – А и В. Фрагмент А состоит из двух петидов – А1 и А2, и обладает специфическим свойством холерного токсина. Фрагмент В состоит из пяти одинаковых субъединиц, и выполняет две функции:
1.Распознаёт рецептор энтероцита, и связывается с ним.
2.Формирует внутринемембранный гидрофобный канал для прохождения субъединицы А.
Пептид А2 служит для связи фрагментов А и В. Собственно токсическую функцию выполняет пептид А1. Он взаимодействует с НАД, вызывает его гидролиз, образующаяся при этом АДФ – рибоза связывается с аденилатциклазой. Это ведёт к угнетению гидролиза ГТФ. Возникший комплекс ГТФ+аденилатциклаза вызывает гидролиз АТФ с образованием цАМФ.
6.Помимо холерогена холерный вибрион синтезирует и выделяет фактор, повышающий проницаемость капилляров.
7.У холерных вибрионов обнаружены и другие экзотоксины (LT, ST, SLT).
Липополисарарид V. choleras обладает сильным эндотаксическим свойством.
Главными факторами патогенности являются токсинкорегулируемые пили (Тср), холерный энтеротоксин (СТ) и нейраминидаза, растворимая гемагглютининпротеаза.
1. Токсинкорегулируемые пили (являются пилями IV типа): обеспечивают колонизацию микроворсинок тонкой кишки, участвуют в образовании биопленок на поверхности панциря гидробионтов.
2. Холерный энтеротоксин - белок с молекулярной массой 84 000 Д, синтез которого осуществляется геном, локализованном на конвертирующем бактериофаге СТХ. Только серогруппы О1 и О139 лизогенизированы этим бактериофагом. Токсин состоит из 1 субъединицы А и 5 субъединиц В.
В-субъединицы связывают всю молекулу токсина с клеточным рецептором – моносиаловым ганглиозидом GM1, которым очень богаты эпителиальные клетки слизистой оболочки тонкой кишки. Для этого от него должна быть отщеплена сиаловая кислота, что осуществляется ферментом нейраминидазой (способствует реализации действия токсина). После прикрепления В-субъединицы, субъединица А проникает в клетку, где она активирует аденилатциклазу, переводя ее в постоянное активное состояние => усиление синтеза цАМФ => изменяется активный транспорт ионов: в области крипт эпителиоциты усиленно выделяют ионы Cl-, а в области ворсинок затрудняется всасывание Na и Cl, что составляет осмотическую основу для выделения в просвет кишечника воды.
3. Растворимая гемагглютининпротеаза способствует откреплению возбудителя от поверхности кишечника, давая возможность возбудителю инфицировать новые участки тонкой кишки.
4. Эндотоксин, активируя каскад арахидоновой кислоты, запускает синтез простагландинов, результатом действия которых являются сокращение гладкой мускулатуры кишечника и развитие тенезм
5. Добавочные белковые токсины, которые участвуют в увеличении проницаемости стенки кишечника.
Эпидемиология
Холера известна с древних времен. Но до начала XIX века она встречалась только в Индии, где расположен гиперэндемический очаг этого заболевания.
Место обитания - теплая вода. В воде у вибриона отсутствует О-АГ и имеется всего 1 копия гена, отвечающего за синтез токсина, поэтому в воде микроб авирулентен. При попадании в организм человека ( и повышении температуры) происходит амплификация генов и появляется О-АГ, т.е. микроб приобретает вирулентность.
Источники инфекции: больной человек, бактерионосители, а также водная среда и гидробионты.
Пути передачи: водный, алиментарный, контактно-бытовой.
Восприимчивый коллектив: лица с пониженной кслотностью желудочного сока, страдающие анацидным гастритом. Носительство вибриона Эль-Тор встречается чаще, чем классического вибриона (на 1 больного холерой приходится 10-1000 носителей). Больной наиболее опасен в первые дни болезни: в это время в испражнених и рвотных массах содержится наибольшее количество возбудителя.
Лечение
Для лечения проводится патогенетическая терапия, направленная на нормализацию водно-солевого обмена, и этиотропная антибиотикотерапия. Для поздней профилактики и лечения чаще всего применяют тетрациклин.
Профилактика
Профилактика холеры направлена главным образом на выполнение санитарно-гигиенических требований и проведение карантинных мероприятий.
Для специфической профилактики по эпидпоказаниям, имеющей вспомогательное значение, применяют холерную убитую вакцину и комплексный препарат, состоящий из холерогена-анатоксина и О-антигена сероваров Огава и Инаба.
 Основные средства борьбы с холерой — раннее выявление больных и вибрионосителей, а также лиц, контактировавших с ними с последующей их изоляцией. Для вакцинопрофилактики используют несколько видов вакцин: корпускулярная убитая, холероген-анатоксин, живая для перорального применения. В нашей стране массовая вакцинация не проводится.
Основные средства борьбы с холерой — раннее выявление больных и вибрионосителей, а также лиц, контактировавших с ними с последующей их изоляцией. Для вакцинопрофилактики используют несколько видов вакцин: корпускулярная убитая, холероген-анатоксин, живая для перорального применения. В нашей стране массовая вакцинация не проводится.
Диагностика
Материалом для исследования служат испражнения, рвотные массы, желчь, пищевые продукты, вода, гидробионты, смывы с объектов окружающей среды. Материал засевается на элективную питательную среду с последующим субкультивированием на неселективных средах и идентификацией по антигенной структуре и биохимическим свойствам. Для экспресс-диагностики используют РИФ и ПЦР.
Иерсинии (род Yersinia)
Род Yersinia включает 11 видов, из которых в патологии человека основное значение имеют 3 вида: возбудитель чумы Y. Pestis и энтеропатогенные иерсинии: возбудитель псевдотуберкулеза Y. pseudotuberculosis и возбудитель кишечного иерсиниоза Y. Enterocolitica.
Подразделение внутри рода на виды производится на основе биохимических свойств и подвижности.
Все виды иерсиний обладают способностью сохраняться в лимфоидной ткани, размножаясь в макрофагах.
В связи со своей способностью размножаться при различных температурах и в различных местах обитания иерсинии выработали два механизма, контролирующих экспрессию генов, кодирующих факторы патогенности. Один механизм реагирует на изменение температуры, другой - на концентрацию ионов кальция.
ЧУМА (Y. pestis)
Чума - острая природно-очаговая инфекция, относящаяся к группе карантинных (конвенционных), характеризующаяся тяжелой интоксикацией, лихорадкой, поражением лимфатических узлов, легких, сепсисом и высокой летальностью.
Морфология
Y. pestis является неподвижной палочкой размером 1,5x0,7 мкм, овоидной формы, с биполярным окрашиванием анилиновыми красителями, напоминающей по форме английскую булавку. Имеет нежную капсулу.
Культуральные свойства
Факультативный анаэроб. Растет на простых питательных средах. Может расти в широком диапозоне температур от 2 до 40 0С, оптимум – 28 0С. Для ускорения роста в питательные среды добавляют стимуляторы, сульфит натрия и гемолизированную кровь. При росте на плотных питательных средах через 8-12 ч появляются колонии в виде битого стекла. Через 18-20 ч инкубации вирулентные бактерии образуют колонии в R-форме, которые имеют форму кружевных платочков со светлым центром и фестончатыми краями. Бактерии с пониженной вирулентностью образуют колонии в S-форме. На жидких средах растут в виде пленки, от которых спускаются нити, напоминающие пещерные сталактиты; на дне образуется хлопьевидный осадок.
Биохимические свойства
Биохимическая активность достаточно высокая. Синтезирует плазмокоагулазу, фибринолизин, гемолизин, лецитиназу, РНКазу. Основные биохимические свойства, необходимые для идентификации: не разжижает желатину, не расщепляет мочевину, не ферментирует рамнозу и сахарозу, ферментирует декстрин. По отношению к утилизации глицерина подразделяется на хемовары.
Антигенная структура
Обладает комплексом антигенов, многие из которых относятся к факторам патогенности. Имеет термостабильный О-антиген и термолабильный капсульный антигены. Протективной активностью (вызывают наиболее сильный имунный ответ) обладает F1-антиген и LCR-белок. Имеет антигены, общие с антигенами эритроцитов 0-группы крови человека.
Y. pestis имеет несколько антигенов. Антиген F1 представляет собой основной компонент поверхностной структуры бактериальных клеток белковой природы. V-антиген также является белком, W-антиген — липопротеидным комплексом. Эти антигены связаны с клеточной стенкой. Y. pestis имеет перекрестные антигены с другими иерсиниями и энтеробактериями (Є. coli, Salmonella), а так же с эритроцитами человека О-группы.
Резистентность
Факультативные психрофилы. При понижении температуры увеличиваются сроки выживания бактерий. При -22 0С бактерии сохраняют жизнеспособность 4 мес, в замороженных трупах и блохах - до 1 года. При нагревании до 50 0С гибнет в течение 10 мин, до 100 0С - в течение 1 мин. Чувствителен к сулеме в концентрации 0,1%, к 3-5% растворам лизола и фенола, УФ-облучению.
 6. Факторы патогенности
6. Факторы патогенности
1. Плазмида pYV детерминирует синтез ТТСС, эффекторные белки которой обладают антифагоцитарной активностью.
2. Крупная плазмида pFra детерминирует синтез F1-антигена, капсульного белка, препятствующего поглощению микроба фагоцитами, и F2-фракции мышиного токсина, который не играет роли в патогенезе чумы у людей, но необходим в процессе колонизации кишечника блохи.
3. Малой плазмида pPst регулирует синтез ферментов патогенности: плазмокоагулазы (активирующей плазминоген протеазу), обеспечивающую резистентность к действию комплемента, фибринолизина и пестицина.
 4. Гены хромосомы кодируют внеклеточную аденилатциклазу, супероксиддисмутазу и белок рН6, которые обладают антифагоцитарной активностью.
4. Гены хромосомы кодируют внеклеточную аденилатциклазу, супероксиддисмутазу и белок рН6, которые обладают антифагоцитарной активностью.
Эпидемиология
Резервуаром возбудителя природной чумы являются дикие, синантропные и домашние животные (всего около 300 видов). Основными носителями служат грызуны (сурки, суслики, полевки, песчанки, крысы, зайцы и др.). У грызунов, впадающих зимой в спячку, чума протекает в хронической латентной форме. Эти животные являются источником инфекции в межэпидемический период.
Природные очаги чумы существуют на всех континентах, кроме Австралии и Антарктиды. В России такими очагами являются регионы Закавказья и Поволжья. Основными носителями возбудителя чумы в природных очагах являются грызуны (суслики, сурки, песчанки, тарбаганы, около 300 видов животных). Вторичные очаги, связанные с деятельностью человека, обнаруживаются в географических зонах между 35? северной широты и 35? южной широты. В них источниками и хранителями возбудителя служат домовые виды крыс и мышей, от них заражаются некоторые виды домашних животных, в частности верблюды и, возможно, кошки.
Специфическими переносчиками в обоих типах очагов служат блохи вида Xenopsylla cheopsis.
В инфицированной блохе возбудитель размножается в преджелудке, а при кровососании человека попадает в ток его крови.
Человек может заражаться:
• в очаге трансмиссивно через укусы инфицированных блох вида Xenopsylla cheopsis;
• при контакте с инфицированными животными (разделка шкур и мяса зараженных животных);
• алиментарным путем (редко) при употреблении в пищу продуктов, обсемененных чумным микробом;
• аэрогенно от больного с легочной формой чумы. Восприимчивость людей к чуме очень высокая. Вследствие своей контагиозности, возможности аэрогенного инфицирования человека и устойчивости в аэрозоле Y. pestis входит в 1-ю группу потенциальных агентов биологического терроризма.
Иммунитет
Различной длительности и напряженности. Протективная активность обеспечивается главным образом клеточным иммунным ответом, реализующимся через иммунные макрофаги. Иммунитет ограничен по длительности и напряженности. Описаны случаи повторных заболеваний.
Лечение
Больные чумой подлежат строгой изоляции и обязательной госпитализации. Для лечения используют этиотропную антибиотикотерапию. Прогноз неблагоприятный, так как при генерализованных формах болезни летальность может достигать 100%.Для лечения применяют стрептомицин и другие антибиотики.
Профилактика
Специфическая профилактика осуществляется живой вакциной из штамма EV (имеется таблетированная форма). После вакцинации развивается иммунитет продолжительностью до 6 мес. Вакцина вводится однократно накожно или подкожно с помощью безыгольного инъектора; разработана таблетированная живая вакцина из штамма EV дляперорального применения, а также аэрозольная вакцина.
Неспецифическая профилактика включает: предупреждение заболевания людей и возникновения эпизоотий в природных очагах, предупреждение завоза чумы на территорию страны, которое осуществляется согласно специальным ≪Международным санитарным правилам≫; предупреждение заражения лиц, работающих с зараженным Y. pestis материалом, осуществляемое согласно регламенту работы противочумных учреждений. Вся работа с зараженным Y. Pestis материалом и в
госпиталях для больных чумой должна проводиться в специальных защитных противочумных костюмах с соблюдением строгого порядка их надевания и снятия. В случае появления больного чумой проводятся карантинные мероприятия.

Диагностика
 Для диагностики используют бактериологический, биологический, бактериоскопический и серологические методы исследования. Материалом для исследования являются пунктаты бубона, мокрота, отделяемое кожных язв, рвотные массы, кровь, трупный материал. Материал засевается на жидкие и плотные питательные среды, которые инкубируют при 28 ?С в течение 12-20 ч. Биопробу ставят на морских свинках. В качестве экспресс-диагностики используют РИФ, ПЦР, фагодиагностику. Серологическое исследование проводится постановкой ИФА, РНГА с применением парных сывороток.
Для диагностики используют бактериологический, биологический, бактериоскопический и серологические методы исследования. Материалом для исследования являются пунктаты бубона, мокрота, отделяемое кожных язв, рвотные массы, кровь, трупный материал. Материал засевается на жидкие и плотные питательные среды, которые инкубируют при 28 ?С в течение 12-20 ч. Биопробу ставят на морских свинках. В качестве экспресс-диагностики используют РИФ, ПЦР, фагодиагностику. Серологическое исследование проводится постановкой ИФА, РНГА с применением парных сывороток.
Резистентность
Возбудитель устойчив во внешней среде: в воде при комнатной температуре выживает до 1,5 мес., при 4 0С — до полугода; в овощах (капуста, морковь, лук) и фруктах выживает несколько месяцев. Малоустойчив к нагреванию при 60 0С, кипячению, УФ-свету, дезинфектантам.
Антигенная структура
Обладает О- и Н-антигенами. По О-антигенну подразделяется на 8 сероваров. Б О-антиген
отличается от подобных антигенов других энтеробактерий структурой повторяющихся звеньев полисахаридной цепи
ЭПС. Различают 10 сероваров этих бактерий, которые отличаются друг от друга по О-антигенной специфичности. Наибольшее значение в патологии человека имеют I, III и IV серовары.
Эпидемиология
Резервуаром возбудителя в природе являются многие виды млекопитающих (рогатый скот, кошки) и птиц, грызуны (мыши, крысы), выделяющие микроб с испражнениями, а также вода, почва, в которых накапливается микроб. Человек заражается водным и алиментарным путями. Основные факторы передачи — вода и овощи. Овощи заражаются Y. pseudotuberculosis в результате их загрязнения в хранилищах испражнениями инфицированных возбудителем мышей, а также непосредственно почвой и водой. Заражение человека от больного или носителя не происходит. Естественная восприимчивость людей к возбудителю высокая. Болезнь распространена повсеместно, возникает в виде спорадических и эпидемических вспышек, имеет сезонность (февраль–
март). В районе Дальнего Востока РФ заболевание протекает в виде эпидемических вспышек в генерализованной форме под названием дальневосточная скарлатиноподобная лихорадка.
Патогенез и клиника
Инкубационный период — 3–10 дней. Заболевание протекает в виде локальной и генерализованной форм. Начало острое или подострое, сопровождается лихорадкой. Инвазировав слизистую кишечника трансцитозом через М-клетки, выделяя при этом цитотоксин, Y. pseudotuberculosis
вследствие незавершенности фагоцитоза попадает в мезентериальные лимфатические узлы, вызывая мезентериальный лимфаденит. В результате развития мезентериального лимфаденита отмечаются боли в эпигастральной области, симптомы раздражения брюшины, которые имитируют симптомы острого аппендицита.
В случае прорыва лимфатического барьера наступает бактериемия, в результате которой микроб разносится по организму, вызывая образование гранулем и микроабсцессов в макрофагальных элементах печени, селезенки, легких, суставов. При этом происходит аллергизация организма. На 1–6-й день появляется розеолезная сыпь. Возможен летальный исход.
Иммунитет
Непрочный, нестерильный. Антитела не обладают протективной активностью. В организме происходит развитие ГЗТ.
Лечение
— этиотропная антибиотикотерапия.
Профилактика
Специфическая профилактика не разработана. Неспецифическая профилактика включает постоянный санитарный контроль за водоснабжением, технологическим режимом обработки и хранения пищевых продуктов, борьбу с грызунами.
Возбудитель кишечного иерсиниоза (Y. enterocolitica)
Кишечный иерсиниоз — инфекционное заболевание с поражением тонкого и толстого кишечника и развитием мезентериального лимфаденита. Возбудитель кишечного иерсиниоза Y. Enterocolitica.
Морфология
Грамотрицательные палочки,подвижные, капсулу не образуют.
Культуральные свойства
Хорошо растут на обычных питательных средах. Оптимум роста 22–28 0С.
Биохимические свойства
Обладают выраженной биохимической активностью. Внутри вида подразделяется на пять хемоваров по спектру биохимической активности — индолообразованию, утилизации эскулина, реакции Фогеса–Проскауэра. Заболевание чаще вызывают биовары 2, 3 и 4. Основные биохимические признаки, необходимые для идентификации: расщепление мочевины, ферментация сахарозы, отсутствие ферментации рамнозы, продукция орнитиндекарбоксилазы.
Антигенная структура
Обладает О- и Н-антигенами. По строению О-антигена подразделяется более чем на 30 сероваров. Наиболее часто заболевание у человека вызывают серовары О3, О5, О8, О9.
Патогенность
Помимо общих для энтеропатогенных иерсиний факторов патогенности, Y. enterocolitica обладает термостабильным энтеротоксином, гомологичным термостабильному энтеротоксину ЭТКП.
Эпидемиология
Кишечный иерсиниоз выявляется во всех странах, возникает в виде групповых, семейных, внутрибольничных вспышек. Резервуаром возбудителя в природе являются почва, вода, инфицированные через них растения. Инфицированные вода и растения способствуют распространению инфекции среди сельскохозяйственных животных. Резервуаром и источником
инфекции могут быть крупный рогатый скот, свиньи, собаки, кошки, птицы. Основные пути передачи — водный и алиментарный, через воду, молоко, овощи.
Лечение
— этиотропная антибиотикотерапия.
Профилактика
Специфическая профилактика не разработана.
Неспецифическая профилактика аналогична таковой при псевдотуберкулезе.
® Это условно-патогенные микроорганизмы.
® Инфекция зооантропонозная (источник инфекции – грызуны); так как это кишечная инфекция, путь передачи – алиментарный.
Попав в организм иерсинии проходят в желудок => тонкий кишечник и прикрепляются к эпителиальным клеткам тонкого кишечника.
Заболевание протекает в несколько фаз:
Фаза – энтеральная
Клиника гастроэнтероколита, или токсической диспепсии. Иерсинии попадают в организм, прикрепляются к тонкому кишечнику. В наружной мембране иерсиний расположен белок инвазин, который помогает процессу пенетрации возбудителя в эукариотические клетки.
Фаза – регионарная
Клиника – симптомы энтероколита с мезентеральным лимфоаденитом (протекает с клиникой острого аппендицита) Раз острый аппендицит оперируют => отросток в лабораторию ( даже в бак).
Часто оперируют напрасно:
1. платно;
2. 10-15% осложнений – внутрибольничные;
3. продлевают срок в стационаре.
Если есть сомнения, что делать, то проводят экспресс-диагностику:
- ДНК-зондирование;
- ПЦР;
- РИФА;
- коагглютинация.
На этой фазе заболевание может закончиться, тогда кишечный иерсиниоз протекает как типичная кишечная инфекция, но возбудитель может проникнуть в кровь, тогда начинается
Фаза – генерализованная.
4 фаза – вторичных очаговых и аллергических проявлений.
Клиника – могут наблюдаться самые различные симптомы:
- гепатиты;
- артриты;
- крапивница.
ЧАСТНАЯ МИКРОБИОЛОГИЯ
МОДУЛЬ
Микробиологическая диагностика бактериальных острых кишечных инфекций
Острые кишечные инфекции продолжают оставаться одной из самых широко распространенных форм инфекционной патологии. Главные из них: эшерихиозы, дизентерия, сальмонеллезы, в том числе брюшной тиф и паратифы, а также пищевые токсикоинфекции несальмонеллезной природы.
По частоте встречаемости возбудителей острых кишечных инфекций среди них выделяют различные уровни приоритетности, что необходимо учитывать при проведении лабораторной диагностики этих инфекций.
Так, например, Salmonella typhi, Salmonella paratyphi, Shigella, Vibrio cholerae серогруппа О1, нехолерные вибрионы, Aeromonas, Plesiomonas относятся к патогенам высокого уровня приоритетности, а не относящиеся к возбудителю брюшного тифа сальмонеллы и эдвардсиеллы, Yersinia enterocolitica, Campylobacter jejuni, Clostridium difficile – к патогенам среднего уровня приоритетности.
Патогены низкого уровня приоритетности – это энтеропатогенные, энтеротоксигенные, энтероинвазивные и энтерогеморрагические Escherichia coli.
Исследование на наличие патогенных энтеробактерий проводится не только с диагностической целью, но и при обследовании лиц определенных контингентов, предусмотренных нормативными документами Минздрава РФ, а также по эпидемиологическим показаниям в целях выявления носителей − источников инфекции.
Для микробиологической диагностики острых кишечных инфекций могут использоваться:
1)бактериологический метод − основной метод при большинстве инфекций;
2)серодиагностика − чаще ретроспективно (дизентерия, пищевые токсикоинфекции, эшерихиозы), но могут использоваться для серодиагностики тифо-паратифозного заболевания, иерсиниозов - реакции агглютинации (РПГА,латекс-агглютинации);
3)иммуноиндикация − для ориентировочной экспресс-диагностики –чаще для диагностики эшерихиозов, сальмонеллезов, дизентерии – реакция иммунофлюоресценции, РПГА с антительным шигеллезным диагностикумом, реакция ко-агглютинации с реагентом на сальмонеллы группы В (при пищевой токсикоинфекции).
Дата: 2019-07-30, просмотров: 562.