Диоксид селена (оксид селена(IV)) — неорганическое соединение селена и кислорода с формулой SeO2, бледно розовые кристаллы, пары́ имеют желтовато-зелёный цвет и запах гнилой редьки, реагирует с водой (ангидрид селенистой кислоты).
ПОЛУЧЕНИЕ:
Окисление селена:
· Se + O2 → SeO2 (при to =250C; кат. NO2)
Действие перегретого пара на селен:
· Se + 2H2O → SeO2 + 2H2 (при to =150C)
Окисление селена горячей концентрированной серной кислотой:
· Se + 2H2SO4 → SeO2 + 2SO2↑ + 2H2O (при to =100C)
Окисление красного селена йодноватой кислотой:
· 5Se + 4HIO3 → 5SeO2 + 2I2 + 2H2O (при to =200C)
Окисление селена горячей концентрированной селеновой кислотой:
· Se + 2H2SeO4 → 3SeO2 + 2H2O (при to =100C)
Разложение триоксида селена и пентаоксида диселена:
· 2SeO3 → 2SeO2 + O2 (при to =185C)
· 2Se2O5 → 4SeO2 + O2↑ (при to =260C)
Разложение селенистой кислоты:
· H2SeO3 → SeO2 + H2O (при to =70C)
Окисление селенидов металлов кислородом:
· Th2Se5 + 7O2 → 2ThO2+5SeO2
ХИМИЧЕСКИЕ СВОЙСТВА:
Реагирует с водой, образуя селенистую кислоту:
· SeO2 + H2O → H2SeO3
Реагирует с гидроксидами металлов, образуя селениты:
· SeO2 + 2NaOH → Na2SeO3 + H2O
Обратимо разлагается при сильном нагревании:
· 2SeO2 → 2SeO + O2 (при to =1000C)
Реагирует с галогеноводородами:
· SeO2 + 2HCl → H2[SeO2Cl2]
Растворённый в серной кислоте диоксид селена реагирует с хлороводородом с образованием оксихлорида селена (аналог тионилхлорида):
· SeO2 + 2HCl → SeCl2O + H2O
Реагирует с тионилхлоридом с образованием тетрахлорида селена:
· SeO2 + 2SCl2O → SeCl4 + 2SO2 (при to =75-90C)
Окисляется концентрированной перекисью водорода:
· SeO2 + H2O2 → H2SeO4 (при to =90C)
Восстанавливается сероводородом:
· SeO2 + 2H2S → Se + 2S + 2H2O
Селенистая кислота́ — неорганическое химическое соединение селена, кислота. Химическая формула H2SeO3. Является аналогом сернистой и теллуристой кислот. Слабая кислота. Образует два ряда солей — кислые и средние соли — биселениты и селениты в результате реакций нейтрализации щелочей (и кислые, и средние), или сплавления с оксидами металлов (средние)Токсична.
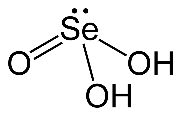
ХИМИЧЕСКИЕ СВОЙСТВА:
Сильные окислители окисляют до элемента в своей степени окисления +6, например:
· H2SeO3 + 10КMnO4 → 5K2SeO4 + 10H2SO4 + 10MnO2 + 5H2O
Является окислителем средней силы, проявляет окислительно-восстановительную двойственность:
· реагирует с концентрированным растворами галогеноводородных кислот (кроме фтороводородной), окисляя их до галогенов. В результате этой реакции элементарный селен выпадает в осадок;
H2SeO3+HCl+SnCl2= Se + SnCl4
· может быть окислена сильными окислителями (хлор и бром в щелочной среде, озон в сильнокислой среде, пероксид водорода) до селеновой кислоты
H2SeO3+Br2+H2O=H2SeO4+2HBr
Триоксид селена (оксид селена(VI)) — неорганическое соединение селена и кислорода с формулой SeO3, бесцветные кристаллы, растворимые в концентрированной серной кислоте, диоксиде серы, уксусном ангидриде, реагирует с водой, сильный окислитель, очень ядовит.
ПОЛУЧЕНИЕ:
Разложение селеновой кислоты:
· H2SeO4 → SeO3 + H2O (to; кат. = P2O5)
Действие триоксида серы на селенат натрия:
· Na2SeO4 + SO3 → SeO3 + Na2SO4 (при to= 110C)
ХИМИЧЕСКИЕ СВОЙСТВА:
При нагревании разлагается:
· 2SeO3 → 2SeO2 + O2↑ (при to>185C)
Реагирует с водой:
· SeO3 + H2O → H2SeO4
Реагирует с щелочами:
· SeO3 + 2NaOH → Na2SeO4 + H2O
Является сильным окислителем:
· SeO3 + 2HCl → H2SeO3 + Cl2↑ (при to=0C)
Селе́новая кислота́ — неорганическая кислота, состоящая из катиона водорода и аниона селената (SeO42-). Химическая формула H2SeO4. Сильная кислота, токсична.
ПОЛУЧЕНИЕ:
Взаимодействие оксида селена(VI) с водой:
· SeO3 + H2O ⟶ H2SeO4
Взаимодействие селена с хлорной или бромной водой:
· Se + 3Cl2 + 4H2O ⟶ H2SeO4 + 6HCl
Взаимодействие селенистой кислоты или оксида селена(IV) с пероксидом водорода:
· SeO2 + H2O2 ⟶ H2SeO4
· H2SeO3 + H2O2 ⟶ H2SeO4 + H2O
ХИМИЧЕСКИЕ СВОЙСТВА:
Сильный окислитель, более сильный чем серная кислота, даже в умеренно разбавленном растворе.(Так, например, селеновая кислота способна к окислению соляной кислоты (ввиду большего значения электродного потенциала), в отличие от серной, которая не взаимодействует с ней:
· H2SeO4 + 2HCl → H2SeO3 + Cl2 + H2O
Горячая, концентрированная селеновая кислота способна растворять золото, образуя красно-жёлтый раствор селената золота(III):
· 2Au + 6H2SeO4 ⟶ Au2(SeO4)3 + 3H2SeO3 + 3H2O
Диокси́д теллу́ра — неорганическое соединение теллура и кислорода с формулой TeO2, бесцветные кристаллы, не растворяется в воде. Ангидрид теллуристой кислоты.
ПОЛУЧЕНИЕ:
Окисление теллура:
· Te + O2 → TeO2 (при to =450C)
Действие перегретого пара на теллур:
· Te + 2H2O → TeO2 + 2H2 (при to=100-150C)
Окисление теллура горячей концентрированной азотной кислотой:
· Te + 4HNO3 → TeO2 + 4NO2↑ + 2H2O (при to=100)
Окисление теллура калийной селитрой:
· Te + 2KNO3 → TeO2 + 2KNO2 (при to=400-430C)
Разложение горячими кислотами теллуритов:
· Na2TeO3 + 2HNO3 → TeO2↓ + 2NaNO3 + H2O (при to=100C)
Разложение триоксида теллура:
· 2 T e O 3 → 400 o C 2 T e O 2 + O 2
Разложение теллуристой кислоты и ортотеллуровой кислоты:
· H 2 T e O 3 → 40 o C T e O 2 + H 2 O
· 2 H 6 T e O 6 → 400 − 600 o C 2 T e O 2 + O 2 + 6 H 2 O ХИМИЧЕСКИЕ СВОЙСТВА:
Реагирует с кислотами, образуя оксосоли:
· 2 T e O 2 + 2 H C l → T e 2 O 3 C l 2 + H 2 O
· 2 T e O 2 + H 2 S O 4 → T e 2 O 3 S O 4 + H 2 O
При взаимодействии с концентрированными галогеноводородными кислотами образует комплекс:
· TeO 2 + 6 HI = H 2 [ TeI 6 ] + 2 H 2 O
Реагирует с гидроксидами и оксидами щелочных металлов, образуя теллуриты:
· T e O 2 + 2 N a O H → N a 2 T e O 3 + H 2 O
· T e O 2 + K 2 O → K 2 T e O 3
Обратимо разлагается при сильном нагревании:
· 2 T e O 2 → 1000 o C 2 T e O + O 2
Восстанавливается водородом:
· T e O 2 + 2 H 2 → 1000 o C T e + 2 H 2 O
Теллуристая кислота — неорганическое соединение, двухосновная кислота с формулой H2TeO3, бесцветные кристаллы, не растворимые в воде.
ПОЛУЧЕНИЕ:
Из раствора выпадает в виде гидрата TeO2•n H2O, который при стоянии переходит в H2TeO3•H2O.
Действие разбавленной кислоты на теллурит натрия:
· Na2TeO3 + 2HNO3 → H2TeO3↓ + 2NaNO3 (при to=0C)
Восстановление триоксида теллура:
· 2TeO3 + 2HCl → H2TeO3↓ + Cl2↑ (при to=100C)
Восстановление ортотеллурата натрия:
· Na6TeO6 + 8HCl → H2TeO3↓ + Cl2↑ + 6NaCl + 3H2O
ХИМИЧЕСКИЕ СВОЙСТВА:
Разлагается при незначительном нагревании:
· H2TeO3 → TeO2 + H2O (при to = 40C)
С щелочами образует теллуриты:
· H2TeO3 + 2NaOH → Na2TeO3 + 2H2O
Является сильным окислителем:
· H2TeO3 + 4HCl → Te↓ + 2Cl2↑ + 3H2O
Является слабым восстановителем:
· H2TeO3 + H2O2 + 2NaOH → Na2H4TeO6↓ + H2O
Вступает в обменные реакции:
· H2TeO3 + Ca(NO3)2 → CaTeO3↓ + 2HNO3
Триокси́д теллу́ра — неорганическое соединение теллура и кислорода с формулой TeO3.
ХИМИЧЕСКИЕ СВОЙСТВА:
При нагревании разлагается в диоксид теллура и кислород:
· 2TeO3 → 2TeO2 + O2 (при to = 400C)
Аморфная форма медленно реагирует с водой, образуя ортотеллуровую кислоту:
· TeO3 + 3H2O → H6TeO6
Реагирует с щелочами, образуя тетрагидроортотеллураты:
· TeO3 + 2NaOH + H2O → Na2H4TeO6↓
Является сильным окислителем:
· 2TeO3 + 2HCl → H2TeO3↓ + Cl2↑ (при to = 100C)
Теллуровая кислота — слабая многоосновная неорганическая кислота состава H6TeO6 (H2TeO4•2H2O), соответствующая высшей степени окисления теллура (+6).
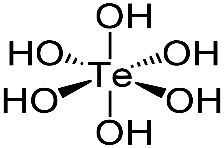
ХИМИЧЕСКИЕ СВОЙСТВА:
Выше 300 °С распадается на TeO3 и воду.
БИОЛОГИЧЕСКАЯ РОЛЬ СЕЛЕНА.
Входит в состав активных центров некоторых белков в форме аминокислоты селеноцистеина. Является необходимым для жизни микроэлементом, но большинство соединений достаточно токсичны (селеноводород, селеновая и селенистая кислота) даже в средних концентрациях.
Селен в организме взаимодействует с витаминами, ферментами и биологическими мембранами, участвует в регуляции обмена веществ, в обмене жиров, белков и углеводов, а также в окислительно-восстановительных процессах. Селен является составным компонентом более 30 жизненно важных биологически активных соединений организма. Селен входит в активный центр ферментов системы антиоксидантно-антирадикальной защиты организма, метаболизма нуклеиновых кислот, липидов, гормонов.
Селен входит в состав белков мышечной ткани, белков миокарда. Также селен способствует образованию трийодтиронина (гормонов щитовидной железы).
Селен является синергистом витамина E и иода. При дефиците селена йод плохо усваивается организмом. Согласно исследованиям, селен необходим для нормального функционирования иммунной системы. Он задействован в механизмах противодействия вирусным инфекциям, включая ВИЧ. Было доказано, что у пациентов, уже заразившихся ВИЧ, он замедляет переход заболевания в СПИД.
Дата: 2019-07-30, просмотров: 1090.