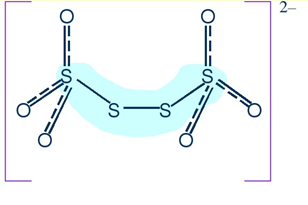
ПОЛИТИОНАТЫ, соли малоустойчивых политионовых кислот общей формулы HO3S—Sn—SO3H, где n ≥ 1. Содержат в структуре зигзагообразные цепи из атомов S. Известны политионаты аммония, щелочных, щелочноземельных и некоторых других металлов. При нагревании разлагаются; многие растворяются в воде, образуют кристаллогидраты. Лучше других изучены политионаты калия и натрия – бесцветные кристаллы. Устойчивость политионатов падает от соединений с п = 1 к соединениям с n = 4; политионаты с n > 4 малоустойчивы.
На примере политионата калия
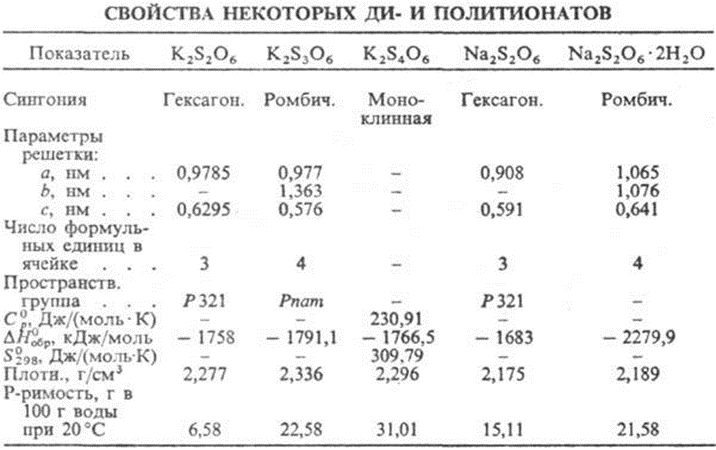
Политиона́ты ка́лия — неорганические соединения, соли щелочного металла калия и политионовых кислот с формулой K2SnO6, где n > 2, бесцветные (белые) кристаллы, растворимые в воде.
Химические свойства:
Разлагается при нагревании:
· K2SnO6 → K2SO4 + (n – 2) S (при to)
Окисляется горячей концентрированной азотной кислотой:
· K2SnO6 + (6n – 10) HNO3 → K2SO4 + (n – 1) H2SO4 + (6n – 10) NO2↑ + (2n – 4) H2O (при to)
Вступает в обменные реакции:
· K2SnO6 +HClO4 → H2SnO6 + KClO4↓ (при to=0)
Разлагается при кипячении с щелочами на несколько продуктов:
· K2SnO6 → K2SO3, K2SO3S, K2S, K2SO4
Соединения серы( VI ) – оксид, гексафторид, сульфонилхлорид, сульфурилхлорид, серная кислота и её производные – сульфаты, КО и ОВ свойства. Олеум. Пиросерная кислота. Пероксодисерные кислоты и соли. Окислительные свойства пероксосульфатов.
ОКСИД СЕРЫ (VI).
Оксид серы (VI) SO3 (или триоксид серы или серный ангидрид) – вещество белого цвета, в твёрдом состоянии существует в виде аморфного летучего тримера ((SO3)3 или S3O9). При повышении температуры плавится с образованием бесцветной жидкости, выше +45 0С закипает. SO3 – вещество ядовитое.
Триоксид серы – кислотный оксид, реагируя с водой, образует серную кислоту:
· SO3 + H2O = H2SO4
Для серного ангидрида характерны все реакции кислотных оксидов:
· SO3 + Ba(OH)2 = BaSO4↓ + H2O,
· SO3 + CaO = CaSO4,
· SO3 + 2NaOH(конц.) = Na2SO4 + Н2О,
· SO3 + NaOH(разб.) = NaHSO4.
Оксид серы (VI) содержит серу в высшей степени окисления, поэтому обладает свойствами сильного окислителя:
· SO3 + 2KI = I2 + K2SO3
· 5SO3 + 2P = 5SO2 + P2O5,
· 3SO3 + H2S = 4SO2↑ + H2O
SO3 получают окислением оксида серы (IV) в присутствии катализатора V2O5 и при температуре 500 0С:
· 2 SO2 + О2 ↔ 2 SO3
Очень чистый серный ангидрид получают окислением диоксида серы озоном:
· SO2 + О3 = SO3 + О2.
В лабораторных условиях небольшие количества SO3 можно получить по реакции:
· Н2SO4 + P2O5 = 2HPO3 + SO3.
ГЕКСАФТОРИД
Гексафторид серы (также элегаз или шестифтористая сера, SF6) — неорганическое вещество, при стандартных условиях представляет собой тяжёлый газ (в 5 раз тяжелее воздуха).
Возможно получать гексафторид серы из простых веществ:
· S + 3F2 → SF6
Также гексафторид серы образуется при разложении сложных фторидов серы:
· S2F10 → SF6 + SF4
Гексафторид серы — достаточно инертное соединение, не реагирует с водой, вероятно, из-за кинетических факторов. Не реагирует также с растворами HCl и NaOH, однако при действии восстановителей могут протекать некоторые реакции.
Взаимодействие с металлическим натрием проходит только при нагревании, однако уже при 64 °C взаимодействует с раствором натрия в аммиаке:
· SF6 + 8Na → Na2S + 6NaF
Гексафторид серы реагирует с литием с выделением большого количества тепла:
· SF6 + 6Li → S + 6LiF
При этом продукты реакции — элементарная сера и фторид лития — имеют меньший объём, чем исходные вещества, что нашло применение в некоторых экзотических тепловых двигателях (см. ниже).
С водородом и кислородом гексафторид не реагирует. Однако, при сильном нагревании (до 400 °C) SF6 взаимодействует с сероводородом, а при 30 °C — с иодоводородом:
· 2SF6 + 6H2S → S8 + 12HF
· SF6 + 8HI → 6HF + H2S + 4I2
При повышенном давлении и температуре около 500 °C SF6 окисляет PF3 до PF5:
· SF6 + PF3 → PF5 + SF4
СУЛЬФОНИЛХЛОРИД
СУЛЬФОХЛОРИДЫ (сульфонилхлориды, хлорангидриды сульфокислот), соединения общей формулы RSO2Cl, где R-opганический остаток. Жидкие или твердые вещества; низшие алифатические и ароматические сульфохлориды обладают неприятным резким запахом, не растворимые или трудно растворимые в воде, растворяются в диэтиловом эфире, ацетоне, СНСl3, ССl4, спиртах, бензоле.
При нагревании выше температуры кипения сульфохлориды, особенно ароматические, разлагаются с выделением SO2; в воде и в кислотах довольно устойчивы, в присутствии оснований легко гидролизуются до сульфокислот.
СУЛЬФУРИЛХЛОРИД
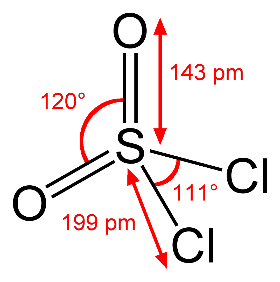 - искажённый тетраэдр
- искажённый тетраэдр
Сульфурилхлорид (хлористый сульфурил) SO2Cl2 — хлорангидрид серной кислоты.
Бесцветная, резко пахнущая жидкость, хорошо растворимая в хлороформе и уксусной кислоте, в избытке воды растворяется с частично протекающим гидролизом. Дымит на воздухе, гидролизуется по реакции:
· SO2Cl2 + H2O → HSO3Cl + HCl
· SO2Cl2 + 2H2O → H2SO4 + 2HCl
Гидролиз идёт слабо в холодной воде, в горячей воде протекает быстро.
При хранении желтеет, поскольку распадается на SO2 и зеленовато-жёлтый хлор:
· SO2Cl2 → SO2 + Cl2
Получают взаимодействием SO2 с Cl2 в присутствии катализаторов (активированный уголь, камфора). (или при t = 160-300 0С?)
· SO2 + Cl2 → SO2Cl2
Реакция взаимодействия хлорида сульфурила и аммиака с образованием амида сульфурила (сульфамида) и хлорида аммония. Реакция протекает при комнатной температуре.
· SO2Cl2 + 4NH3 → SO2(NH2)2 + 2NH4Cl
Реакция взаимодействия хлорида сульфурила и фторида натрия с образованием фторида сульфурила и хлорида натрия. Реакция протекает в сульфолане при температуре 60-150°C и избыточном давлении.
· SO2Cl2 + 2NaF → SO2F2 + 2NaCl
Реакция взаимодействия хлорида сульфурила и серной кислоты с образованием хлорсульфоновой кислоты. Серная кислота безводная.
· SO2Cl2 + H2SO4 → 2HSO3Cl
Реакция взаимодействия хлорида сульфурила и оксида кальция с образованием сульфата кальция и хлорида кальция. Хлорид сульфурила жидкий.
· SO2Cl2 + 2CaO → CaSO4 + CaCl
Реакция взаимодействия хлорида сульфурила и фтора с образованием фторида сульфурила и хлора. Реакция протекает при комнатной температуре.
· SO2Cl2 + F2 → SO2F2 + Cl2
СЕРНАЯ КИСЛОТА
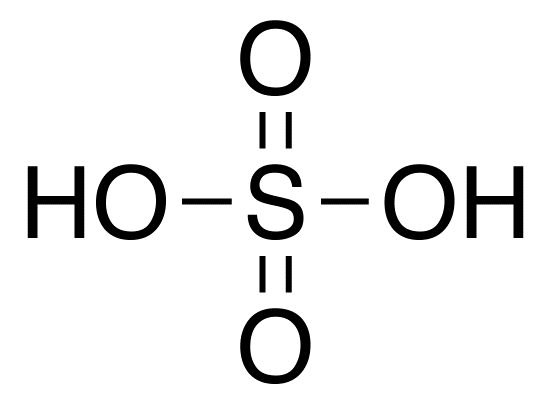
Серная кислота – бесцветная вязкая и гигроскопическая жидкость, термически устойчивая, но при сильном нагревании разлагается с выделением SO3. Серная кислота неограниченно смешивается с водой. Разбавленные растворы серной кислоты представляют собой очень сильную кислоту. При смешивании с водой выделяется большое количество энергии, так как идёт процесс образования гидратов. Жидкость вскипает, происходит разбрызгивание. Поэтому при приготовлении растворов серной кислоты нужно осторожно приливать малыми порциями серную кислоту к воде и интенсивно перемешивать раствор.
Химические свойства серной кислоты сильно зависят от её концентрации, поэтому мы рассмотрим отдельно свойства разбавленной серной кислоты и свойства концентрированной.
Разбавленная серная кислота проявляет все свойства, характерные для всех кислот:
1.Водный раствор имеет сильнокислую реакцию, поэтому индикаторы окрашиваются в соответствующие цвета (лакмус в красный, метилоранж в розовый, фенолфталеин – бесцветный).
2.Взаимодействует с основными и амфотерными оксидами, образуя соль и воду:
· CuO + H2SO4(разб.) = CuSO4 + H2O,
· CaO + H2SO4(разб.) = CaSO4 + H2O,
· ZnO + H2SO4(разб.) = ZnSO4 + H2O.
3.Взаимодействует с щелочами и нерастворимыми гидроксидами:
· 2NaOH + H2SO4 = Na2SO4 + H2O,
· Cu(OH)2 + H2SO4(разб.) = CuSO4 + H2O.
· NaOH + H2SO4 = NaHSO4 + H2O.
4.Реагирует с солями более слабых кислот (реакции проходят по правилам реакций обмена в электролитах):
· H2SO4 + CaCO3 = CaSO4 + H2O + CO2↑,
· H2SO4 + K2SiO3 = K2SO4 + H2SiO3↓.
5.C аммиаком серная разбавленная кислота образует соли аммония:
· 2NH3 + H2SO4 = (NH4)2SO4.
Окислительные свойства разбавленной серной кислоты обусловлены только ионом Н+. Единственным продуктом восстановления разбавленной серной кислоты является молекулярный водород. Такие кислоты принято называть кислотами-неокислителями.
Реагируя с металлами, разбавленная серная кислота образует ионы низшей степени окисления металла.
Свинец не реагирует с разбавленной серной кислотой, так как образующийся на поверхности сульфат свинца в кислоте не растворим.
Концентрированная серная кислота резко отличается по свойствам от разбавленной, так как проявляет свойства сильного окислителя, окислительные свойства её обусловлены ионом SO42-, содержащим атом серы в высшей степени окисления +6. Окислительные свойства проявляются наиболее сильно при нагревании. Концентрированная серная кислота окисляет как металлы, стоящие в электрохимическом ряду до водорода, так и после него. Водород при этом никогда не выделяется. Продуктом восстановления кислоты, в зависимости от активности металла, могут быть SO2, S и H2S.
Рассмотрим взаимодействие концентрированной серной кислоты с медью, которое протекает в две стадии:
а) молекулы серной кислоты окисляют медь до оксида и при этом выделяется SO2:
· Cu + H2SO4 = CuO + SO2 + H2O;
б) образовавшийся оксид меди (II) является основным оксидом и сейчас же растворяется в серной кислоте с образованием соли и воды:
· CuO + H2SO4 = СuSO4 + H2O.
Суммарное уравнение взаимодействия меди с концентрированной серной кислотой записывается следующим образом:
· Cu + 2H2SO4 = СuSO4 + 2H2O + SO2↑.
С активными металлами продуктами восстановления кислоты могут быть: SO2, S и Н2S:
· Zn + 2H2SO4 = ZnSO4 + SO2↑ + H2O,
· 3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O,
· 4Zn + 5H2SO4 = 4ZnSO4 + H2S + 4H2O.
Чем металл более активен, тем больше выделяется S и Н2S.
Можно представить схемой образование продуктов восстановления серной кислоты в зависимости от активности металлов:
Увеличение активности восстановителя
· H2SO4 (концентрированная) → SO2 → S → H2S
Концентрированная серная кислота окисляет и неметаллы:
· С + 2H2SO4 = CO2↑ + SO2↑ + 2H2O,
· 2Р + 5H2SO4 = 2H3PO4 + 5SO2↑ + 2H2O,
· S + 2H2SO4 = 3SO2↑ + 2H2O.
Эти реакции проходят при нагревании.
При комнатной температуре протекают следующие реакции:
· 8HI + H2SO4 = 4I2 + H2S↑ + 4H2O,
· 2HBr + H2SO4 = Br2 + SO2↑ + 2H2O,
· H2S + H2SO4 = S + SO2↑ + 2H2O.
На термической устойчивости и нелетучести серной кислоты основаны способы получения при нагревании более летучих кислот в лабораториях:
· KClO4(кр.) + H2SO4(конц.) = KHSO4 + HClO4↑,
· Ca3(PO4)2 + + H2SO4(конц.) = 3CaSO4 + 2H3PO4,
· KNO3(кр.) + H2SO4(конц.) = KHSO4 + HNO3↑,
· NaCl (кр.) + H2SO4(конц.) = NaHSO4 + HCl↑,
При сильном нагревании реакции идут с образованием средних солей, например:
· 2NaCl (кр.) + H2SO4(кр.) = Nа2SO4 + 2HCl↑.
При сильном нагревании не получают только азотную кислоту, так как она сама при нагревании разлагается.
Концентрированная серная кислота активно поглощает воду, поэтому сахар обугливается в концентрированной серной кислоте и древесина:
· С12H22O11 + H2SO4(конц.) = 12C + 11H2O∙ H2SO4,
· (C6H10O5)n + H2SO4(конц.) = 6nC + 5nH2O∙ H2SO4.
На водоотнимающей способности серной кислоты основаны реакции дегидратации спиртов, протекающие при нагревании и в присутствии серной кислоты. Продуктами таких реакций являются алкены или простые эфиры:
· C2H5OH → СH2 = CH2 + H2O,
· C2H5OH → C2H5 – O – C2H5 + H2O.
Благодаря своим окислительныи свойствам концентрированнпая серная кислота окисляет ионы железа (II) до ионов железа (III):
· FeSO4 + 2H2SO4 = SO2↑ + 2H2O + Fe2(SO4)3.
Качественной реакцией на ион SO42- является реакция с ионом Ba2+, которая приводит к образованию осадка белого цвета и не растворимого ни в воде ни в кислотах:
· Ba2+ + Ba2+ → BaSO4↓.
Дата: 2019-07-30, просмотров: 1020.