Процесс получения серной кислоты основан на следующих химических реакциях:
· 4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
· 2SO2 + O2 ↔ 2SO3, ∆H = -284 кДж,
· SO3 + H2O = H2SO4.
Соли серной кислоты – сульфаты в большинстве своём бесцветные соединения, хорошо кристаллизуются, из водных растворов выделяются в виде кристаллогидратов. Сульфаты щелочных и щелочноземельных металлов термически стойки, сульфаты же менее активных металлов при нагревании разлагаются:
· ZnSO4 → ZnO + SO3↑,
· Ag2SO4 → 2Ag + SO2↑ + O2.
Неорганические сульфаты являются ионными соединениями, содержат анион SO42-, образуют три ряда солей:
· нормальные, или средние соли (собственно сульфаты, например, сульфат калия K2SO4);
· кислые соли (гидросульфаты, или бисульфаты, кроме катионов металла содержат катионы водорода H+, например, гидросульфат натрия NaHSO4);
· основные соли (содержат наряду с сульфат-анионом SO42- группы ОН, например, Cu3(OH)4SO4
Кислые сульфаты щелочных металлов при нагревании разлагаются с отщеплением воды, превращаясь в пиросульфаты (дисульфаты, соли дисерной кислоты):
· 2KHSO4 → K2S2O7 + H2O↑.
Осно́вные сульфаты, а также кислые сульфаты металлов, не являющихся щелочными, при нагревании, как правило, разлагаются с отщеплением оксида серы(III) SO3, образуя оксиды металлов.
Качественная реакция на растворимые сульфаты — образование белого нерастворимого осадка сульфата бария при добавлении к раствору хлорида бария.
· M2SO4 + BaCl2 → BaSO4↓ + 2MCl
Используется также осаждение белого сульфата свинца(II) при добавлении к раствору ацетата свинца(II).
· M2SO4 + Pb(CH3COO)2 → PbO4↓ + 2MCH3COO
Ряд солей серной кислоты используются в медицине. Например, Na2SO4∙10H2O является слабительным средством, MgSO4∙7H2O обладает слабительным и желчегонным действием, его используют при гипертонии, антисептиками являются CuSO4∙5H2O и ZnSO4∙7H2O. Гипс СaSO4∙2H2O используют для изготовления гипсовых повязок. ВаSO4 является рентгеноконтрастным веществом, поэтому используется в рентгенологии.
ОЛЕУМ.
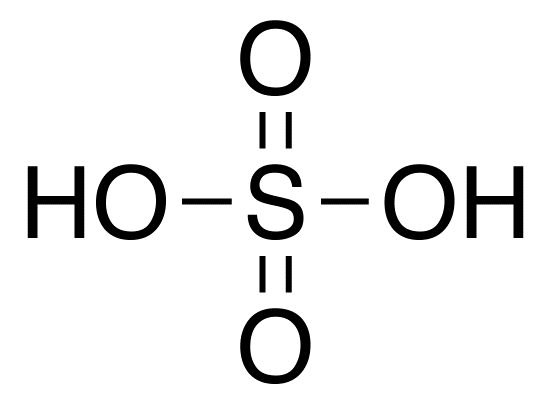
Олеум — раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. На воздухе «дымит», реагирует с водой с выделением огромного количества тепла. Концентрация серного ангидрида может варьировать в очень широких пределах: от единиц до десятков процентов. Олеум обладает ещё большим водоотнимающим и окислительным действием. Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
· H2SO4 + SO3 → H2S2O7
· H2SO4 + 2SO3 → H2S3O10
ПИРОСЕРНАЯ КИСЛОТА.
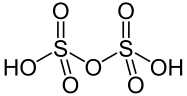
Пиросерная кислота — неорганическое соединение, двухосновная кислота с формулой H2S2O7, бесцветные кристаллы, разлагается в воде. На воздухе она дымит, так как разлагается на серную кислоту, выделяя летучий серный ангидрид, а потому называется дымящей серной кислотой.
В 100% серной кислоте содержится 0,04% пиросерной кислоты.
В серной кислоте, насыщенной триоксидом серы (олеум), имеет место равновесие:
· SO3 + H2SO4 ⇄ H2S2O7
Разлагается водой:
· H2S2O7 + H2O → 2H2SO4
Образует соли — дисульфаты или пиросульфаты, которые получаются нагреванием гидросульфатов, например, дисульфат калия:
· 2KHSO4 → 2K2S2O7 + H2O (при to)
Дата: 2019-07-30, просмотров: 522.