- Повышение температуры тела (от субфебрильных цифр до 38,5 – 39°С)
- Лейкоцитоз, не превышающий обычно 12-15*109/л
- Небольшой палочкоядерный сдвиг формулы крови влево
- Увеличение СОЭ
- Гиперферментемия (тропонин и миоглобин)
Этиология. Основной причиной ИМ является атеросклероз коронарных артерий, осложненный тромбозом или кровоизлиянием в атеросклеротическую бляшку (у умерших от ИМ атеросклероз коронарных артерий обнаруживается в 90—95 % случаев).
В настоящее время существенное значение в возникновении ИМ придается функциональным нарушениям, приводящим к спазму коронарных артерий (не всегда патологически измененным) и острому несоответствию объема коронарного кровотока потребностям миокарда в кислороде и питательных веществах.
Чрезвычайно редко причинами ИМ бывают эмболии коронарных артерий, тромбоз их при воспалительных поражениях (тромбангиит, ревматический коронарит и т.д.), сдавление устья коронарных артерий расслаивающей аневризмой аорты и пр. Они приводят к развитию ИМ в 1 % случаев и не относятся к проявлениям ИБС.
Факторами, способствующими возникновению ИМ, являются:
1) недостаточность коллатеральных связей между коронарными сосудами и нарушение их функции;
2) усиление тромбообразующих свойств крови;
3) повышение потребности миокарда в кислороде;
4) нарушение микроциркуляции в миокарде.
Чаще всего ИМ локализуется в передней стенке левого желудочка, т.е. в бассейне кровоснабжения наиболее часто поражаемой атеросклерозом передней нисходящей ветви левой коронарной артерии. Второе место по частоте занимает ИМ задней стенки левого желудочка и ИМ межжелудочковой перегородки (25 % всех поражений).
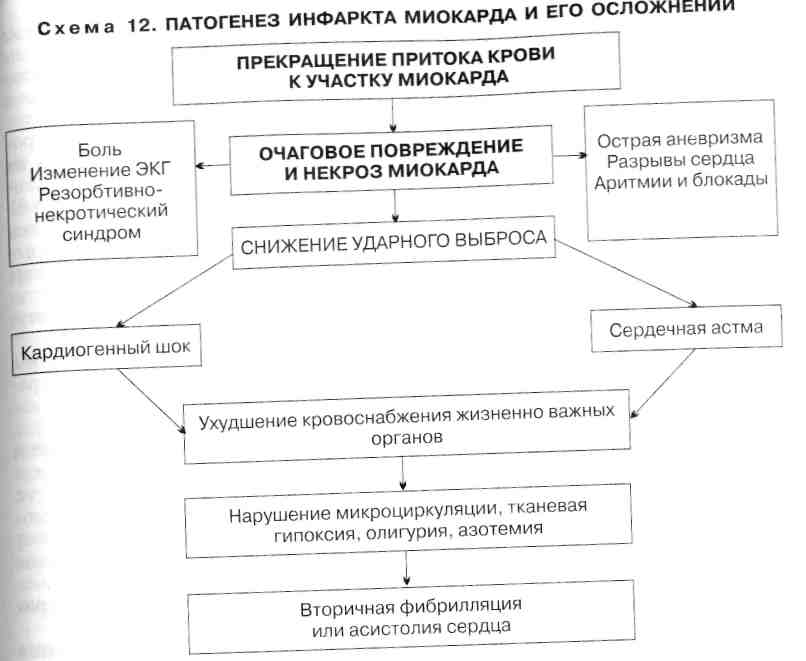
Патогенез. В патогенезе ИМ главная роль принадлежит прекращению притока крови к участку сердечной мышцы, что приводит к повреждению миокарда, его некрозу, ухудшению жизнедеятельности периинфарктной зоны (схема 12).
Некроз миокарда проявляется резорбционно-некротическим синдромом (данные лабораторных исследований, повышение температуры тела) и подтверждается данными ЭКГ. Он вызывает длительный болевой синдром, также может проявляться развитием аритмий и блокад сердца, а трансмуральный некроз — разрывами сердца или острой аневризмой.
Некроз миокарда и нарушение сократительной способности периинфарктной зоны способствуют снижению ударного и минутного объема сердца. Клинически это проявляется развитием острой левожелудочковой недостаточности — отеком легких и/или кардиогенным шоком. Последний сопровождается резким снижением кровоснабжения жизненно важных органов, что приводит к нарушению микроциркуляции, тканевой гипоксии и накоплению продуктов обмена.
Метаболические нарушения в миокарде вызывают тяжелые нарушения ритма сердца, нередко заканчивающиеся фибрилляцией желудочков.
Возникающее при кардиогенном шоке снижение коронарного кровотока еще больше способствует снижению насосной функции сердца и усугубляет течение кардиогенного шока, отека легких — главных причин смерти при ИМ.
Клиническая картина. Проявления ИМ определяются вариантом начала болезни, периодом течения и развитием тех или иных осложнений.
В течении ИМ выделяют ряд периодов.
Острейший период (I) — время между возникновением ишемии участка миокарда (так называемая ишемическая стадия) и появлением признаков его некроза (от 30 мин до 2 ч).
Типичная, или ангинозная, форма начала ИМ с интенсивным болевым синдромом с локализацией боли за грудино и области сердца), часто иррадиирующеи в левую, руку, нижнюю челюсть и т.д. Боль длительная, не купируется нитроглицерином, сопровождается холодным потом, страхом смерти.Помимо типичной формы начала болезни, выделяют ряд других проявлений заболевания нарушения ритма, чаще Желудочковой тахикардией;
4) церебральный — основными проявлениями служат неврологические расстройства, напоминающие клиническую картину инсульта;
5) с атипичной локализацией боли (боль появляется только в позвоночнике, руке, плече, челюсти и т.д.; локализуется не только слева, но и справа);
6) «бессимптомный» — симптомы общего недомогания, немотивированной слабости, адинамия, особенно у пожилых; в подобных случаях не находят правильного объяснения, если не регистрируют ЭКГ.
Астматический и гастралгический варианты встречаются наиболее часто.
Осложнения. В острейшем периоде ИМ часто развиваются тяжелые нарушения сердечного ритма и острая сердечная недостаточность, которые могут привести к летальному исходу (если в этот период больному еще не оказывается интенсивная врачебная помощь).
В остром периоде возникают осложнения, многие из них также могут быть причиной смерти больных:
1) нарушения ритма и проводимости (пароксизмальная желудочковая тахикардия, фибрилляция, атриовентрикулярная блокада, мерцание и трепетание предсердий и другие менее грозные нарушения);
2) шок (рефлекторный, кардиогенный и аритмический);
3) сердечная астма, отек легких (проявление острой левожелудочковой недостаточности);
4) острая аневризма сердца;
5) разрывы сердца (в том числе перфорация межжелудочковой перегородки и разрыв сосочковых мышц);
6) тромбоэмболические осложнения (в большом и малом круге кровообращения);
7) парез желудка и кишечника, эрозивный гастрит с желудочным кровотечением, панкреатит.
Подострый период протекает более благоприятно, но и в его течении возможны осложнения:
1) тромбоэндокардит с тромбоэмболическим синдромом (чаще эмболия мелких сосудов большого круга кровообращения);
2) пневмония;
3) постинфарктный синдром — синдром Дресслера, синдром передней грудной стенки, синдром плеча. Постинфарктный синдром развивается обычно на 2—6-й неделе после ИМ, характеризуется перикардитом, плевритом, пневмонитом; иногда в воспалительный процесс вовлекаются синовиальные оболочки суставов. Одновременно все симптомы встречаются редко, чаще наблюдается сочетание перикардита с плевритом или пневмонитом. Иногда выявляется один из этих симптомов, затрудняя диагностику постинфарктного синдрома;
4) психические изменения (чаще неврозоподобные симптомы);
5) хроническая левожелудочковая сердечная недостаточность;
6) начало формирования хронической аневризмы сердца;
7) правожелудочковая недостаточность, развивающаяся редко. При ее наличии следует думать о тромбоэмболии ветвей легочной артерии, разрыве межжелудочковой перегородки и крайне редко — об инфаркте правого желудочка.
В постинфарктном периоде заканчивается формирование хронической аневризмы, могут оставаться проявления синдрома Дресслера и симптомы хронической сердечной недостаточности. Вновь могут возникнуть нарушения ритма сердца. В целом для этого периода развитие осложнений нехарактерно.На I этапе диагностического поиска на основании клинической картины, особенностей ее развития, с учетом предшествующего анамнеза, возраста и пола больного можно: а) заподозрить развитие ИМ; б) высказать предположение о клиническом варианте болезни; в) получить сведения о тех или иных осложнениях.
При длительном приступе нестерпимых болей за грудиной и в области сердца с характерной иррадиацией, не купирующихся нитроглицерином, следует прежде всего предположить ИМ, особенно у мужчин старше 40 лет. Надо помнить, что подобная симптоматика иногда может быть обусловлена и другими причинами (неврит, плеврит, миозит и др.).
Остро возникший приступ удушья, особенно у лиц пожилого возраста, прежде всего наводит на мысль об астматическом варианте ИМ. Однако острая левожелудочковая недостаточность может быть проявлением иной болезни (аортальный или митральный порок сердца, гипертоническая болезнь). Сердечная астма и отек легких при соответствующей клинической картине ИМ могут быть не вариантом его начала, а осложнением.
Резкие боли в эпигастральной области, особенно у больных с хронической ИБС, позволяют заподозрить гастралгический вариант ИМ. Подобная клиническая картина может быть проявлением других заболеваний (обострение язвенной болезни, гастрита, холецистита, острого панкреатита; пищевое отравление, особенно при наличии симптомов желудочной диспепсии).
Жалобы больного на приступы сердцебиений или резкого урежения ритма, появление аритмий, обмороков могут указывать на начало ИМ или его осложнений. Кроме этого, нарушения ритма могут появиться и вне связи с ИМ и быть проявлением нейроциркуляторной дистонии, миокар-дитического кардиосклероза, хронической ИБС и др.
Интенсивный болевой синдром с атипичной локализацией реже напоминает ИМ, но не исключает его, в связи с чем дальнейшее обследование больного обязательно.
Внезапное немотивированное развитие кардиогенного шока, когда больной заторможен, вял, сознание его спутано, также должно вызвать у врача подозрение на ИМ.
Все сведения, полученные на I этапе, должны оцениваться с учетом данных физикального и лабораторно-инструментального обследования. Иногда на этом этапе диагностического поиска не получают никакой информации, позволяющей поставить диагноз ИМ.
На II этапе диагностического поиска можно получить сведения: а) косвенно указывающие на развитие ИМ (прямых признаков не существует); б) позволяющие выявить осложнения.
При соответствующем анамнезе такие симптомы, как повышение температуры тела, тахикардия, артериальная гипотония, особенно развившаяся на фоне предшествующей гипертонии, глухость тонов сердца и кратковременно выслушиваемый шум трения перикарда, позволяют высказаться в пользу диагноза ИМ. Однако сами по себе эти симптомы непатогномо-ничны для ИМ и могут быть при ряде заболеваний (ревматизм, миокардит, перикардит и т.д.).
Физикальное исследование помогает выявить симптомы возможных осложнений. Для кардиогенного шока характерны холодная кожа серо-бледного цвета, покрытая липким потом (нарушение периферической циркуляции); олигоанурия (уменьшение мочеобразования); нитевидный пульс; Уменьшение пульсового давления (менее 20—30 мм рт. ст.); снижение систолического давления (ниже 80 мм рт. ст.).
Могут наблюдаться симптомы острой левожелудочковой недостаточности: одышка, ортопноэ, влажные хрипы в легких.
Тромбоэмболия легочной артерии проявляется одышкой, болями в груди, кровохарканьем, цианозом.
Увеличенная печень, периферические отеки — симптомы недостаточности кровообращения в большом круге.
При физикальном обследовании представляется возможность обнаружить бради-, тахикардию, экстрасистолию, мерцательную аритмию, паро-ксизмальную тахикардию.
Диагностическое значение всех указанных осложнений невелико, так как они встречаются и при других заболеваниях. Лишь в сочетании с анамнезом и данными III этапа они имеют значение при постановке диагноза ИМ.
Большое диагностическое значение приобретает выявление острой аневризмы (патологическая пульсация в прекордиальной области в четвертое межреберье слева от грудины), разрыва межжелудочковой перегородки (интенсивный систолический шум в нижней трети грудины с симптомами быстро нарастающей недостаточности кровообращения в малом и большом круге), разрыва или отрыва сосочковой мышцы (дующий систолический шум над верхушкой сердца, иногда определяемый пальпаторно, в сочетании с нарастающим застоем в малом круге кровообращения).
III этап диагностического поиска позволяет: а) поставить окончательный диагноз ИМ; б) уточнить его локализацию и распространенность; в) подтвердить или выявить нарушения ритма и проводимости; г) выявить новые осложнения (аневризма сердца, очаговое поражение почек при тромбоэмболии).
Поставить окончательный диагноз ИМ можно на основании сочетания признаков резорбционно-некротического синдрома и данных ЭКГ.
Резорбционно-некротический синдром выявляется по результатам общеклинического и биохимического методов исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево и анэозинофилия (не всегда) с первых часов заболевания; увеличение СОЭ с 3—5-го дня; повышение в крови активности ферментов — креатинфосфокиназы (КФК) и ее МВ-фракции (с первых часов, сохраняющееся 2—3 дня), аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой с конца первых суток, нормализующееся к 3—5-му дню), ЛДГ — лактатдегидрогеназы (обшей) и ее первого и второго изоферментов, которое может держаться 10—14 дней.
В настоящее время наиболее информативными маркерами являются тропонин Т, тропонин I и миоглобин.
Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц: тропонин Т (ТнТ), тропонин С (ТнС) и тропонин I (Тн1).
При ИМ содержание миоглобина в крови у большинства больных превышает 200 мкг/л через 4 ч после ангинозного приступа, а через 6 ч его уровень повышается у 100 % больных с впервые возникшим ИМ.
Определение гипермиоглобинемии — наиболее достоверный тест для исключения острого ИМ в ранние сроки.
Электрокардиография является методом, который позволяет уточнить диагноз ИМ, его локализацию, глубину и обширность поражения, фазу течения; подтвердить или выявить нарушения ритма и проводимости; высказать предположение о развитии аневризмы сердца.
В ишемической стадии отмечают подъем сегмента ST в так называемых прямых отведениях (в этих отведениях в последующем будет формироваться патологический зубец Q ) и реципрокное снижение ST в отведениях, в которых изменений комплекса QRS не будет. В острой фазе в «прямых» отведениях при трансмуральном ИМ резко снижается (или полностью исчезает) зубец R и формируется комплекс QS . При меньшей глубине поражения некрозом стенки миокарда в «прямых» отведениях появляется патологический зубец Q (равный по амплитуде '/з зубца R или более, длительностью 0,04 с и более). Последующая эволюция ЭКГ сводится к возвращению сегмента ST к изоэлектрической линии и формированию в «прямых» отведениях отрицательного («коронарного») зубца Т.
При нетрансмуральном инфаркте изменения ограничиваются небольшим смещением сегмента ST вверх или вниз и инверсией зубца Т.
Для инфаркта миокарда передней стенки (включая область верхушки) характерны изменения ЭКГ в отведениях I, II, aVL и V3_4; Для инфаркта нижней стенки — в отведениях II, III и aVF; для инфаркта боковой стенки _ в отведениях I, aVL и V5-6; при поражениях области перегородки выявляют изменения в отведениях V2-3).
ЭКГ не является информативной в случае предшествовавшей блокады левой ножки пучка Гиса и при инфаркте правого желудочка.
На ЭКГ выявляются разнообразные нарушения ритма, встречающиеся при ИМ. По ЭКГ можно узнать впервые о нарушениях атриовентрикулярной проводимости и проводимости по ножкам пучка Гиса, определить характер блокады.
Признаком, позволяющим предположить аневризму, является так называемая застывшая ЭКГ — сохранение подъема сегмента ST в сочетании с комплексом QS в «прямых» отведениях, при этом может отмечаться «коронарный» зубец Т.
Ультразвуковой метод исследования позволяет выявить участок гипокинезии или акинезии, соответствующий зоне поражения, а также состояние сосочковых мышц и межжелудочковой перегородки, которые также могут поражаться при инфаркте миокарда.
При рентгеноскопии органов грудной клетки можно выявить аневризматическое выпячивание и участок парадоксальной пульсации.
Данные инструментальных исследований, проводимых в общепринятом порядке, позволяют выявить атеросклеротическое поражение аорты (при рентгенологическом исследовании органов грудной клетки) и сосудов нижних конечностей (по данным реографии). Эти симптомы являются косвенным доводом наличия атеросклеротического поражения коронарных артерий при ИМ.
На III этапе диагностического поиска впервые могут быть получены Данные, свидетельствующие о тромбоэмболии мелких сосудов почки (гематурия, невысокая протеинурия).
В подавляющем большинстве случаев диагностический поиск на этом заканчивается и формулируется развернутый клинический диагноз. Иногда прибегают к специальным методам диагностики.
1. Визуализация ИМ с помощью радиоактивных изотопов. Этот метод применяют, если затруднена диагностика ИМ при помощи ЭКГ, а исследование активности ферментов сыворотки крови невозможно или малоинформативно.
2. Селективная коронарография применяется для решения вопроса о возможности хирургического лечения (аортокоронарное шунтирование) в остром периоде ИМ и для уточнения локализации тромба при попытке его растворения местным введением фибринолитических средств.
Диагностика. Диагноз ИМ с достоверностью может быть поставлен с учетом трех основных синдромов.
• Характерный болевой синдром или его эквиваленты в сочетании с такими физикальными данными, как шум трения перикарда, пульсация в прекордиальной области, снижение АД, появление нарушений ритма и острой сердечной недостаточности.
• Изменения на ЭКГ: признаки ИМ с характерной последующей динамикой.
• Признаки резорбционно-некротического синдрома: повышение температуры тела; динамика общего анализа крови (лейкоцитоз и анэозинофилия с последующим нарастанием СОЭ); гиперферментемия (повышение активности тропонинов, а также КФК и МВ-фракции КФК, ЛДГ, ЛДГ-1).
Лечение. Лечебные мероприятия при ИМ складываются из системы организационных и терапевтических мероприятий.
Организационные мероприятия включают: 1) оказание врачами специализированной бригады скорой помощи «на месте» высококвалифицированного лечения; 2) возможно раннюю госпитализацию больного; 3) наблюдение за больным в острый период в палате интенсивной терапии; 4) систему восстановительного лечения (реабилитация).
Терапевтические мероприятия проводятся с учетом стадии ИМ, выраженности и характера осложнений.
Лекарственную терапию (режим, диета, ЛФК) назначают индивидуально в зависимости от состояния и тяжести течения ИМ.
Основными направлениями лекарственной терапии острого периода ИМ являются:
• купирование боли;
• терапия, направленная на восстановление кровотока в «инфарктсвязанной» артерии;
• терапия, направленная на предотвращение реокклюзии коронарной артерии;
• ограничение зоны некроза.
Купирование болевого синдрома наиболее эффективно осуществляют с
помощью наркотических анальгетиков — морфин 1 % внутривенно струйно в 20 мл изотонического раствора хлорида натрия; кроме того, применяют нейролептаналгезию: сочетание нейролептических средств (1—2 мл 0,25 % раствора дроперидола) с обезболивающими (1—2 мл 0,005 % раствора фентанила) внутривенно или внутримышечно.
Восстановление кровотока в «инфарктсвязанной артерии» осуществляют с помощью тромболитической терапии. Ее следует начинать как можно раньше, не позднее 12 ч с момента его развития (а еще лучше на догоспитальном этапе), так как спустя 12 ч после появления первых признаков острого ИМ нет оснований рассчитывать на успешную реперфузию миокарда. Ее проводят только при отсутствии абсолютных противопоказаний: инсульт, желудочно-кишечные кровотечения, склонность к кровотечениям, расслаивающая аневризма аорты или хирургическая операция в течение предшествующих 3 нед.
В качестве тромболитических средств в настоящее время применяют схрептокиназу или тканевый активатор плазминогена (альтеплаза — суммарно 100 мг, при этом вводят 30 мг болюсом, а затем 70 мг внутривенно капельно; тенектеплаза — 100 мг болюсом). Перед введением любого тромболитического препарата вводят гепарин (нефракционированный гепарин — 60 ME внутривенно болюсом, затем внутривенно капельно в течение 48—72 ч под контролем АЧТВ).
Внутривенную инфузию стрептокиназы осуществляют в дозе 1 500 000 ME в течение 30—40 мин. Препарат разводят в изотоническом растворе хлорида натрия до объема 100 мл; инфузию осуществляют в два этапа: сначала первые 250 000 ME (50 мл) вводят внутривенно капельно в течение 10 мин, а затем после 15-минутного перерыва вводят остальные 1 250 000 ME (50 мл) также в течение 10 мин.
Непосредственно перед началом инфузии стрептокиназы и сразу же после ее окончания следует ввести внутривенно струйно 100 мг гидрокортизона или 60—90 мг преднизолона.
При лечении стрептокиназой гепарин или не назначают, или вводят подкожно по 12 500 ЕД 2 раза в сутки.
При наличии противопоказаний к применению тромболитической терапии в первые часы острого ИМ иногда для ликвидации окклюзии коронарной артерии в специализированных условиях (в лаборатории по коронарной катетеризации) проводят ЧТКА. К этой процедуре прибегают и при отсутствии эффекта от тромболитической терапии.
Ацетилсалициловую кислоту в качестве антиагреганта назначают больному с первого дня заболевания (еще на догоспитальном этапе). Первую дозу (160—325 мг) дают в таблетках для разжевывания; затем в дозе 80—125 мг больной принимает внутрь один раз в сутки очень длительно. При невозможности проведения тромболитической терапии больному проводят антитромботическую (антикоагулянтную) терапию гепарином. Нефракционированный гепарин вводят внутривенно капельно в течение 24—48 ч в средней дозе 1000 ЕД/ч под контролем АЧТВ. Низкомолекулярный гепарин (эноксопарин, фраксипорин) вводят в дозе 0,1 МЕ/кг 2 раза через 12 ч в течение 7 сут.
Антикоагулянтная терапия осуществляется для предупреждения: а) прогрессирования тромбоза в коронарных артериях; б) внутрисердечного тромбоза; в) системной эмболии; г) развития венозного тромбоза.
Проведение антикоагулянтной и тромболитической терапии рассчитано и на улучшение микроциркуляции («ограничение» очага поражения) в периинфарктной зоне, от состояния которой во многом зависит течение инфаркта в первые сутки.
Для ограничения зоны инфаркта применяют нитраты, b-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (ИАПФ). При ОИМ с зубцом Q больным показано раннее (в первые сутки) назначение 1 % Раствора нитроглицерина внутривенно капельно из расчета 5—7 мкгДкгч) под контролем АД.
Бета-адреноблокаторы назначают внутрь в первые сутки ИМ в случае Развития тахикардии (в отсутствие сердечной недостаточности), при относительно повышенном АД или для купирования болевого синдрома, когда неэффективны наркотические (опиоидные) анальгетики.
На 2—4-й день заболевания добавляют ингибиторы АПФ (каптоприл, эналаприл, рамиприл, периндоприл, лизиноприл). Установлено, что они оказываются особенно эффективными, если у больных ОИМ имелось снижение фракции выброса или были признаки сердечной недостаточности в ранней фазе заболевания. Назначение ингибиторов АПФ показано всем больным, перенесшим ранее ИМ. В ситуациях при наличии повторного ОИМ, ОИМ передней локализации, сердечной недостаточности ИАПф назначают в первые сутки болезни.
Поздние осложнения
Хроническая аневризма Хроническая аневризма образуется в месте сформировавшегося через 6 — 8 недель после ишемического некроза рубца. В результате его растяжения формируется зона, не способная сокращаться и ухудшающая насосную работу сердца. Это закономерно ведет к прогрессирующей сердечной слабости.
Синдром Дресслера (постинфарктный синдром)
Плеврит При резорбции очагов некроза продукты распада миокардиоцитов выступают в роли аутоантигенов и запускают аутоиммунные процессы. В результате извращенной защитной реакции страдают синовиальные и серозные оболочки. Клинически между 2 и 6 неделями внезапно может подняться температура и отдельно или в сочетании разовьются: перикардит; плеврит; пневмонит; синовит; гломерулонефрит; васкулит; экзема или дерматит.
Ишемические осложнения Поскольку причина острого инфаркта миокарда никуда не делась, сохраняется постоянная угроза возобновления нарушения кровообращения в системе коронарных артерий. В этом случае возможны три варианта неблагоприятных событий:
1. Расширение некроза в зоне ответственности артерии, поражение которой привело к инфаркту. Процесс может распространяться на все слои стенки сердца (трансмуральный инфаркт) или на участки рядом.
2. Постинфарктная стенокардия. Диагностируется при соответствующей симптоматике, если до инфаркта ее не было. Встречается более чем у четверти больных, а после тромболизиса — у более половины больных. Утяжеляет прогноз, повышает опасность внезапной смерти.
3. Повторный инфаркт миокарда. Может быть как на месте предыдущего, так и в зоне ответственности других коронарных артерий. Велика вероятность крупноочагового инфаркта. Если прошло не более 4 недель от предыдущего инфаркта, то называется рецидивирующим, а свыше — уже повторный.
Кардиосклероз постинфарктный Характерным осложнением острого инфаркт миокарда является развитие очагового постинфарктного кардиосклероза. Соединительнотканный рубец за 2 — 4 месяца занимает место погибшей сердечной мышцы. Чем обширнее участки рубцовой ткани, тем хуже сократительная способность, проводимость и возбудимость миокарда. Со временем прогрессирует сердечная слабость.
Лечение осложнений инфаркта миокарда В лечение осложнений, нарушающих ритмичность сокращений сердца, используются медикаменты с противоаритмическим действием. Применяются электроимпульсная терапия и электрокардиостимуляция, позволяющие значительно снизить смертность от аритмий. Фибрилляция и асистолия требуют проведения сердечно-легочной реанимации.
Помощь при острой сердечной недостаточности и кардиогенном шоке полагает назначение препаратов, снижающих периферическое сопротивление и повышающих сократительную способность миокарда. Изменения гемодинамики должны постоянно корригироваться. Если терапия неэффективна, то через 1 — 2 часа необходимо применить внутриаортальную баллонную контрпульсацию (метод вспомогательного кровообращения).
Внутриаортальная баллонная контрпульсация Улучшают результаты лечения осложнений инфаркта миокарда и кардиогенного шока методы восстановления кровотока в коронарной артерии, ответственной за ишемию. Это могут быть тромболитическая терапия или малоинвазивная внутрисосудистая ангиопластика. Смертность после оперативного лечения разрывов сердца высока. Но без него она достигает практически 100%. Поэтому лечение этого вида осложнений инфаркта миокарда только хирургическое. Для стабилизации состояния перед вмешательством также используется внутриаортальная баллонная контрпульсация.
Лечение синдрома Дресслера заключается в терапии стероидными гормонами, антигистаминными и противовоспалительными препаратами. Улучшение состояния должно сопровождаться отказом от гормонов, чтобы избежать опасности истончения и разрыва рубца. Если образовался выпот в плевральной или других полостях, отменяются противосвертывающие препараты.
Ишемические осложнения лечатся также, как классические стенокардия или инфаркт. Если проводилась тромболитическая терапия стрептокиназой, то из-за возможных аллергических реакций ее применение в течение 6 месяцев противопоказано.
При парезах желудка и кишечника следует отменить наркотические анальгетики, назначить голод, а при застое провести эвакуацию желудочного содержимого. Затем проводится фармакологическая стимуляция.
Аневризмы сердца, сопровождающиеся прогрессирующей сердечной недостаточностью, опасными нарушениями ритма подлежат хирургическому лечению.
Дата: 2019-07-24, просмотров: 570.