Антигипертензивные препараты
Основные
- иАПФ
- блокаторы рецепторов АТ1 (БРА)
- Антагонисты кальция
- Тиазидные диуретики
- β-адреноблокаторы
Дополнительные (в составе комбинированной терапии)
- α-адреноблокаторы
- агонисты имидазолиновых рецепторов
- прямые ингибиторы ренина
Каптоприл (капотен) – короткодействующий ИАПФ, эффективен для купирования гипертонического криза (в течение 30 мин).
(1) ИАПФ или (2) БРА должны включаться в любую схему лечения АГ, так как не только снижают артериальное давление, но и максимально обеспечивают органопротекцию сердца, сосудов, почек и эф. лечение АЗ (снижение смертности).
(3) БКК (дигидропиридиновые пролонгированные вазодилататоры) – амлодипин, фенлодипин. Короткодействующие нифедипины не принимать для длительного лечения АГ – риск осложнений (коринфар). (а недигидропиридиновые БКК действуют на проводящую систему сердца)
Побочные эффекты от нифедипина: резкое увеличение ЧСС – провокация ишемии – стенокардия и др. (ИБС)
Для купирования ГК не используют нифедипин, если есть подозрение на наличие ишемии миокарда или тахикардии. Для купирования ГК: моксонидин (физиотенз) 0,2-0,4 мг и каптоприл (капотен).
(4) Тиазидные диуретики: гидрохлортиазид, индопамид, хлоитамидон
(5) β-адреноблокаторы: метопролол, бисопролол, атенолол
+ (7) α-адреноблокаторы: алфузозин, празозин, доксазозин, тамсулозин, теразозин
+ (8) агонисты имидазолиновых рецепторов: моксонидин (физиотенз), рилменидин (альборен)
(9) прямые ингибиторы ренина: алескирен
Для лечения АГ не назначать ИАПФ и(?) сартаны, так как нарушается функция почек(!)
ИАПФ/БРА + БАБ/диуретик/БКК
Выбор АГП в зависимости от клинической ситуации
| Поражение органов-мишеней | |
| ГЛЖ | БРА, ИАПФ, АК |
| Бессимптомный атеросклероз | АК, ИАПФ |
| Микроальбуминурия | ИАПФ, БРА |
| Поражение почек | ИАПФ, БРА |
| Ассоциированные клинические состояния | |
| Инсульт в анамнезе | Любой препарат, эффективно снижение АД |
| Инфаркт миокарда в анамнезе | ББ, ИАПФ, БРА |
| Стенокардия | ББ, АК |
| ХСН | Диуретик, ББ, ИАПФ, БРА, ант. МКР |
| Фибрилляция предсердий, профилактика фибрилляции предсердий, контроль ритма ТСБП/протеинурия | БРА, ИАПФ, ББ, ант. МКР ББ, недигидропиридиновые АК ИАПФ, БРА |
| Заболевания периферических артерий | ИАПФ, АК |
| Особые клинические ситуации | |
| ИСАГ (пожилой и старческий возраст) | Диуретик, АК |
| Метаболический синдром | БРА, ИАПФ, АК |
| Сахарный диабет | БРА, ИАПФ |
| Беременность | Метилдопа, ББ, АК |
5. Гипертонические кризы. Понятие, классификация, неотложная терапия.
Гипертонические кризы
Внезапное резкое повышение артериального давления. Кризы бывают двух типов.
Криз I типа (гиперкинетический) является кратковременным. Развивается на фоне хорошего самочувствия, длится от нескольких минут до нескольких часов. Проявляется резкой головной болью, головокружением, снижением зрения, тошнотой, реже рвотой. Характерно возбуждение, сердцебиение и дрожь во всем теле, поллакиурия, к концу криза наблюдается полиурия или обильный жидкий стул. Повышается систолическое артериальное давление, увеличивается пульсовое давление. Необходимо незамедлительное проведение снижения артериального давления (необязательно до нормы).
Криз II типа (эу– и гипокинетический) относится к тяжелому. Развивается постепенно, длится от нескольких часов до 4–5 дней и более. Обусловлен циркуляторной гипоксией мозга, характерен для более поздних стадий гипертонической болезни. Проявляется тяжестью в голове, резкими головными болями, иногда парестезиями, очаговыми нарушениями мозгового кровообращения, афазией. Могут быть боли в области сердца ангинозного характера, рвота, приступы сердечной астмы. Значительно повышается диастолическое давление. Артериальное давление необходимо снижать постепенно в течение нескольких часов.
Сравнительная характеристика типов гипертонических кризов
| Особенности криза | I тип | II ТИП |
| Ведущий патогенетический фактор Время появления Течение Развитие Гемодинамические особенности Артериальное давление Основные клинические проявления Продолжительность Осложнения | Адреналин Ранние стадии ГБ Легкое Быстрое Преимущественный рост сердечного выброса Рост САД Головная боль, возбуждение, тахикардия Часы, минуты (редко до суток) Нехарактерны | Норадреналин Поздние стадии ГБ Тяжелое Постепенное Преимущественное повышение периферического сопротивления сосудов Повышение САД и ДАД Заторможенность, нарушение зрения, тошнота От нескольких часов до нескольких суток Мозговой инсульт, транзи-торные ишемические атаки, острый инфаркт миокарда, приступ стенокардии, сердечная астма, слепота |
При развитии симптомов гипертонического криза необходимо:
- Прекратить физическую нагрузку и успокоиться. Присесть или прилечь с приподнятой головой, измерить АД.
- Если давление высокое или гипертонический криз возник впервые необходимо сразу вызвать скорую медицинскую помощь.
- Измерять артериальное давление каждые 20-30 минут с записью в дневнике.
- Если гипертонический криз уже был ранее и известно, какие препараты Вам помогают, попытайтесь снизить повышенное артериальное давление самостоятельно, приняв препараты, рекомендованные врачом на случай резкого повышения АД.
- Могут быть использованы препараты быстрого действия, имеющиеся в домашней аптечке:
- Каптоприл 25 мг или Физиотенз, магнезия в/в, эналаприлат в/в, фуросемид
- Желательно, чтобы давление снижалось постепенно и нормализовалось в течение 2-6 часов в зависимости от исходного уровня. Если через 60 минут давление остается высоким (более 180/100 мм рт.ст.), необходимо повторить прием лекарства (см. пункт 5).
- В случае появления загрудинных болей (стенокардии) нужно принять под язык нитроглицерин в таблетках или в форме спрея. При необходимости прием нужно повторить несколько раз, пока боли не прекратятся. Загрудинные боли, продолжающиеся более 30 минут на фоне приема нитроглицерина, могут быть признаком инфаркта миокарда.
- Если на фоне криза или до него появилось чувство страха, нервное возбуждение – примите успокоительные препараты (валерьянка, корвалол, валокордин).
- Не нужно применять неэффективные или устаревшие средства, такие как Папазол, Дибазол, Но-шпа, Дротаверин, Спазмолгон, Баралгин и пр. и другие «подручные средства», т.к. это лишь затянет гипертонический криз и ухудшит состояние.
- У пожилых пациентов нельзя снижать АД резко, в течение короткого промежутка времени. Такие симптомы как сонливость, слабость, головокружение могут указывать на недостаточное кровообращение головного мозга, опасное возникновением инсульта.
- «Скорую помощь» нужно незамедлительно вызывать в следующих случаях:
- впервые возникший гипертонический криз;
- появление таких тревожных симптомов, как загрудинные боли, выраженная одышка, головокружение, слабость, перебои в работе сердца, нарушение движения конечностей;
- затянувшийся гипертонический криз на фоне отсутствия эффекта от проведенной лекарственной терапии.
6. Симптоматические артериальные гипертензии. Классификация. Дифференциальная диагностика. Лечение. + кафедральная методичка стр 273-290 (то же самое)
СИМПТОМАТИЧЕСКАЯ, ИЛИ ВТОРИЧНАЯ, АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ (СГ) — это АГ, причинно-связанная с определенными заболеваниями или повреждениями органов (или систем), участвующих в регуляции АД.
Она выявляется у 5—15 % больных, страдающих гипертонией.
Классификация. Существует множество классификаций СГ, однако выделяют четыре основные группы СГ. I. Почечная (нефрогенная).
II. Эндокринная.
III. Гипертония, обусловленная поражением сердца и крупных артериальных сосудов (гемодинамическая).
IV. Центрогенная (обусловленная органическим поражением нервной системы). Иногда наблюдается группа СГ при сочетанных поражениях [Арабидзе Г.Г., 1982].
Возможно сочетание нескольких (чаще двух) заболеваний, потенциально способных привести к АГ, например: диабетический гломерулосклероз и хронический пиелонефрит; атеросклеротический стеноз почечных артерий и хронический пиело- или гломерулонефрит; опухоль почки у пациента, страдающего атеросклерозом аорты и мозговых сосудов и т.п. К основным вариантам СГ некоторые авторы относят и экзогенно обусловленную АГ [Кушаковский М.С., 1983; Гогин Е.Е. и др., 1997], развившуюся в результате отравлений свинцом, таллием, кадмием и т.д., а также лекарственными средствами (глюкокортикоиды, контрацептивные средства, индометацин в сочетании с эфедрином и др.).
Однако и с приведенными добавлениями классификация не является исчерпывающей. Существует АГ при полицитемии, хронических обструктивных заболеваниях легких и прочих состояниях, не вошедших в классификацию.
В настоящем разделе рассмотрены четыре основные группы СГ.
Этиология. Этиологическими факторами для СГ являются многочисленные заболевания, сопровождающиеся развитием АГ как симптома. Описано более 70 подобных заболеваний.
• Заболевания почек, почечных артерий и мочевыводящей системы:
а) приобретенные: диффузный гломерулонефрит, хронический пиелонефрит, интерстициальный нефрит, системные васкулиты, амилоидоз, диабетический гломерулосклероз, атеросклероз, тромбоз и эмболия почечных артерий, пиелонефрит на фоне мочекаменной болезни, обструктивные уропатии, опухоли, туберкулез почек и т.п.;
б) врожденные: гипоплазия, дистопия, аномалии развития почечных артерий, гидронефроз, поликистоз почек, патологически подвижная почка и другие аномалии развития и положения почек.
• Заболевания эндокринной системы: феохромоцитома и феохромобластома; альдостерома (первичный альдостеронизм, или синдром Конна); кортикостерома; болезнь и синдром Иценко—Кушинга; акромегалия; диффузный токсический зоб.
• Заболевания сердца, аорты и крупных сосудов:
а) пороки сердца приобретенные (недостаточность клапана аорты и др.) и врожденные (открытый артериальный проток и др.); заболевания сердца, сопровождающиеся застойной сердечной недостаточностью и полной атриовентрикулярной блокадой;
б) поражения аорты врожденные (коарктация) и приобретенные (артерииты аорты и ее ветвей, атеросклероз); стенозирующие поражения сонных и позвоночных артерий и др.
• Заболевания ЦНС: опухоль мозга; энцефалит; травмы; очаговые ишемические поражения и др.
Реноваскулярные (вазоренальные) АГ относятся к почечным СГ.
Патогенез. Механизм развития СГ при каждом заболевании имеет отличительные черты. Они обусловлены характером и особенностями развития основного заболевания. Так, при почечной патологии и реноваскулярных поражениях пусковым фактором является ишемия почки, а доминирующим механизмом повышения АД — повышение активности прессорных и снижение активности депрессорных почечных агентов.
При эндокринных заболеваниях первично повышенное образование некоторых гормонов является непосредственной причиной повышения АД. Вид гиперпродуцируемого гормона (альдостерон или другой минералокортикоид, катехоламины, СТГ, АКТГ и глюкокортикоиды) зависит от характера эндокринной патологии.
При органических поражениях ЦНС создаются условия для ишемии центров, регулирующих АД, и нарушений центрального механизма регуляции АД, вызванного не функциональными (как при ГБ), а органическими изменениями.
При гемодинамических СГ, обусловленных поражением сердца и крупных артериальных сосудов, механизмы повышения АД не представляются едиными и определяются характером поражения. Они связаны с: 1) нарушением функции депрессорных зон (синокаротидной зоны), снижением эластичности дуги аорты (при атеросклерозе дуги); 2) переполнением кровью сосудов, расположенных выше места сужения аорты (при ее коарктации), с дальнейшим включением почечно-ишемического ренопрессорного механизма; с сужением сосудов в ответ на уменьшение сердечного выброса, увеличением объема циркулирующей крови, вторичным гиперальдосте-ронизмом и повышением вязкости крови (при застойной сердечной недостаточности); 3) увеличением и ускорением систолического выброса крови в аорту (недостаточность клапана аорты) при возрастании притока крови к сердцу (артериовенозные свищи) или увеличении продолжительности диастолы (полная атриовентрикулярная блокада).
Клиническая картина. Клинические проявления СГ в большинстве случаев складываются из симптомов, обусловленных повышением АД, и симптомов основного заболевания.
• Повышением АД можно объяснить головные боли, головокружение, мелькание «мушек» перед глазами, шум и звон в ушах, разнообразные боли в области сердца и другие субъективные ощущения. Обнаруживаемые при физикальном обследовании гипертрофия левого желудочка, акцент II тона над аортой — результат стабильной АГ. Выявляются характерные изменения сосудов глазного дна. Рентгенологически и электрокардиографически обнаруживают признаки гипертрофии левого желудочка (более подробно см. «Гипертоническая болезнь»).
• Симптомы основного заболевания:
1) могут быть ярко выраженными, в таких случаях характер СГ устанавливают на основании развернутой клинической симптоматики соответствующего заболевания;
2) отсутствуют — заболевание проявляется только повышением АД; в такой ситуации предположения о симптоматическом характере АГ возникают при: а) развитии АГ у лиц молодого возраста и старше 50—55 лет; б) остром развитии и быстрой стабилизации АГ на высоких цифрах; в) бессимптомном течении АГ; г) резистентности к гипотензивной терапии; д) злокачественном характере течения АГ. По характеру течения СГ, как и гипертоническую болезнь, разделяют на доброкачественные и злокачественные формы. Синдром злокачественной АГ встречается у 13—30 % всех больных СГ.
Различная выраженность симптомов и широкий круг заболеваний, сопровождающихся АГ, обусловливают чрезвычайную вариабельность клинической картины СГ. В связи с этим этапы диагностического поиска будут представлены отдельно для каждой группы заболеваний, выделенных в классификации.
Почечная (нефрогенная) гипертония. Почечная АГ выявляется у 70—80 % больных СГ. Она возникает при заболеваниях паренхимы, почек, нарушениях оттока мочи (реноваскулярная, вазоренальная гипертония). Очень часто почечная АГ возникает при ренопаренхиматозной и вазоренальной патологии.
Клиническая картина многочисленных заболеваний, сопровождающихся АГ почечного генеза, может проявляться следующими синдромами: АГ и патологией мочевого осадка; АГ и лихорадкой; АГ и шумом над почечными артериями; АГ и пальпируемой опухолью брюшной полости; АГ (мо-носимптомно).
На основании оценки выявленных синдромов можно высказать предположения о заболеваниях, сопровождающихся АГ почечного генеза.
• Сочетание АГ и патологии мочевого осадка наблюдается при: а) хроническом и остром гломерулонефрите; б) хроническом пиелонефрите.
• Сочетание АГ и лихорадки наиболее часто встречается при: а) хроническом пиелонефрите; б) поликистозе почек, осложненном пиелонефритом; в) опухолях почки; г) узелковом периартериите.
• Сочетание АГ с пальпируемой опухолью в брюшной полости наблюдается при: а) опухолях почек; б) поликистозе; в) гидронефрозе.
• Сочетание АГ с шумом над почечными артериями характеризует стеноз почечных артерий различного происхождения.
• Моносимптомная АГ характерна для: а) фибромускулярной гиперплазии почечных артерий (реже стенозирующего атеросклероза почечных артерий и некоторых форм артериита); б) аномалий развития почечных сосудов и мочевыводящих путей.
На III этапе диагностического поиска производят: а) обязательное обследование всех больных (см. «Гипертоническая болезнь»); б) специальные исследования по показаниям.
Исследования по показаниям включают:
1) количественную оценку бактериурии, суточную потерю белка с мочой;
2) суммарное исследование функции почек;
3) раздельное исследование функции обеих почек (изотопная реногра-фия и сканирование, инфузионная и ретроградная пиелография, хромоци-стоскопия);
4) ультразвуковое сканирование почек;
5) компьютерную томографию почек;
6) контрастную ангиографию (аортография с исследованием почечного кровотока и каваграфия с флебографией почечных вен);
7) исследование крови на содержание ренина и ангиотензина.
Однако для окончательного решения вопроса нужны дополнительные исследования.
Эти исследования включают анализ мочи по Нечипоренко, посев мочи по Гулду (с качественной и количественной оценкой бактериурии), проведение преднизолоновой пробы (провокация лейкоцитурии после внутривенного введения преднизолона), изотопной ренографии и сканирования, хромоцистоскопии и ретроградной пиелографии. Кроме того, следует безупречно выполнить инфузионную урографию. В сомнительных случаях для окончательного диагноза латентно проте-кающего пиелонефрита или гломерулонефрита производят биопсию почки.
Эти исследования — биопсия почки и ангиография — проводят по строгим показаниям.
Ангиографию осуществляют больным молодого и среднего возраста при стабильной диастолической АГ и неэффективности лекарственной терапии (небольшое снижение АД наблюдается только после применения массивных доз препаратов, действующих на разные уровни регуляции АД).
Данные ангиографии трактуются следующим образом:
1) односторонний стеноз артерии, устья и средней части почечной артерии, сочетающийся с признаками атеросклероза брюшной аорты (неровность ее контура), у мужчин среднего возраста характерен для атеросклероза почечной артерии;
2) чередование на ангиограмме участков стеноза и дилатации пораженной почечной артерии с локализацией стеноза в средней трети ее (а не в устье) при неизмененной аорте у женщин моложе 40 лет свидетельствует о фибромускулярной гиперплазии стенки почечной артерии;
3) двустороннее поражение почечных артерий от устьев и до средней трети, неравномерность контуров аорты, признаки стеноза других ветвей грудной и брюшной аорты характерны для артериита почечных артерий и аорты.
Эндокринная гипертония. Среди эндокринных заболеваний, сопровождающихся АГ, не рассматривается диффузный токсический зоб, так как АГ при нем не вызывает сложностей в диагностике, а по своему механизму является преимущественно гемодинамической.
Клиническая картина других эндокринных заболеваний, протекающих с повышением АД, может быть представлена в виде следующих синдромов: АГ и симпатико-адреналовые кризы; АГ с мышечной слабостью и мочевым синдромом; АГ и ожирение; АГ и пальпируемая опухоль в брюшной полости (редко).
Выявление этих синдромов на разных этапах диагностического поиска позволяет предположить эндокринный генез АГ.
На I этапе диагностического поиска жалобы больного на возникновение гипертонических кризов, сопровождающихся приступами сердцебиений, мышечной дрожью, профузными потами и бледностью кожных покровов, головными болями, болями за грудиной, позволяют говорить о феохромоцитоме. Если перечисленные жалобы возникают на фоне лихорадки, похудения (проявление интоксикации), сопровождаются болями в животе (метастазы в регионарные забрюшинные лимфатические узлы?); вероятно предположение о феохромобластоме.
Вне кризов АД может быть нормальным или повышенным. Склонность к обморокам (особенно при вставании с постели) на фоне постоянно высокого АД также характерна для феохромоцитомы, протекающей без кризов.
Жалобы больного на повышение АД и приступы мышечной слабости снижение физической выносливости, жажду и обильное мочеиспускание. особенно в ночные часы, создают классическую клиническую картину первичного гиперальдостеронизма (синдром Конна) и выявляют возможную причину АГ уже на I этапе диагностического поиска. Сочетание приведенных симптомов с лихорадкой и болями в животе делает вероятным предположение об аденокарциноме надпочечника.
Если больной предъявляет жалобы на увеличение массы тела, совпадающее по времени с развитием АГ (при алиментарном ожирении, как правило, увеличение массы тела происходит задолго до развития АГ), нарушения в половой сфере (дисменорея у женщин, угасание либидо у мужчин), то можно предположить синдром или болезнь Иценко—Кушинга. Предположение подкрепляется, если больного беспокоят жажда, полиурия, кожный зуд (проявление нарушений углеводного обмена).
Таким образом, I этап диагностического поиска является очень информативным для диагностики эндокринных заболеваний, сопровождающихся АГ. Сложности возникают при феохромоцитоме, не сопровождающейся кризами. В данной ситуации диагностическое значение последующих этапов, особенно III, чрезвычайно возрастает.
На II этапе диагностического поиска физикальные методы обследования позволяют выявить:
а) изменения сердечно-сосудистой системы, развивающиеся под влиянием повышения АД;
б) преимущественное отложение жира на туловище при относительно худых конечностях, розовые стрии, угри, гипертрихоз, свойственные болезни и синдрому Иценко—Кушинга;
в) слабость мышц, вялые параличи, судороги, характерные для синдрома Конна; положительные симптомы Хвостека и Труссо; периферические отеки (изредка наблюдаются при альдостероме);
г) округлое образование в животе (надпочечник); уточнение характера опухоли возможно только на III этапе.
Необходимо провести провокационный тест: бимануальная пальпация области почек поочередно в течение 2—3 мин может вызвать катехоламиновый криз при феохромоцитоме. Отрицательные результаты этой пробы не исключают феохромоцитомы, так как она может иметь вненадпочечниковое расположение.
Этап III диагностического поиска приобретает решающее значение, поскольку позволяет: а) поставить окончательный диагноз; б) выявить локализацию опухоли; в) уточнить ее характер; г) определить тактику лечения.
Уже при проведении обязательных исследований обнаруживаются характерные изменения: лейкоцитоз и эритроцитоз в периферической крови, гипергликемия и гипокалиемия; стойкая щелочная реакция мочи (вследствие высокого содержания калия), характерная для первичного гиперальдостеронизма. При развитии «гипокалиемической нефропатии» выявляются полиурия, изостенурия, никтурия (исследование мочи по Зимницкому).
Из дополнительных методов исследования для выявления или исключения первичного альдостеронизма производят:
1) исследование суточного выделения калия и натрия в моче с подсчетом коэффициента Na/K (при синдроме Конна он более 2);
2) определение содержания калия и натрия в плазме крови до и после приема 100 мг гипотиазида (выявление гипокалиемии при первичном альдостеронизме, если исходные показатели нормальные);
3) определение щелочного резерва крови (выраженный алкалоз при первичном альдостеронизме);
4) определение содержания альдостерона в суточной моче (увеличено при первичном альдостеронизме);
5) определение уровня ренина в плазме крови (понижение активности ренина при синдроме Конна).
Решающее значение для диагностики всех опухолей надпочечника имеют данные следующих исследований:
1) ретропневмоперитонеума с томографией надпочечников;
2) радионуклидного исследования надпочечников;
3) компьютерной томографии;
4) селективной флебографии надпочечников.
Особенно сложно выявить феохромоцитому вненадпочечниковой локализации. При клинической картине заболевания и отсутствии опухоли надпочечников (по данным ретропневмоперитонеума с томографией) необходимо произвести грудную и брюшную аортографию с последующим тщательным анализом аортограмм.
Из дополнительных методов для постановки диагноза феохромоцитомы до проведения указанных инструментальных методов производят следующие лабораторные исследования:
1) определение суточной экскреции с мочой катехоламинов и содержания ванилил-миндальной кислоты на фоне криза (резко повышено) и вне его;
2) раздельное исследование экскреции адреналина и норадреналина (опухоли, расположенные в надпочечниках и стенке мочевого пузыря, секретируют адреналин и норадреналин, опухоли других локализаций — только норадреналин);
3) гистаминовый (провоцирующий) и регитиновый (купирующий) тесты (при наличии феохромоцитомы положительные).
Из дополнительных методов исследования при подозрении на болезнь и синдром Иценко—Кушинга производят:
1) определение в суточной моче содержания 17-кетостероидов и 17-ок-сикортикостероидов;
2) исследование суточного ритма секреции 17- и 11-оксикортикосте-роидов в крови (при болезни Иценко—Кушинга содержание гормонов в крови монотонно повышено в течение суток);
3) обзорный снимок турецкого седла и его компьютерную томографию (выявление аденомы гипофиза);
4) все описанные ранее инструментальные методы исследования надпочечников для выявления кортикостеромы.
Постановкой диагноза эндокринного заболевания заканчивается диагностический поиск.
Гемодинамическая гипертония. Гемодинамическая АГ обусловлена поражением сердца и крупных сосудов и развивается при: 1) атеросклерозе,брадикардии, аортальной недостаточности; 2) коарктации аорты (регионарная); 3) артериовенозных фистулах (гиперкинетический циркуляторный синдром); 4) сердечной недостаточности и пороках митрального клапана (ишемическая застойная).
Гемодинамическая АГ связана непосредственно с заболеваниями сердца и крупных сосудов, изменяющими условия системного кровотока и способствующими подъему АД. Характерно изолированное или преимущественное повышение систолического АД.
На I этапе диагностического поиска получают сведения о: а) времени возникновения повышения АД, его характере и субъективных ощущениях; б) различных проявлениях атеросклероза у лиц пожилого возраста и степени их выраженности (перемежающаяся хромота, резкое снижение памяти и т.д.); в) заболеваниях сердца и крупных сосудов, с которыми можно связать повышение АД; г) проявлениях застойной сердечной недостаточности; д) характере и эффективности лекарственной терапии.
Возникновение АГ на фоне существующих заболеваний и прогрессиро-вание ее в связи с ухудшением течения основного заболевания обычно свидетельствует о симптоматическом характере гипертонии (АГ — симптом основного заболевания).
На II этапе диагностического поиска выявляют: 1) уровень повышения АД, его характер; 2) заболевания и состояния, которыми определяется повышение АД; 3) симптомы, обусловленные АГ.
У большинства пожилых больных АД не отличается стабильностью, возможны беспричинные подъемы и внезапные понижения его. АГ характеризуется повышением систолического давления при нормальном, а иногда и пониженном диастолическом — так называемая атеросклеротическая гипертония, или возрастная (склеротическая) гипертония пожилых (без явных клинических проявлений атеросклероза). Выявление признаков атеросклероза периферических артерий (снижение пульсации на артериях нижних конечностей, похолодание их и т.д.) делает диагноз атеросклеротической АГ более вероятным. При аускультации сердца можно обнаружить интенсивный систолический шум над аортой, акцент II тона во втором межреберье справа, что свидетельствует об атеросклерозе аорты (иногда выявляется атеросклеретический порок сердца). Присоединение к уже существующей систолической АГ довольно стойкого повышения диастоличе-ского давления может свидетельствовать о развитии атеросклероза почечных артерий (систолический шум над брюшной аортой у пупка прослушивается не всегда).
Может быть выявлено резкое повышение АД на руках и снижение его на ногах. Сочетание такой АГ с усиленной пульсацией межреберных артерий (при осмотре и пальпации), ослаблением пульсации периферических артерий нижних конечностей, запаздыванием пульсовой волны на бедренных артериях позволяет с достоверностью заподозрить коарктацию аорты. Выявляют грубый систолический шум над основанием сердца, выслушиваемый над грудным отделом аорты спереди и сзади (в межлопаточной области), шум иррадиирует по ходу крупных сосудов (сонных, подключичных). Характерная аускультативная картина позволяет на II этапе с уверенностью поставить диагноз коарктации аорты.
При физикальном исследовании могут быть выявлены признаки недостаточности аортального клапана, незаращения артериального протока, проявления застойной сердечной недостаточности. Все эти состояния могут приводить к АГ.
На Ш этапе диагностического поиска можно поставить окончательный диагноз.
Обнаруживаемое при исследовании липидного спектра крови повышение уровня холестерина (чаше а-холестерина), триглицеридов, (3-липопротеидов наблюдается при атеросклерозе. При офтальмоскопии могут быть выявлены изменения сосудов глазного дна, развивающиеся при атеросклерозе мозговых сосудов. Снижение пульсации сосудов нижних конечностей, иногда сонных артерий и изменение формы кривых на реограмме подтверждает атеросклеротическое поражение сосудов.
На III этапе диагностического поиска обнаруживают характерные электрокардиографические, рентгенологические и эхокардиографические признаки порока сердца (см. «Пороки сердца»).
Больным с коарктацией аорты ангиография обычно производится для уточнения локализации и протяженности пораженного участка (перед операцией). Если имеются противопоказания к оперативному лечению, то для постановки диагноза достаточно данных физикального исследования.
Центрогенная гипертония. Этот вариант гипертонии обусловлен органическими поражениями нервной системы.
На I этапе диагностического поиска выявляют характерные жалобы на пароксизмальное повышение АД, сопровождающееся тяжелыми головными болями, головокружениями и различными вегетативными проявлениями, иногда эпилептиформным синдромом. В анамнезе имеются указания на перенесенные травмы, сотрясение мозга, возможно, арахноидит или энцефалит.
Сочетание характерных жалоб с соответствующим анамнезом позволяет предположить нейрогенный генез АГ.
На II этапе диагностического поиска важно получить сведения, позволяющие высказать предположение об органических поражениях ЦНС. В начальной стадии болезни таких данных может не быть. При длительном течении болезни можно выявить особенности поведения, нарушения двигательной и чувствительной сферы, патологию со стороны отдельных черепных нервов. Сложно поставить правильный диагноз у лиц пожилого возраста, когда все особенности поведения объясняют развитием церебрального атеросклероза.
На III этапе получают наиболее важные для диагностики сведения.
Необходимость в проведении дополнительных методов исследования возникает при соответствующих изменениях глазного дна («застойные соски») и сужении полей зрения.
Главной задачей III этапа является четкий ответ на вопрос о том, есть у больного опухоль мозга или ее нет, так как только своевременная диагностика позволяет провести хирургическое лечение.
Больному, помимо рентгенографии черепа (информативность которой значима только при больших опухолях мозга), производят электроэнцефалографию, реоэнцефалографию, ультразвуковое сканирование и компьютерную томографию черепа.
Диагностика. Выявление СГ базируется на четком и точном диагнозе заболеваний, сопровождающихся повышением АД, и на исключении других форм СГ.
СГ может быть ведущим признаком основной болезни, и тогда она фигурирует в диагнозе: например, реноваскулярная гипертония. Если АГ является одним из многих проявлений заболевания и не выступает главным симптомом, то в диагнозе может не упоминаться, например при диффузном токсическом зобе, болезни или синдроме Иценко—Кушинга.
Лечение.
I . Этиологическое лечение. При выявлении АГ, обусловленной патологией почечных сосудов, коарктацией аорты или гормонально-активными аденомами надпочечников, ставят вопрос об оперативном вмешательстве (устранение причин, приводящих к развитию АГ). В первую очередь это касается феохромоцитомы, альдостеронпродуцирующей аденомы и аденокарциномы
надпочечника, кортикостеромы и, конечно, гипернефроидного рака почки.
При аденоме гипофиза используют методы активного воздействия с помощью рентгено- и радиотерапии, лечения лазером, в ряде случаев производят операции.
Лекарственная терапия основного заболевания (узелкового периартериита, эритремии, застойной сердечной недостаточности, инфекции мочевых путей и т.д.) дает положительный эффект и в отношении АГ.
II. Лекарственная гипотензивная терапия. В подавляющем большинстве
случаев терапия не ограничивается средствами, направленными на лечение
основного заболевания, приведшего к развитию АГ, а сочетается с назначением различных групп гипотензивных препаратов.
Больным стойкой АГ при поражении почек широко назначают мочегонные средства [дихлотиазид (гипотиазид), фуросемид, триамтерен, или триампур композитум] в сочетании с ингибиторами АПФ.
При отсутствии должного гипотензивного эффекта дополнительно назначают b -адреноблокаторы и периферические вазодилататоры.
Комбинированная терапия с применением различных групп лекарственных средств показана при стабильной, особенно диастолической, АГ любого генеза.
Необходимо тщательно учитывать противопоказания к использованию лекарственных средств и возможные побочные эффекты.
В пожилом возрасте не рекомендуется быстро снижать АД при длительной стабильной АГ, так как может ухудшиться коронарное, церебральное и почечное кровообращение.
Для нормализации тонуса мозговых сосудов и улучшения регуляции нервных процессов можно применять малые дозы кофеина и кордиамина, особенно в утренние часы, когда АД невысокое.
Прогноз СГ зависит от течения и исхода заболевания, проявлением которого является СГ.
Профилактика СГ состоит в предупреждении развития основного заболевания и его своевременном лечении.
7. ИБС. Факторы риска. Классификация. Профилактика.
8. ИБС. Инструментальные методы диагностики. Нагрузочные пробы.
9. Клинические варианты стенокардии. Характеристика функциональных классов стабильной стенокардии напряжения. Лечение.
12. Принципы немедикаментозной и медикаментозной терапии стенокардии.
ИБС - кафедральная методичка ОКС стр 107- 131 + лекция ИБС
ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА (ИБС) - острое или хроническое поражение миокарда, обусловленное уменьшением или прекращением доставки кислорода к сердечной мышце, возникающее в результате патологических процессов в системе коронарных артерий [ВОЗ, 1979].
Нарушение снабжения миокарда кислородом при ИБС обусловлено несоответствием между коронарным кровотоком и метаболическими потребностями сердечной мышцы. Эта ситуация может быть следствием:
• атеросклероза коронарных артерий;
• спазма неизмененных (или малоизмененных) коронарных артерии,
• нарушения микроциркуляции в миокарде;
• повышения активности свертывающей системы крови (или снижения активности противосвертывающей системы).
ИБС широко распространена во многих странах мира, ею болеют преимущественно мужчины в возрасте 40—60 лет, у женщин после 60 лет ИБС встречается с той же частотой, что и у мужчин того же возраста. Из всех причин смерти от сердечно-сосудистых заболеваний на долю ИБС приходится более 50 %.
Классификация. В 1979 г. Комитетом экспертов ВОЗ по стандартной клинической терминологии была разработана классификация ИБС, модифицированная Кардиологическим научным центром Российской академии медицинских наук. Эта классификация предусматривает выделение следующих клинических форм ИБС:
. внезапная коронарная смерть (первичная остановка сердца);
• стенокардия (стабильная, прогрессирующая стенокардия напряжения, спонтанная стенокардия);
• инфаркт миокарда с зубцом Q , ранее именовавшийся как «крупно-очаговый» и без зубца Q , ранее именовавшийся как «мелкоочаговый»);
• постинфарктный кардиосклероз;
• нарушения ритма сердца (имеются в виду лишь связанные с ишемией миокарда);
• сердечная недостаточность (связанная с поражением миокарда
вследствие ИБС).
В последние годы произошли изменения в терминологии. Так, в практике используется термин «нестабильная стенокардия» (о чем будет сказано более подробно ниже в разделе «Стенокардия») и термин «острый коронарный синдром» (ОКС).
ОКС объединяет несколько форм ИБС: нестабильную стенокардию, инфаркты миокарда с зубцом Q и без зубца Q , а также острые осложнения при оперативном вмешательстве на коронарных артериях и внезапную смерть.
По существу диагноз ОКС является временным, «рабочим», и используется для выделения категории больных с высокой вероятностью развития инфаркта миокарда или нестабильной стенокардии при первом контакте врача с ними. Лечение больных с ОКС начинают до получения информации, необходимой для уверенной постановки нозологического диагноза (инфаркта миокарда или нестабильной стенокардии). После определения какого-либо из перечисленных выше клинических состояний на основе дополнительной информации производится уточнение лечения.
Главным этиологическим фактором ИБС является атеросклероз коронарных артерий. Факторы, предрасполагающие к его развитию, следует рассматривать как факторы риска ИБС. Наиболее важными среди них являются: 1) гиперлипидемия (высокая концентрация холестерина низкой плотности, снижение холестерина высокой плотности, повышение уровня триглицеридов); 2) артериальная гипертония; 3) курение; 4) гиподинамия (физическая детренированность); 5) избыточная масса тела и высококалорийное питание; 6) сахарный диабет или инсулинорезистентность периферических тканей); 7) генетическая предрасположенность.
Стенокардия
Стабильная стенокардия характеризуется загрудинной болью сжимающего характера, возникающей при физической нагрузке, эмоциональном стрессе, выходе на холод, ходьбе против ветра, в покое после обильного приема пищи. Этот тип стенокардии называется «стабильной стенокардией напряжения».
Классификация:
Стенокардия напряжения:
-впервые возникшая
-стабильная с указанием функционального класса (1-4)
-спонтанная(вазоспастическая, особая, вариантная, Принцметала)
Клиническая картина. Главным проявлением стенокардии является характерный болевой приступ. В классическом описании стенокардия характеризуется как приступообразное давящее ощущение в области грудины, возникающее при физическом усилии, нарастающее по выраженности и распространенности.
Обычно боль сопровождается чувством дискомфорта в груди, иррадиирует в левое плечо или обе руки, в шею, нижнюю челюсть, зубы; ей может сопутствовать чувство страха, которое заставляет больных застывать в неподвижной позе. Боли быстро исчезают после приема нитроглицерина или устранения физического напряжения (остановка при ходьбе, устранение других условий и факторов, спровоцировавших приступ: эмоциональный стресс, холод, прием пищи).
В зависимости от обстоятельства, при котором возникли боли, различают стенокардию напряжения и покоя. Появление болевого синдрома при типичной стенокардии напряжения зависит от уровня физической активности. Согласно принятой классификации Канадского общества кардиологов, по способности выполнять физические нагрузки больными стенокардией напряжения выделяют четыре функциональных класса:
I функциональный класс — обычная физическая активность не вызывает приступа стенокардии. Стенокардия появляется при необычно большой, быстро выполняемой нагрузке.
II функциональный класс — небольшое ограничение физической активности. Стенокардию вызывает обычная ходьба на расстояние более 500 м или подъем по лестнице на один этаж, в гору, ходьба после еды, при ветре, в холод; возможно развитие стенокардии под влиянием эмоционального напряжения.
III функциональный класс — выраженное ограничение физической активности. Стенокардия возникает при обычной ходьбе на расстояние 100—200 м. Возможны редкие приступы стенокардии покоя.
IV функциональный класс — неспособность выполнять любую физическую работу без дискомфорта. Появляются типичные приступы стенокардии покоя.
К стенокардии покоя принято относить приступы болей, возникающие во время полного покоя, главным образом во сне.
Особо должна быть выделена так называемая вариантная стенокардия (стенокардия Принцметала): приступы стенокардии покоя, как правило, возникают ночью без предшествующей стенокардии напряжения. В отличие от обычных приступов стенокардии они сопровождаются значительным подъемом сегмента ST на ЭКГ в момент болей. С помощью коронароангиографии показано, что вариантная стенокардия обусловлена спазмом склерозированных или неизмененных коронарных артерий. Этот вариант ИБС относят к нестабильной стенокардии.
Основной клинический симптом — приступ стенокардии — не является Патогномоничным только для ИБС. В связи с этим диагноз стенокардии как формы хронической ИБС можно поставить только с учетом всех данных, полученных на различных этапах обследования больного.
Диагностика:
Электрокардиография — ведущий метод инструментальной диагностики хронической ИБС. При этом нужно учитывать следующие положения.
1. Депрессия сегмента ST (возможно сочетание с «коронарным» зубцом Т) является подтверждением предварительного диагноза ИБС. Однако негативный зубец Т может быть проявлением перенесенного ранее мелкоочагового инфаркта (надо учитывать отрицательные результаты лабораторных данных, указывающих на резорбционно-некротический синдром), тяжелого миокардита, дилатационной кардиомиопатии.
2. Подтвердить ИБС могут характерные ЭКГ-признаки (депрессия сегмента ST ) во время приступа и быстрое их исчезновение (в течение от нескольких часов до суток). Для верификации ИБС используют суточное ЭКГ-мониторирование по Холтеру (холтеровское мониторирование).
3. У большинства больных стенокардией, не перенесших ИМ, ЭКГ вне приступа не изменена, а во время приступа изменения возникают не у всех больных.
4. «Рубцовые» изменения, выявленные на ЭКГ, при наличии характерных болей в сердце являются важным доводом в пользу диагноза ИБС.
5. Для выявления признаков ишемии миокарда, когда на ЭКГ, снятой в покое, они отсутствуют, а также для оценки состояния коронарного резерва (тяжесть коронарной недостаточности) проводят пробы с физической нагрузкой.
Среди различных нагрузочных проб наибольшее распространение получили пробы с физической нагрузкой на велоэргометре или бегущей дорожке (тредмиле). Показаниями к проведению велоэргометрии для диагностики ИБС являются: а) атипичный болевой синдром; б) нехарактерные для ишемии миокарда изменения на ЭКГ у лиц среднего и пожилого возраста, а также у молодых мужчин с предварительным диагнозом ИБС; в) отсутствие изменений на ЭКГ при подозрении на ИБС.
Пробу расценивают как положительную, если в момент нагрузки отмечают: а) возникновение приступа стенокардии; б) появление тяжелой одышки, удушья; в) снижение АД; г) депрессию сегмента ST «ишемического типа» на 1 мм и более; д) подъем сегмента ST на 1 мм и более.
Основными противопоказаниями к проведению проб с физической нагрузкой служат: а) острый инфаркт миокарда; б) частые приступы стенокардии напряжения и покоя; в) сердечная недостаточность; г) прогностически неблагоприятные нарушения сердечного ритма и проводимости; д) тромбоэмболические осложнения; е) тяжелые формы АГ; ж) острые инфекционные заболевания.
При необходимости (невозможность проведения велоэргометрии или технического ее выполнения, детренированность больных) усиление работы сердца достигается с помощью теста частой чреспищеводной стимуляции (метод нетравматичен, широко распространен).
6. Для ЭКГ-диагностики ИБС применяют различные фармакологические нагрузочные пробы с использованием лекарственных препаратов, влияющих на коронарное русло и функциональное состояние миокарда. Так, для ЭКГ-диагностики вазоспастической формы ИБС применяют пробы с эргометрином или дипиридамолом.
Фармакологические пробы с пропранололом, хлоридом калия проводят в тех случаях, когда имеются исходные изменения конечной части желудочкового комплекса на ЭКГ и необходимо проведение дифференциальной диагностики между ИБС и НЦД.
Выявленные на ЭКГ изменения всегда оценивают с учетом других данных обследования больного.
Ультразвуковое исследование сердца необходимо проводить всем больным, страдающим стенокардией. Оно позволяет оценить сократительную способность миокарда, определить размеры его полостей. Так, при выявлении порока сердца, дилатационной или обструктивной кардиомиопатии диагноз ИБС становится маловероятным; однако у лиц пожилого возраста возможно сочетание этих болезней.
Стресс-эхокардиография является более точным методом диагностики ИБС. Существо метода заключается в изменении локальной подвижности различных сегментов левого желудочка при увеличении ЧСС в результате введения добутамина, физической нагрузки или чреспищеводной стимуляции. При увеличении ЧСС повышается потребность миокарда в кислороде и возникает дисбаланс между доставкой кислорода по венечным артериям и потребностью в нем определенного участка миокарда, снабжаемого кровью пораженной ветвью той или иной коронарной артерии. Вследствие этого дисбаланса возникают локальные нарушения сократимости миокарда. Изменения локальной сократимости могут предшествовать другим проявлениям ишемии (изменениям ЭКГ, болевому синдрому).
Ряд инструментальных методов исследования, проводимых в общепринятом порядке у больного с подозрением на ИБС, позволяет выявить внесердечные признаки атеросклероза аорты (рентгеноскопия грудной клетки) и сосудов нижних конечностей (реовазография) и получить косвенный довод, подтверждающий ИБС.
Лабораторные исследования (клинический и биохимический анализы крови) позволяют: а) выявить гиперлипидемию — фактор риска ИБС; б) исключить проявление резорбционно-некротического синдрома (см. «Инфаркт миокарда») и при появлении изменений на ЭКГ и затянувшемся приступе стенокардии отвергнуть диагноз инфаркта миокарда. В ряде случаев проводят дополнительные исследования.
Селективная коронарография является «золотым стандартом» в диагностике ИБС. Показаниями для ее проведения являются:
• стенокардия напряжения более III функционального класса при отсутствии эффекта от лекарственной терапии;
• стенокардия I—II функционального класса у больных, перенесших инфаркт миокарда;
• стенокардия напряжения в сочетании с блокадой левой ножки пучка Тиса на ЭКГ и признаками ишемии по данным сцинтиграфии миокарда;
• тяжелые желудочковые аритмии;
• стабильная стенокардия у больных, которым предстоит операция на сосудах (аорта, бедренные, сонные артерии);
• реваскуляризация миокарда (аортокоронарное шунтирование, чрескожная транслюминальная ангиопластика);
. уточнение диагноза по клиническим или профессиональным соображениям.
Следует отметить, что «нормальная» коронарография свидетельствует лишь об отсутствии существенного сужения главных коронарных артерий и их ветвей, при этом могут оставаться невыявленными изменения в мелких артериях.
Проведение этих методов возможно лишь в специализированных стационарах и по определенным показаниям.
Сцинтиграфия миокарда — метод визуализации миокарда, позволяющий выявить участки ишемии (больному вводится радиофармакологический препарат, который фиксируется в участках ишемии миокарда).
Диагностика ИБС. При постановке диагноза учитывают основные и дополнительные диагностические критерии.
К основным критериям относят:
1) типичные приступы стенокардии напряжения и покоя (анамнез, наблюдение);
2) достоверные указания на перенесенный инфаркт миокарда (анамнез, признаки хронической аневризмы сердца, признаки Рубцовых изменений на ЭКГ);
3) положительные результаты нагрузочных проб (велоэргометрия, частая предсердная стимуляция);
4) положительные результаты коронарографии (стеноз коронарной артерии, хроническая аневризма сердца);
5) выявление зон постинфарктного кардиосклероза.
Дополнительными диагностическими критериями считают:
1) признаки сердечной недостаточности;
2) нарушения сердечного ритма и проводимости (при отсутствии других заболеваний, вызывающих эти явления).
Лечение стенокардии. Основными целями лечения больных со стабильной стенокардией, согласно рекомендациям Европейского кардиологического общества, являются:
• улучшение прогноза больного путем предупреждения инфаркта миокарда (ИМ) и внезапной смерти;
• минимизация или полное устранение клинических проявлений заболевания.
Этих целей можно достичь сочетанным применением мер немедикаментозного воздействия, направленных на коррекцию имеющихся факторов риска, и медикаментозного лечения. Альтернативой последнему в ряде случаев могут служить методы интервенционной кардиологии (баллонная ангиопластика, стентирование) и коронарной хирургии (шунтирование, трансмиокардиальная лазерная реваскуляризация).
Немедикаментозные
Изменение образа жизни
Гиполипидемическая диета
Контроль веса
Физическая активность
Отказ от курения
Ограничение употребления алкоголя
Медикаментозное:
Антиагреганты - АСК 75-100 мг/сут
b-блокаторы - ¯до 55-60 уд/мин
Статины - розувастатин до 40 мг, аторвастатин до 80 мг
Ингибиторы АПФ/ АРАII
Предуктал (триметазидин)
Дополнительно: БКК (хорошо при вазоспастической стенокардии)
Пролонгированные нитраты - изосорбида мононитрат/динитрат
Ивабрадин (блокатор if-каналов)
10. Нестабильная стенокардия. Классификация клинических форм. Диагностические критерии. Лечение.
11. Острый коронарный синдром. Определение. Этиопатогенез. Диагностика. Общие принципы ведения больных с ОКС. кафедральная методичка ОКС стр 107- 131 + лекция ИБС +
Острый коронарный синдром
Как уже упоминалось, острый коронарный синдром (ОКС) объединяет несколько вариантов проявления ИБС: нестабильную стенокардию (ситуация, когда на ЭКГ нет подъема сегмента ST и отсутствуют маркеры некроза миокарда) и острый инфаркт миокарда с зубцом Q или без зубца Q (на ЭКГ имеется подъем сегмента ST и присутствуют маркеры некроза миокарда). Это сделано исключительно из практических целей, так как лечебная тактика у больных при затяжном болевом приступе, но с различным положением сегмента ST на ЭКГ при первом контакте с больным будет принципиально различная.
Нестабильная стенокардия — этот термин объединяет несколько ситуаций, к которым относятся:
• впервые возникшая стенокардия напряжения;
• прогрессирующая стенокардия напряжения (учащение приступов стенокардии и/или увеличение их продолжительности и силы);
• стенокардия, впервые возникшая в покое.
Классификация. Общепринятой классификации нестабильной стенокардии (НС) не существует. На практике используют классификацию Бра-унвальда (1989), подразделяющую нестабильную стенокардию на три класса (чем выше класс, тем вероятнее развитие осложнений).
I класс — впервые возникшая стенокардия или усиление имевшейся стенокардии в течение месяца.
II класс — стенокардия покоя в течение предшествующего месяца.
III класс — стенокардия покоя в течение последних 48 ч.
Патогенез. Основным механизмом развития нестабильной стенокардии является разрыв капсулы фиброзной бляшки в коронарной артерии, что приводит к образованию тромба с неполным закрытием просвета сосуда. Пристеночный тромб препятствует адекватному снабжению миокарда, что приводит к появлению болевого синдрома. Разрыву фиброзной бляшки способствуют накопление большого количества липидов и недостаточное содержание в ней коллагена, а также гемодинамические факторы. Кроме того, в патогенезе нестабильной стенокардии играют роль кровоизлияние в бляшку из-за разрыва vasa vasorum, увеличенная агрегация тромбоцитов, снижение антитромботических свойств эндотелия, высвобождение вазоактивных веществ (тромбоксан, эндотелии, серотонин) в ответ на повреждение целостности фиброзной бляшки.
Клиническая картина. Нестабильная стенокардия характеризуется типичными ангинозными приступами, и уже на I этапе диагностического поиска можно выявить ряд особенностей, позволяющих заподозрить «нестабильность» стенокардии:
1) на протяжении последних 1—2 мес увеличились число, продолжительность и сила приступов стенокардии напряжения;
2) стенокардия впервые появилась не более 1 мес назад;
3) приступы стенокардии стали появляться в покое или в ночное время;
4) нитроглицерин, ранее купировавший приступы болей, ослабил эффект (больной стал принимать большее количество таблеток нитроглицерина) или вовсе перестал действовать.
Такая ситуация может возникнуть как у лица, не переносившего инфаркт миокарда, так и у больного, ранее перенесшего инфаркт миокарда.
На II этапе диагностического поиска можно не получить какой-либо существенной информации или же выявить те же признаки, что и у больного со стабильной стенокардией.
Исключительно важен III этап диагностического поиска: так как НС входит в понятие ОКС, то основная задача врача заключается в дифференцировании нестабильной стенокардии с инфарктом миокарда (в первую очередь без зубца Q ).
Электрокардиография является основным инструментальным методом (по возможности рекомендуется сравнивать ЭКГ, зарегистрированные у больного в момент осмотра с предыдущими ЭКГ для определения имеющейся динамики). При наличии соответствующей симптоматики для НС характерны депрессия сегмента ST не менее 1 мм в двух и более смежных отведениях, а также инверсия зубца Т глубиной более 1 мм в отведениях с преобладающим зубцом R. Для развивающегося инфаркта миокарда (с зубцом Q или без зубца Q ) характерен подъем сегмента ST (стойкий или преходящий). Помимо обычной ЭКГ в покое, для диагностики НС и контроля эффективности лечения применяется холтеровское мониторирование ЭКГ.
Наибольшее значение в интерпретации ОКС имеют биохимические методы исследования. Наиболее предпочтительным считается определение содержания в крови сердечных тропонинов Т и I , повышение которых представляет собой наиболее надежный критерий некроза миокарда. Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из трех субъединиц: тропонин Т (ТнТ), тропонин Ц (ТнС), тропонин I (Тн1). Считается, что Тн1 и ТнТ являются наиболее чувствительными и специфичными маркерами некроза миокарда. Их уровень повышается в крови уже через 2—3 ч после развития инфаркта миокарда, увеличивается в 300—400 раз по сравнению с нормой и сохраняется повышенным в течение 10—14 дней. Менее специфичным, но более доступным методом является исследование фермента креатинфосфокиназы (КФК), повышение его содержания в крови за счет изофермента свидетельствует о некрозе. Достаточно чувствительным является определение в сыворотке крови содержания миоглобина. Миоглобин — хромопротеид, сходный по строению с гемоглобином, пигментный белок мышечной ткани, обеспечивающий депонирование в ней кислорода. Если при нестабильной стенокардии развивается острый инфаркт миокарда, то содержание миоглобина в крови резко повышается и превышает 200 мкг/л через 4 ч после ангинозного приступа. Через 6 ч его уровень повышается у 100 % больных с впервые развившимся инфарктом миокарда. Повышение содержания тропонинов и КФК-МВ регистрируется через 4—6 ч от начала формирования инфаркта миокарда (некроза сердечной мышцы). Эти биохимические тесты имеют большое значение в трактовке ОКС.
Диагноз. Диагноз НС является по существу временным, так как в процессе лечения и наблюдения за больным врач приходит к выводу о развитии инфаркта миокарда (с зубцом Q или без зубца Q ), что требует соответствующей терапии, или же у больного имеет место обострение коронарной недостаточности, что требует иного медикаментозного лечения или же кардиохирургического вмешательства (чрескожная баллонная ангиопластика или аортокоронарное шунтирование).
В течение первых 8—12 ч после появления симптоматики НС необходимо определить степень риска развития инфаркта и смертельного исхода.
К критериям высокого риска относятся повторяющиеся ангинозные приступы в сочетании с депрессией или подъемом сегмента ST ; повышение содержания сердечных тропонинов (при невозможности их определения — КФК-МВ) в крови; гемодинамическая нестабильность (артериальная гипотония, сердечная недостаточность); пароксизмальные желудочковые нарушения ритма.
Признаками низкого непосредственного риска смерти и развития инфарк та миокарда являются отсутствие повторных приступов болей в груди; отсутствие депрессии или подъема сегмента ST ; изменения только зубца Т (инверсия, уменьшение амплитуды) или нормальная ЭКГ; отсутствие повышения в крови тропонинов (при невозможности их определения - КФК-МВ).
Лечение. Первыми медикаментозными средствами, которые следует применять при подозрении на ОКС, являются аспирин — 325 мг внутрь и нитроглицерин — 0,5 мг под язык (при необходимости возможен прием до 3 таблеток с интервалом в 5 мин).
Болевой синдром купируется внутривенным введением нитроглицерина 5—10 мкг/мин с увеличением каждые 15 мин на 5—10 мкг/мин до исчезновения боли. Через 24 ч осуществляется перевод на пероральные нитраты — изосорбид мононитрата или изосорбид динитрата.
Обязательно назначают антикоагулянты — низкомолекулярные гепарины (эноксапарин, фраксипарин) в течение 1—72 сут в первоначальной дозе 80 мг/кг (5000—7000 ЕД) внутривенно, а затем капельно по 18 мг/кг (до 1500 ЕД) с последующим переводом на подкожное введение. Лечение гепарином проводят под контролем активированного частичного тромбо-пластинового времени (АЧТВ), которое на фоне лечения должно быть 45—70 с. При отсутствии низкомолекулярных гепаринов вводят нефракционированные гепарины: внутривенно болюс 60—80 мг/кг (но не более 5000 ЕД), затем инфузия 12—18 мг/кг в течение 48 ч.
С самого начала назначают b-адреноблокаторы, снижающие потребность миокарда в кислороде, вначале короткодействующие (пропранолол в дозе до 40—60 мг), а затем быстро переводят на пролонгированные препараты (метопролол, бисопролол) в различной дозе с расчетом снижения ЧСС до 55—60 в минуту. В случае непереносимости и р-адреноблокаторов назначают недигидропиридиновые антагонисты кальция (верапамил или дилтиазем).
При стабилизации состояния и ликвидации болевого синдрома проводят стратификацию риска (см. выше).
При низком риске развития ОИМ, смерти и отсутствии динамики на ЭКГ и повышения сердечных тропонинов введение гепарина прекращают. Больной продолжает принимать аспирин, р-адреноблокаторы (или недигидропиридиновые антагонисты кальция), нитраты. Дальнейшая тактика определяется течением стенокардии.
При высоком риске развития ОИМ и смерти возможна стабилизация состояния, тогда продолжают лечение теми же препаратами. В случае высокого риска к лечению добавляют мощные антиагреганты (блокаторы гликопротеиновых IIb/IIIа рецепторов тромбоцитов — абциксимаб, эптифибатид, тирофибан) с последующим проведением коронароангиографии и при наличии стеноза коронарных артерий — аортокоронарное шунтирование или чрескожную балонную ангиопластику с установлением коронарного стента.
Прогноз. Определяется тяжестью коронарной недостаточности, наличием факторов риска и дальнейшей эволюцией нестабильной стенокардии.
Профилактика. Устраняют факторы риска (запрещение курения, сбалансированная диета). Прием р-адреноблокаторов (и других антиангинальных препаратов) в сочетании с антигиперлипидемическими препаратами (статинами) является вторичной профилактикой развития ОИМ у этой категории больных.
13. Инфаркт миокарда. Эпидемиология. Патогенез. Клинические формы. Дифференциальная диагностика.
14. Клинические варианты дебюта инфаркта миокарда. Патогенез основных клинических синдромов. ЭКГ-критерии острого инфаркта миокарда.
15. Острый инфаркт миокарда. Лабораторная и инструментальная диагностика.
16. Принципы лечения неосложненного острого инфаркта миокарда.
17. Поздние осложнения инфаркта миокарда. Клиническая симптоматика и методы диагностики.
18. Лечение ранних осложнений инфаркта миокарда (острая левожелудочковая недостаточность, кардиогенный шок).
19. Кардиогенный шок. Классификация. Клиника. Диагностика. Критерии степени тяжести. Оказание неотложной помощи.
Инфаркт миокарда + лекция ОИМ+ методичка ОКС стр 107- 131 +
Инфаркт миокарда
Инфаркт миокарда (ИМ) — острое заболевание, обусловленное возникновением одного или нескольких очагов ишемического некроза в сердечной мышце в связи с абсолютной или относительной недостаточностью коронарного кровотока.
У мужчин ИМ встречается чаще, чем у женщин, особенно в молодых возрастных группах. В группе больных в возрасте от 21 года до 50 лет это соотношение составляет 5:1, а от 51 года до 60 лет — 2:1. В более поздние возрастные периоды эта разница исчезает за счет увеличения числа ИМ у женщин. В последнее время значительно увеличилась заболеваемость ИМ лиц молодого возраста (мужчин до 40 лет).
- Ежегодно в России насчитывается около 1 500 000 пациентов, перенесших инфаркт миокарда, в т.ч. в Ростовской области более 3700 чел
- 13% всех смертей в мире вследствие инфаркта миокарда
Острейший период
1. Боль – отличия от стенокардии:
- Необычно интенсивная («морфинные» боли)
- Длительность > 30-60 мин
- Не купируется НЦ
2. Отдышка
3. Аритмии
4. Острая сосудистая недостаточность
Варианты острейшего периода ИМ:
1. ангинозный вариант (80%)
2. абдоминальный вариант
3. астматический вариант
4. аритмический вариант
5. церебральный вариант
6. малосимптомный вариант и др.
Острая боль в груди
1. Стенокардия
2. Кардиалгия
а) Коронарогенная
б) Некоронарогенная
- СМП
- Интенсивная терапия
- Обострение хронической боли
Периодика инфаркта миокарда
| Развивающийся ИМ | от 0 до 6 часов |
| ОИМ | от 6 часов до 7 суток |
| Заживающий (рубцующийся) ИМ | от 7 до 28 суток |
| Заживший ИМ | начиная с 29 суток |
Терапевтическое окно 4 часа
Объективные данные:(признаки ЛЖ-недостаточности)
- Выраженный цианоз
- Положение ортопноэ
- Влажные мелкопузырчатые хрипы в нижних отделах легких
- Увеличение ЧДД
- Тахи- или брадикардия
- Снижение АД
Аускультация
- Ослабление 1 тона
- Ослабление 2 тона или акцент 2 тона на аорте
- Протодиастолический ритм галопа
- Шум трения перикарда (на 2-4 сутки ИМ)
- Систолический шум в сочетании с ослаблением 1 тона
Ú Изменения ЭКГ: патологический зубец Q (шире 0,03 сек, глубже ¼ R), уменьшение или полное исчезновение зубца R, смещение ST выше изолинии на 2 и более мм.
Передне-перегородочный ( V 1- V 4)
Нижний ( II , III , AVF )
Боковой ( AVL , I , V 5- V 6)
Задний ( V1-V2 )

Поздние осложнения
Хроническая аневризма Хроническая аневризма образуется в месте сформировавшегося через 6 — 8 недель после ишемического некроза рубца. В результате его растяжения формируется зона, не способная сокращаться и ухудшающая насосную работу сердца. Это закономерно ведет к прогрессирующей сердечной слабости.
Синдром Дресслера (постинфарктный синдром)
Плеврит При резорбции очагов некроза продукты распада миокардиоцитов выступают в роли аутоантигенов и запускают аутоиммунные процессы. В результате извращенной защитной реакции страдают синовиальные и серозные оболочки. Клинически между 2 и 6 неделями внезапно может подняться температура и отдельно или в сочетании разовьются: перикардит; плеврит; пневмонит; синовит; гломерулонефрит; васкулит; экзема или дерматит.
Ишемические осложнения Поскольку причина острого инфаркта миокарда никуда не делась, сохраняется постоянная угроза возобновления нарушения кровообращения в системе коронарных артерий. В этом случае возможны три варианта неблагоприятных событий:
1. Расширение некроза в зоне ответственности артерии, поражение которой привело к инфаркту. Процесс может распространяться на все слои стенки сердца (трансмуральный инфаркт) или на участки рядом.
2. Постинфарктная стенокардия. Диагностируется при соответствующей симптоматике, если до инфаркта ее не было. Встречается более чем у четверти больных, а после тромболизиса — у более половины больных. Утяжеляет прогноз, повышает опасность внезапной смерти.
3. Повторный инфаркт миокарда. Может быть как на месте предыдущего, так и в зоне ответственности других коронарных артерий. Велика вероятность крупноочагового инфаркта. Если прошло не более 4 недель от предыдущего инфаркта, то называется рецидивирующим, а свыше — уже повторный.
Кардиосклероз постинфарктный Характерным осложнением острого инфаркт миокарда является развитие очагового постинфарктного кардиосклероза. Соединительнотканный рубец за 2 — 4 месяца занимает место погибшей сердечной мышцы. Чем обширнее участки рубцовой ткани, тем хуже сократительная способность, проводимость и возбудимость миокарда. Со временем прогрессирует сердечная слабость.
Лечение осложнений инфаркта миокарда В лечение осложнений, нарушающих ритмичность сокращений сердца, используются медикаменты с противоаритмическим действием. Применяются электроимпульсная терапия и электрокардиостимуляция, позволяющие значительно снизить смертность от аритмий. Фибрилляция и асистолия требуют проведения сердечно-легочной реанимации.
Помощь при острой сердечной недостаточности и кардиогенном шоке полагает назначение препаратов, снижающих периферическое сопротивление и повышающих сократительную способность миокарда. Изменения гемодинамики должны постоянно корригироваться. Если терапия неэффективна, то через 1 — 2 часа необходимо применить внутриаортальную баллонную контрпульсацию (метод вспомогательного кровообращения).
Внутриаортальная баллонная контрпульсация Улучшают результаты лечения осложнений инфаркта миокарда и кардиогенного шока методы восстановления кровотока в коронарной артерии, ответственной за ишемию. Это могут быть тромболитическая терапия или малоинвазивная внутрисосудистая ангиопластика. Смертность после оперативного лечения разрывов сердца высока. Но без него она достигает практически 100%. Поэтому лечение этого вида осложнений инфаркта миокарда только хирургическое. Для стабилизации состояния перед вмешательством также используется внутриаортальная баллонная контрпульсация.
Лечение синдрома Дресслера заключается в терапии стероидными гормонами, антигистаминными и противовоспалительными препаратами. Улучшение состояния должно сопровождаться отказом от гормонов, чтобы избежать опасности истончения и разрыва рубца. Если образовался выпот в плевральной или других полостях, отменяются противосвертывающие препараты.
Ишемические осложнения лечатся также, как классические стенокардия или инфаркт. Если проводилась тромболитическая терапия стрептокиназой, то из-за возможных аллергических реакций ее применение в течение 6 месяцев противопоказано.
При парезах желудка и кишечника следует отменить наркотические анальгетики, назначить голод, а при застое провести эвакуацию желудочного содержимого. Затем проводится фармакологическая стимуляция.
Аневризмы сердца, сопровождающиеся прогрессирующей сердечной недостаточностью, опасными нарушениями ритма подлежат хирургическому лечению.
Диагностика
Общепринятыми критериями для диагностирования кардиогенного шока становятся такие показатели:
Снижение систолического давления до 80-90 мм. рт. ст.
Снижение пульсового (диастолического давления) до 20-25 мм. рт. ст. и ниже.
Резкое сокращение количества мочи (олигурия или анурия).
Спутанность сознания, возбуждение или обморок.
Периферические признаки: бледность, цианоз, мраморность, похолодание конечностей, нитевидный пульс на лучевых артериях, спавшиеся вены на нижних конечностях.
При необходимости выполнения хирургически операции для устранения причин кардиогенного шока проводят:
ЭКГ;
Эхо-КГ;
ангиографию.
При лечении кардиогенного шока (острой сердечной недостаточности) применяют:
1) допамин, улучшающий насосную функцию сердца за счет влияния на контрактильный статус уцелевшего миокарда. Допамин вводят внутривенно капельно со скоростью 0,1—1,5 мкг/мин. Препарат не вызывает снижения общего периферического сопротивления (ОПС), но может уменьшать тонус коронарных, мозговых и печеночных артерий, повышая его в то же время в сосудах скелетных мышц;
2) оксигенотерапию;
3) петлевые диуретики (внутривенно лазикс);
4) морфин;
5) нитроглицерин внутривенно;
6) кортикостероиды внутривенно;
7) декстран внутривенно.
Методы, применяемые с целью коррекции кислотно-основного состояния (внутривенное введение гидрокарбоната натрия), так же как и направленные на улучшение реологических свойств крови и микроциркуляции (тромболитическая, антикоагулянтная, антиагрегантная терапия, оксигено-терапия), занимают важное место в терапии шока. Однако они влияют на вторичные механизмы патогенеза и не могут ликвидировать шок до тех пор, пока не решена основная задача — восстановление насосной функции сердца.
Патогенетически обоснованным методом лечения истинного кардиогенного шока (по классификации Killip IV) является контрпульсация. Контрпульсация — один из методов вспомогательного кровообращения, суть которого заключается в том, что в период систолы уменьшается давление в аорте и снижается сопротивление выбросу крови из желудочка (одповременно снижается и потребность миокарда в кислороде). В период диастолы, когда коронарный кровоток максимален, давление в аорте резко увеличивается за счет работы аппарата, который синхронизирован с работой сердца. С помощью такого метода удается значительно улучшить гемодинамику у многих больных шоком.
Лечение при кардиогенном шоке проводят также с учетом гемодинамических параметров. Несмотря на то что истинное представление о них можно получить, лишь определяя сердечный индекс (СИ), конечное диастолическое давление (КДД) и давление заклинивания в легочной артерии (эти исследования проводятся только в специализированных стационарах), существуют клинические симптомы, косвенно отражающие состояние гемодинамики.
а) Гиповолемический вариант кардиогенного шока (встречается редко):
резкое снижение АД, серый цианоз, тахикардия, СИ менее 2,2 л/(мин-м2),
диастолическое давление в легочной артерии снижено (менее 10 мм рт. ст.).
Основные лечебные мероприятия: внутривенное капельное введение реополиглюкина со скоростью не менее 20 мл/мин в сочетании с допамином (50 мг в 400 мл 0,5 % раствора глюкозы с частотой 15 капель в минуту). Введение глюкозы и реополиглюкина способствует увеличению давления наполнения левого желудочка и росту сердечного выброса, что приводит к нормализации АД и исчезновению периферических симптомов шока.
б) Гиподинамический вариант кардиогенного шока: клинически проявляется сочетанием кардиогенного шока и отека легких, сопровождающимся выраженной одышкой и влажными хрипами; диастолическое давление в легочной артерии более 25 мм рт. ст., СИ снижен.
Основные лечебные мероприятия: внутривенное капельное введение 1 % раствора нитроглицерина или другого периферического вазодилатато-ра — нитропруссида натрия по 50 мг в 500 мл 5 % раствора глюкозы [0,5—1 мкг/(кгмин)] и 90 мг фуросемида; при отсутствии эффекта показано дополнительное внутривенное капельное введение допамина — 50 мг в 400 мл 5 % раствора глюкозы с частотой 15 капель в минуту.
в) Застойный вариант кардиогенного шока: конечное диастолическое
давление и давление заклинивания в легочной артерии существенно повышены, но СИ не изменен; в этой ситуации показано введение фуросемида и внутривенное капельное введение 1 % раствора нитроглицерина (периферический венозный дилататор, способствующий уменьшению притока
крови к сердцу и снижению повышенного давления в малом круге кровообращения).
Классиффикация:
РА серопозитивный
РА серонегативный
Особые клинические формы РА:
Синдром Фелти
Болезнь Стилла, разившаяся у взрослых
РА вероятный
Клинические стадии ревматоидного артрита:
- Очень ранняя стадия: длительность болезни <6 месяцев;
- Ранняя стадия: длительность болезни 6 месяцев – 1 год;
- Развернутая стадия: длительность болезни> 1 года при наличии типичной симптоматики РА;
- Поздняя стадия: длительность болезни 2 года и более в сочетании с выраженной деструкцией мелких (III-IV рентгенологическая стадия) и крупных суставов.
Схема 25. ПАТОГЕНЕЗ ПОДАГРЫ
в мозговом, реже в корковом, веществе почки. Эти отложения носят очаговый характер, располагаются в межуточной ткани. Вокруг них развивается воспалительная реакция. Клубочки поражаются редко (утолщение стенок капилляров, клеточная пролиферация, гиалиновые отложения и склероз клубочков).
• Поражение периферических тканей (отложение уратов, формирующих специфические для подагры подагрические узлы). Подагра может достаточно часто сочетаться с другими заболеваниями обмена веществ: сахарным диабетом, нарушением жирового обмена, атеросклерозом и гипертонической болезнью.
Подагра диагностируется у мужчин 30—50 лет (98 % всех больных); женщины заболевают лишь в климактерическом периоде.
На I этапе диагностического поиска можно получить информацию о начале заболевания, характерных признаках острого подагрического артрита и дальнейшем вовлечении суставов в патологический процесс, о наличии и выраженности почечного синдрома.
Подагра проявляется чаще всего в виде атаки острого подагрического артрита, часто развивающегося среди полного здоровья у мужчин старше 30 лет. Провоцирующими факторами приступа могут быть переохлаждение, легкая травма, длительная ходьба, злоупотребление алкоголем или обильной мясной жирной пищей, интеркуррентные инфекции. Приступ начинается внезапно, чаще ночью, проявляется резчайшими болями в плюснефаланговом суставе большого пальца стопы, реже в других суставах стопы (голеностопном, коленном, крайне редко — в лучезапястном, локтевом). Резчайшие боли отмечаются в покое, усиливающиеся при опускании конечности. Возможно повышение температуры тела до 38—39 "С «на высоте» болей. Сустав опухает, становится синевато-багровым. Приступ длится 3—10 дней, затем боли полностью исчезают, функция сустава восстанавливается, внешне сустав приобретает нормальную форму. С течением времени отмечается укорочение межприступных периодов и увеличение продолжительности суставных болей. В патологический процесс вовлекаются и другие суставы. С годами больные отмечают деформацию суставов, ограничение подвижности (поражаются преимущественно суставы нижних конечностей). При вовлечении в патологический процесс почек (развитие мочекаменной болезни) наблюдаются приступы почечной колики со всеми характерными признаками, отхождение камней.
На II этапе диагностического поиска во время приступа острого подагрического артрита выявляются характерные его признаки: припухлость сустава, резкая болезненность при пальпации, изменение цвета кожи над суставом. В межприступный период все патологические изменения исчезают.
Со временем нарастают стойкие изменения в суставах конечностей, возникают признаки хронического полиартрита (чаще поражаются суставы ног): дефигурация сустава, ограничение подвижности, деформация суставов за счет узелковых отложений, костных разрастаний, появляются подвывихи пальцев, контрактуры, грубый хруст в суставах (коленных и голеностопных). Больные утрачивают трудоспособность и с трудом могут передвигаться.
При длительности заболевания более 3—5 лет появляются тофу-сы — специфичные для подагры узелки, представляющие собой отложения уратов, окруженные соединительной тканью. Они локализуются преимущественно на ушных раковинах, локтях, реже на пальцах кистей и стоп. Тофусы иногда размягчаются, самопроизвольно вскрываются с образованием свищей, через которые выделяется беловатая масса (кристаллы мочекислого натрия). Свищи инфицируются редко. При развитии «подагрической почки» появляется АГ. Подагра предрасполагает к развитию нарушений жирового обмена, атеросклероза, способствует прогрессированию гипертонической болезни, других заболеваний сердечно-сосудистой системы (ИБС). Все это следует помнить при обследовании больных, страдающих подагрой.
На III этапе диагностического поиска можно: 1) подтвердить характерное поражение суставов; 2) выявить поражение почек; 3) детализировать степень нарушений пуринового обмена.
При рентгенологическом исследовании пораженных суставов обнаруживают изменения, которые развиваются в случаях тяжелого течения, большой длительности болезни при дебюте артрита в молодом возрасте. Наиболее значительные изменения следующие:
1) круглые «штампованные» дефекты эпифизов костей, окруженные склеротической каймой;
2) кистевидные дефекты, разрушающие кортикальный слой кости;
3) утолщение и расширение тени мягких тканей в связи с отложением в них уратов.
Поражение почек («подагрическая почка») проявляется протеинурией, цилиндрурией, обычно нерезко выраженной. В случае развития мочекаменной болезни при умеренной протеинурии наблюдаются гематурия и большое количество кристаллов мочевой кислоты в осадке. После приступа почечной колики гематурия усиливается.
Почечная недостаточность при поражении почек развивается редко. Выражением ее служат повышение в крови содержания мочевины, креати-нина, резкое снижение фильтрации, относительная плотность мочи ниже 1015.
Нарушение пуринового обмена проявляется гиперурикемией (0,24— 0,5 ммоль/л, или 4—8,5 мг/100 мл).
Во время приступа подагрического артрита отмечают появление острофазовых показателей (нейтрофильный лейкоцитоз, увеличение СОЭ, повышение содержания фибриногена, а2-глобулина, появление СРВ), исчезающих после купирования приступа.
Диагностика. Распознавание болезни основывается на выявлении характерных приступов суставных болей, подагрических тофусов, гиперурикемии, выявлении кристаллов солей мочевой кислоты в синовиальной жидкости, характерных рентгенологических данных.
Наиболее распространены так называемые римские критерии диагноза подагры. Они включают:
1) гиперурикемию — содержание мочевой кислоты в крови более 0,42 ммоль/л (7 мг%) у мужчин и более 0,36 ммоль/л (6 мг%) у женщин;
2) наличие подагрических узелков (тофусов);
3) обнаружение кристаллов уратов в синовиальной жидкости или тканях;
4) наличие в анамнезе острого артрита, сопровождающегося сильной болью, начавшегося внезапно и стихнувшего за 1—2 дня. В соответствии с этими критериями диагноз подагры считается достоверным, если выявляются по крайней мере два любых признака.
Лечение. Назначают комплексное лечение, направленное на: 1) нормализацию пуринового обмена; 2) купирование острого приступа подагрического артрита; 3) восстановление функции пораженных суставов (лечение хронического полиартрита).
• Нормализация пуринового обмена осуществляется с помощью системы мероприятий: а) нормализация питания; б) ликвидация факторов, способствующих гиперурикемии; в) длительный прием лекарственных препаратов, способствующих снижению синтеза мочевой кислоты в организме и повышенному выделению ее почками. Тучным больным необходимо похудеть, так как ожирение закономерно сочетается с увеличением продукции уратов и одновременным снижением их выделения почками.
Запрещается употреблять алкоголь, который при частом приеме вызывает гиперурикемию. Полагают, что молочная кислота, являющаяся конечным продуктом метаболизма этилового спирта, замедляет выделение уратов почками.
Необходимо ограничить употребление продуктов, богатых пуринами (мясо, рыба, печень, почки, бобовые), принимать достаточное количество жидкости (более 1500 мл/сут), так как выделение мочи в меньшем количестве (менее 1 мл/мин — 1400 мл/сут) приводит к уменьшению выведения уратов.
Почти у 40 % больных подагрой отмечается АГ. Поэтому следует помнить, что применение тиазидовых мочегонных (для нормализации АД) у больных подагрой способствует повышению содержания в крови мочевой кислоты. Не следует назначать ацетилсалициловую кислоту, так как при этом нарастает содержание мочевой кислоты в крови и может быть спровоцирован приступ подагрического артрита.
В ряде случаев указанных мероприятий бывает достаточно для профилактики приступов артрита и снижения степени урикемии. Однако некоторым больным приходится назначать лекарственные препараты, нормализующие пуриновый обмен во избежание развития АГ и нарушения функции почек, а также мочекаменной болезни. Кроме того, нелеченая подагра способствует развитию атеросклероза.
При решении вопроса о выборе препарата для длительной антиподагрической терапии необходимо учитывать механизмы, обусловливающие повышение уровня мочевой кислоты в крови. При гиперпродукции пуринов следует назначать антагонисты синтеза пуринов, при уменьшении их выделения — урикозурические препараты. Больным с нормальным выделением пуринов рекомендуют препараты двойного механизма действия.
• Урикозурическим средством является сульфинпиразон (антуран). Увеличение выделения мочевой кислоты достигается за счет подавления ее реабсорбции в почечных канальцах. Начальная доза составляет 50 мг 3 раза в сутки. Дозу постепенно увеличивают (обычно до 200—400 мг/сут) до нор-мализации уровня уратов в сыворотке крови. При лечении антураном больному следует принимать много жидкости (2—3 л/сут) для уменьшения риска образования почечных камней. Побочные явления — тошнота, рвота, кожные аллергические реакции, лейкопения. Препарат противопоказан при язвенной болезни желудка и двенадцатиперстной кишки. Антуран нельзя назначать при гиперпродукции уратов, снижении клубочковой фильтрации, подагрической нефропатии и мочекаменной болезни.
• Среди средств, уменьшающих синтез пуринов, наилучшим является
аллопуринол. Его назначают в стартовой дозе 100 мг/сут с постепенным
увеличением дозы до 300 мг/день. Если клубочковая фильтрация снижена
до 30—60 мл/мин, доза аллопуринола не должна превышать 100 мг/сут, а
при клубочковой фильтрации 60—90 мл/мин — не более 200 мг/сут.
Лечение аллопуринолом показано при: выраженной гиперпродукции уратов (особенно у больных с содержанием мочевой кислоты более 0,6 ммоль/л); наличии подагрических узелков; подагре, сопровождающейся почечной недостаточностью; вторичной подагре с избыточным образованием мочевой кислоты (у больных лейкозами, множественной миело-мой, эритремией); больным, страдающим образованием уратных камней; при острой нефропатии, вызванной отложениями мочевой кислоты в результате лечения новообразований цитостатическими средствами.
При длительном лечении аллопуринолом возможны обратное развитие уратных отложений в тканях и улучшение функции почек.
Аллопуринол хорошо переносится, но у ряда больных могут возникать высыпания на коже и симптомы раздражения пищеварительного тракта.
Указанные препараты назначают лишь после полного купирования острого подагрического артрита, так как применение их на фоне затихающего подагрического воспаления суставов может вызвать серьезное обострение артрита. При первичной подагре аллопуринол следует принимать пожизненно, при вторичной — в зависимости от устранения конкретной провоцирующей ситуации. Перерывы в лечении ведут к рецидиву заболевания.
• Острый приступ подагрического артрита купируют назначением
колхицина, который принимают по 0,5 мг каждый час до стихания проявлений артрита (или до появления побочных эффектов — рвота, понос), но не более 6—8 мг/сут. Препарат принимают в течение суток, не более.
НПВП применяют обычно в больших дозах, чаще всего используют индометацин: первая разовая доза составляет 75 мг, после чего препарат назначают по 50 мг каждые 6 ч до купирования приступа. Эффективен диклофенак натрий (вольтарен): в первые сутки 200 мг, в последующие — по 150 мг. Другие НПВП менее эффективны.
Приступ подагрического артрита может начаться внезапно, без каких-либо предвестников, поэтому больной всегда должен иметь достаточное количество препарата, купирующего боли. Эффективность терапии тем выше, чем раньше начинают лечение.
• ГКС для купирования приступа обычно не используют; лишь при особенно нестерпимых болях возможно внутрисуставное введение (в крупные суставы 10—40 мг, в мелкие суставы 5—20 мг депомедрола, метипреда, дипроспана, кеналога).
• Восстановление функции пораженных суставов при хроническом течении подагрического артрита достигается с помощью лечебной физкультуры и санаторно-курортного лечения. На курорте больные принимают радиоактивные или сульфидные ванны, а также грязелечение (аппликации на пораженные суставы); в процессе бальнеотерапии возможно обострение артрита, в связи с чем в течение первых 8—10 дней рекомендуется принимать НПВП, купировавшие ранее острый приступ артрита (индометацин,
Профилактика. Первичная профилактика подагры заключается прежде всего в нормализации питания и отказе от употребления алкоголя, осообенно при наследственной предрасположенности к этой болезни.
37. Пневмония. Определение. Этиология, патогенез, клинико-морфологическая характеристика пневмоний.
38.Основные клинические синдромы пневмоний, варианты течения (остротекущая, затяжная). Диагностические критерии пневмонии.
39.Принципы антибактериальной терапии пневмоний и выбор антибиотика в зависимости от предполагаемой этиологии пневмонии. Симптоматическая терапия пневмонии.
40. Исходы пневмонии. Критерии прекращения антибактериальной терапии, прогноз. Диспансеризация. Первичная и вторичная профилактика.
кафедральная методичка стр 5-24 + лекция +
ПНЕВМОНИЯ - острое инфекционное заболевание, преимущественно бактериальной этиологии, характеризующееся очаговым поражением респираторных отделов легких, наличием внутриальвеолярной экссудации, выявляемой при физикальном и/или инструментальном исследовании, выраженными в различной степени лихорадочной реакцией и интоксикацией.
Классификация пневмоний (1996г.)
Внебольничные (приобретенные вне лечебного учреждения) пневмонии:
1) у лиц до 60 лет;
2) у лиц старше 60 лет на фоне сопутствующей патологии (хронические
заболевания бронхо-легочной системы, ИБС, сахарный диабет и др)
Внутрибольничные (госпитальные,нозокомиальные) пневмонии -
приобретенные в лечебном учреждении.
Аспирационные пневмонии.
Пневмонии у лиц с иммунодефицитом (врожденным или приобретенным)
Классификация, учитывающая условия, в которых развилось заболевание, важна для эмпирического подхода к стартовой терапии.
КЛАССИФИКАЦИЯ ПНЕВМОНИЙ
➢ По этиологии (в зависимости от возбудителя): пневмококковая,стафилококковая и др.
➢ По клинико-морфологическим признакам: паренхиматозная (долевая), очаговая (дольковая), интерстициальная.
➢ По локализации: правое легкое, левое легкое, двусторонне поражение.
➢ По степени тяжести: легкая, средняя, тяжелая.
Патогенетические механизмы, обуславливающие развитие пневмонии:
Аспирация секрета ротоглотки
Вдыхание аэрозоля, содержащего микроорганизмы
Гематогенное распространение микроорганизмов из внелегочного очага
инфекции (эндокардит трикуспидального клапана, септический тромбофлебит вен таза)
Непосредственное распространение инфекции из соседних пораженных тканей (например, абсцесс печени) или в результате инфицирования при проникающих ранениях грудной клетки.
Типичные возбудители внебольничных пневмоний:
Streptococcus pneumoniae – грамположительные кокки, самые частые возбудители пневмонии во всех возрастных группах ( 30% и более);
Haemophilus influenzae – грамотрицательные палочки, ответственные за развитие пневмонии у 8-25% взрослых, чаще у курильщиков и больных ХОБЛ;
Mycoplazma pneumoniae – мембранотропный патоген, вызывает внебольничную пневмонию в 20-30% случаев у лиц моложе 35 лет, у лиц старших возрастных групп в 1-9%;
Chlamydia pneumoniae – вызывает пневмонию в 2-8%;
Moraxella cataralis – грамотрицательные коккобациллы, вызывают пневмонию в 1-2
% у больных с ХОБЛ;
Klebsiella pneumoniae – возбудитель внебольничной пневмонии реже 5% случаев;
Staphylocjccus aureus – вызывает пневмонию реже 5%;
Микроорганизмы рода Legionella (Legionella pneumoniae) –возбудитель внебольничной пневмонии в 2-10%.
ГОСПИТАЛЬНЫЕ ПНЕВМОНИИ -
это пневмонии, развившиеся через 48 часов и позднее после госпитализации.
В структуре внутрибольничных инфекций пневмонии являются вторыми по частоте после инфекций мочевыводящих путей и характеризуются высокой смертностью – 30 50%.
Для прогнозирования вероятных возбудителей решающее значение имеют данные об эпидемиологической обстановке (превалирующей микрофлоре) в конкретном учреждении.
Типичные возбудители госпитальных пневмоний:
Грамположительные кокки:
Staphylococcus aureus – 12,9%
Грамотрицательные микроорганизмы:
Pseudomonas aeruginosa – 16,9%;
Klebsiella spp. – 11,6%;
Enterobacter spp. – 9,4%;
Escherichia coli – 6,4%.
Вентилятор-ассоциированые пневмонии (ВАП)
«Ранние» ВАП – продолжительность ИВЛ менее 5-7 дней.
«Поздние» ВАП – продолжительность ИВЛ более 5-7 дней. Обладают сложными механизмами устойчивости к антибактериальным препаратам, т.к. развиваются, как правило, на фоне длительной и интенсивной антибактериальной терапии.
АСПИРАЦИОННЫЕ ПНЕВМОНИИ
Могут быть как внебольничными, так и госпитальными;
Фактором риска является нарушение сферы сознания: психическая заторможенность,
энцефалопатия, травма, цереброваскулярные заболевания;
Чаще у мужчин 35-50 лет, нередко алкоголиков или наркоманов;
Этиология – участие анаэробов.
Характерно развитие деструкции легочной ткани (абсцесс, гангренозный абсцесс);
ВНЕБОЛЬНИЧНЫЕ ПНЕВМОНИИ
- ДОКСИЦИКЛИН
- ФТОРХИНОЛОНЫ с анти-пневмококковой активностью ЛЕВОФЛОКСАЦИН
- ФТОРХИНОЛОНЫ с анти-пневмококковой активностью ЛЕВОФЛОКСАЦИН
|
ГОСПИТАЛЬНЫЕ ПНЕВМОНИИ | ||
| 1. В отделе-ниях общего профиля без факторов риска и в ОИТР ранние ВАП | Парентеральные ЦЕФАЛОСПОРИНЫ III поколения : ЦЕФОТАКСИМ. ЦЕФТРИАКСОН | ФТОРХИНОЛОНЫ Антисинегнойные ЦЕФАЛОСПОРИНЫ III – IV ПОКОЛЕНИЯ : ЦЕФТАЗИДИМ ЦЕФЕПИМ +АМИНОГЛИКАЗИДЫ |
| 2. В ОИТР поздние ВАП, в отделениях общего профиля при наличии фактор риска | КАРБАПЕНЕМЫ (ИМИПЕНЕМ,) ЦЕФАЛОСПОРИНЫ III – IV поколения (ЦЕФТАЗИДИМ, ЦЕФЕПИМ) +АМИНОГЛИКАЗИДЫ | |
| Антисинегнойные ПЕНИЦИЛЛИНЫ (пиперациллин) + аминогликозиды | ||
| АЗТРИОНАМ ± аминогликозиды ФТОРХИНОЛОНЫ ГЛИКОПЕПТИДЫ | ||
|
Особенности нозологической формы | Препараты выбора | Комментарии | |
| 3. АСПИРАЦИОННЫЕ ПНЕВМОНИИ | |||
| АСПИРАЦИОННЫЕ ПНЕВМОНИИ | Базисная терапия определяется характером пневмонии (внебольничная или госпитальная) с включением в схему лечения антиаэробных препаратов: • Защищенные беталактамы • Цефамицины (цефотаксим, цефметазол) • Карбапенемы ( имипенем / циластатин) | Основное диагностическое значение имеет исследование гемокультуры на аэробы и анаэробы. Исследование материала из дыхательных путей на анаэробы не информативно. | |
+ Симптоматическая терапия при пневмонии. При непродуктивном сухом кашле назначают противокашлевые средства (кодеин, либексин, тусупрекс, глауцина гидрохлорид, стоптуссин, с(некод и пр.); при затрудненном отхождении мокроты - отхаркивающие (настой травы термопсиса, корень алтея и пр.) и муколитические препараты (мукалтин, лазолван, флуимуцил, халиксол). В случае плохой переносимости высокой температуры тела показаны жаропонижающие средства (анальгин, ацетилсалициловая кислота). Больным с сопутствующей патологией сердечно-сосудистой системы, особенно пожилым, а также при тяжелом течении Пневмонии ( Пн ) назначают инъекции камфоры, сульфокамфокаина, кордиамина, при сердечной недостаточности - сердечные гликозиды. Наличие одышки и цианоза служит показанием к проведению кислородной терапии. При выраженной интоксикации и деструкции легочного инфильтрата проводят дезинтоксикационную терапию (внутривенное введение реополиглюкина, гемодеза и других растворов). Больным с тяжелой формой Пневмонии ( Пн ) и выраженной интоксикацией, инфекционно-токсическим шоком показано внутривенное введение кортикостероидов. Небольшие дозы кортикостероидов (10-15 мг в день) внутрь назначают при вялом рассасывании инфильтрата или сопутствующем аллергическом бронхоспазме.
+Острая пневмония – инфекционно-воспалительное поражение респираторных отделов легких, протекающее с интоксикационным и бронхолегочным синдромом, характерными рентгенологическими изменениями. По характеру течения острую пневмонию разделяют на остротекущую (до 3 недель) и затяжную (до 2 месяцев), развивающуюся обычно на фоне снижения иммуно-биологической реактивности макроорганизма. Случаи острой пневмонии заметно учащаются в зимне-весенний период, особенно при резких колебаниях погоды, во время эпидемических вспышек респираторных инфекций.
+Для проявления Пневмонии ( Пн ) характерны основные синдромы:
o Интоксикационный (общая слабость, разбитость, головные и мышечные боли, одышка, сердцебиение, бледность, снижение аппетита).
o Синдром общих воспалительных изменений (чувство жара, озноб, повышение температуры тела, изменение острофазовых показателей крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличение СОЭ, уровня фибриногена, а2-глобулинов, появление С-реактивного белка).
o Синдром воспалительных изменений легочной ткани (появление кашля и мокроты, укорочение перкуторного звука), усиление голосового дрожания и бронхофонии, изменение частоты и характера дыхания, появление влажных хрипов, характерные рентгенологические изменения.
o Синдром вовлечения других органов и систем - сердечно-сосудистой системы, пищеварительного тракта, почек, нервной системы.
+ Прогноз. Исход Пн во многом зависит от распространенности воспалительного процесса, наличия или отсутствия осложнений, срока начала и адекватности антибиотикотерапии, состояния организма и других причин.
Пн легкого и среднетяжелого течения с нераспространенным воспалительным процессом заканчивается полным выздоровлением при проведении рациональной терапии в течение 3—4 нед.
Всех больных с распространенным воспалительным процессом, затяжным течением Пн, с нарушением функции внешнего дыхания, иммунной системы, осложненной Пн необходимо направлять в реабилитационные отделения для долечивания и восстановления как морфологических, так и функциональных показателей.
Период диспансеризации больных, перенесших Пн без осложнений, может составлять 6 мес, для всех остальных больных Пн — не менее года.
Профилактика. Профилактические мероприятия направлены на проведение общих санитарно-гигиенических мероприятий (режим труда, борьба с запыленностью, загазованностью, перегреванием и переохлаждением, проветривание помещений и изоляция заболевших и т.д.). Личная профилактика включает закаливание организма, занятия физкультурой и туризмом, полноценное питание, санацию очагов инфекции. Большое значение имеют своевременное и правильное лечение острых респираторных заболеваний и проведение других противоэпидемических мероприятий.
Особенно важна профилактика Пн у больных, страдающих хроническими легочными заболеваниями.Необходимо строгое соблюдение режима и других предписаний врача при заболеваниях, которые могут осложниться Пн (инфаркт миокарда, инсульт, состояние после хирургического вмешательства и т.д.).
+
Критериями выздоровления от пневмонии являются полное исчезновение физикальных и рентгенологических симптомов, нормализация температуры тела и общего состояния, исчезновение нарушений вентиляции. Больные, перенесшие обычную пневмонию, находятся под диспансерным наблюдением в течение 6 месяцев: первое обследование проводится через 1 месяц, второе - через 3, а третье - через 6 месяцев. Обследование включает клинический осмотр, общий анализ крови и мочи, биохимический анализ крови (С-реактивный белок, фибриноген, сиаловые кислоты). В случае необходимости при третьем посещении делается рентгенологическое обследование грудной клетки. При отсутствии патологии переболевший пневмонией снимается с учета и считается практически здоровым. Лица, перенесшие затяжную пневмонию, наблюдаются в течение 1 года: через 1, 3, 6 и 12 месяцев с полным клинико-лабораторным и рентгенологическим обследованием. По показаниям проводится консультация онколога и фтизиатра.
Исходы пневмонии следующие:
- выздоровление,
- затяжное течение,
- ограниченный пневмосклероз,
- постпневмонический хронический бронхит,
- легочное нагноение (абсцесс),
- постинфекционный синдром (выраженная слабость, субфебрилитет и др.).
Прогноз зависит от патогенеза пневмонии, типа возбудителя (например, смертность выше при клебсиелльной пневмонии, стафилококковой после гриппа и ниже - при атипичной пневмонии), наличия положительной культуры крови (это плохой прогностический признак, увеличивающий летальность в 3 раза), возраста больного (у пожилых смертность также выше), тяжести сопутствующих заболеваний, иммунной реактивности, имеющихся осложнений (абсцесс легких, эмпиема плевры). Врачу важно сразу выявить больных с тяжелым течением пневмонии, наличием ряда плохих прогностических признаков и тех, кто требует интенсивного лечения и наблюдения. Прогноз при пневмонии определяется взаимодействием всех этих факторов.
41.Бронхиальная астма. Определение, этиология и патогенез. Роль эндогенных, экзогенных, профессиональных факторов.
42.Особенности синдрома бронхиальной обструкции при бронхиальной астме (обратимость бронхиальной обструкции). Диагностические критерии бронхиальной астмы (значение исследования функции дыхания).
43.Классификация бронхиальной астмы. Степени тяжести течения, осложнения.
44.Принципы лечения бронхиальной астмы персистирующего течения. Профилактика. «Школа астматика».
45.Обострение (приступ) бронхиальной астмы, определение, диагностика и лечение.
кафедральная методичка стр 24-47 + лекция БА +
Бронхиальная астма – хроническое воспалительное заболевание дыхательных путей, в котором играют роль многие клетки и клеточные элементы.
Хроническое воспаление вызывает сопутствующее повышение гиперреактивности дыхательных путей, приводящее к повторяющимся эпизодам свистящих хрипов, одышки, чувства стеснения в груди и кашля, особенно ночью или ранним утром.
Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности бронхиальной обструкцией, которая является обратимой либо спонтанно, либо под влиянием лечения.
БА – хроническое персистирующее воспалительное заболевание дыхательных путей, сопровождающееся гиперреактивностью бронхов и их обратимой обструкцией, что клинически проявляется приступами удушья.
В определении БА подчеркивается не механизм – аллергия, а результат – воспаление. Аллергия не является универсальным механизмом патогенеза БА.
В отличии от ХОБЛ обструкция при БА обратима.
Этиология.
1. Генетическая предрасположенность к: атопии (т.е. повышенной готовности к выработке IgE-антител в ответ на антигенную стимуляцию) и гиперреактивности бронхов (бронхоконстрикция в ответ на неспецифические стимулы).
2. Врожденные «плохие легкие» - неполноценная система дыхания у новорожденного, которая сформировалась под влиянием неблагоприятных факторов в период беременности (например, курящая мать).
Врожденной предрасположенности недостаточно для развития БА, необходимо воздействие факторов окружающей среды и развитие воспалительного процесса в бронхах.
3. Инфекция.
4. Наличие неблагоприятных факторов внешней среды: пыльца растений, домашняя пыль, клещи, шерсть животных, споры грибов, вдыхание паров бензина и др. хим. веществ, активное и пассивное курение, экологически вредные примеси в атмосфере –SO2, NO2.
5. Пищевая аллергия
Неспецифические факторы (холод, физ. нагрузка, эмоции)
6. Лекарственные вещества (бета-блокаторы, ингибиторы ФДЭ).
Факторы риска развития астмы: генетический, табакокурение, профессиональный, бытовые поллютанты.
Патогенез.
Распространенно деление БА на 2 типа: экзогенный и эндогенный.
1. Экзогенная или аллергическая астма чаще отмечается у детей. Она иммунно опосредована и в ее возникновении важную роль играют атопия и аллергическая реакция 1-го или немедленного типа на экзогенный антиген.
2. Эндогенная астма чаще встречается у взрослых, доказательства значения аллергии в ее патогенезе отсутствует, предполагается участие нескольких механизмов.
Причины обострения БА
Обострение бронхиальной астмы может быть вызвано многими причинами:
- воздействием аллергенов
- пищевых
- домашних животных
- пыльцы растений
- химических веществ
- профессиональными вредностями
- респираторными инфекциями
- интенсивными физическими нагрузками
- сменой погоды (перепадом температур)
- табакокурением
- некорректным проведением базисной терапии
- быстрой отменой системных кортикостероидов
- неправильным проведением специфической гипосенсибилизации
- приемом некоторых лекарственных средств (нестероидные противовоспалительные препараты, бета-блокаторы) и т. д.
Степени тяжести обострения
Степень тяжести обострения бронхиальной астмы определяется на основании данных анамнеза, тяжести клинических проявлений, функциональных нарушений дыхания и кровообращения. На основании этих показателей выделяют 4 степени тяжести обострений:
- легкую,
- средней тяжести,
- тяжелую,
- угрозу остановки дыхания.
Классификация позволяет четко дифференцировать тяжесть обострения бронхиальной астмы от легкой степени до астматического состояния, назначить необходимый объем лечебной помощи и объективно ее контролировать.
Лечение
Легкие приступы удушья купируются применением ингаляционных селективных b2-агонистов (сальбутамол, фенотерол). Для усиления эффекта, особенно при наличии у больного надсадного непродуктивного кашля, могут быть использованы препараты группы холинолитиков (ипратропиум бромид по 0,25—0,5 мг).
Тяжелое обострение астмы
| Неконтролируемая астма | Тяжелое течение | Жизнеугрожающее обострение |
| 1. Оценка тяжести обострения | ||
| Речь не нарушена, ЧД <25 дых/мин, ПВС >50% от лучших показателей, пульс <110 уд/мин | Одышка при разговоре, ЧД >25 дых/мин, ПВС <50% от лучших показателей, пульс>110 уд/мин | Немое легкое, цианоз, ПСВ<33% от лучших показателей, брадикардия, нарушение сферы сознания |
| 2. Лечение | ||
| Возможно лечение на дому, 5 мг сальбутамола или фенотерола, либо 10 мг тербуталина через небулайзер. | Решить вопрос о госпитализации. Кислородотерапия. 5 мг сальбутамола или фенотерола, либо 10 мг тербуталина через небулайзер. Преднизалон 30-60 мг или гидрокортизон 200 мг в/в (до приезда скорой разжевать таблетированный преднизалон 30мг-6 таблеток) | Немедленная госпитализация в стационар. Преднизолон 30-60 мг или гидрокортизон 200 мг в/в. Кислородотерапия. Ингаляции через небулайзер бета-2-агонистов и ипратропиума бромида или тербуталин п/к или эуфиллин 250 мг в/в |
46.Хроническая обструктивная болезнь легких. Определение. Этиология, патогенез ХОБЛ. Значение факторов риска.
47.Основные клинические синдромы хронической обструктивной болезни легких.
48.Классификация хронической обструктивной болезни легких. Клиническая картина в зависимости от степени тяжести, группы риска А, В, С, Д.
49.Принципы лечения хронической обструктивной болезни легких стабильного течения. Первичная и вторичная профилактика ХОБЛ.
50. Лечение хронической обструктивной болезни легких в фазе обострения.
кафедральная методичка стр 47-69 + лекция ХОБЛ+
*ХОБЛ - первично хроническое воспалительное заболевание с преимущественным поражением дистальных отделов дыхательных путей, паренхимы легких и формированием эмфиземы.
Характеризуется ограничением воздушного потока с развитием необратимой бронхиальной обструкции, вызванной продуктивной неспецифической персистирующей воспалительной реакцией.
ХОБЛ развивается у предрасположенных лиц, имеет неуклонно прогрессирующий характер с исходом в хроническую ДН и ХЛС
+
ХРОНИЧЕСКАЯ ОБСТРУКТИВНАЯ БОЛЕЗНЬ ЛЕГКИХ (ХОБЛ) -
первично хроническое воспалительное заболевание легких с преимущественным поражением дистальных отделов дыхательных путей и паренхимы, формированием эмфиземы, нарушением бронхиальной проходимости с развитием не полностью обратимой или необратимой бронхиальной обструкции, вызванной патологической воспалительной реакцией. Болезнь развивается у предрасположенных лиц и проявляется кашлем, отделением мокроты и нарастающей одышкой, имеет неуклонно прогрессирующий характер с исходом в хроническую дыхательную недостаточность и легочное сердце.ХОБЛ относится к часто встречающимся заболеваниям.
Распространенность симптомов ХОБЛ в значительной степени зависит от курения, возраста,
профессии, состояния окружающей среды, страны или региона
Определение ХОБЛ
- Заболевание, которое можно предупредить и лечить, характеризующееся ограничением скорости воздушного потока, которое обратимо не полностью.
- Ограничение скорости воздушного потока обычно прогрессирует и связано с патологическим воспалительным ответом легких на патогенные частицы или газы, причем основной причиной является курение табака.
- Хотя ХОБЛ воздействует на легкие, она также приводит к значительным системным эффектам.
-Хроническое заболевание
- Воспаление не аллергической природы
-Причина воспаления – токсические частицы, газы
- Нет выраженной гиперреактивности
- Значительные системные эффекты (ЛГ, ЛС)
- Болезнь можно предупредить и лечить
Диагностические критерии ХОБЛ:
- Симптомы (жалобы пациента): кашель, мокрота, одышка
- История контакта с источником «заражения» (экспозиция поллютанта): табакокурение, профессиональные вредности, внешние и контактные поллютанты
ОСНОВНЫЕ КЛИНИЧЕСКИЕ СИМПТОМЫ ХОБЛ
 Одышка: прогрессирующая, персистирующая (ежедневная), усиливается при нагрузке и во время респираторных инфекций.
Одышка: прогрессирующая, персистирующая (ежедневная), усиливается при нагрузке и во время респираторных инфекций.
 Хронический кашель: отмечается каждый день или временами, обычно наблюдается в течение всего дня, реже только ночью.
Хронический кашель: отмечается каждый день или временами, обычно наблюдается в течение всего дня, реже только ночью.
 Хроническая продукция мокроты: чаще – слизистого характера (гнойного – при обострении).
Хроническая продукция мокроты: чаще – слизистого характера (гнойного – при обострении).
Внелегочные проявления ХОБЛ:
Ø Снижение веса
Ø Сонливость днем
Ø Бессоница ночью
Ø Утренняя головная больследствие гипоксии и гиперкапнии
Основными клиническими синдромами ХОБЛ являются бронхиальная обструкция, эмфизема легких, мукоцилиарная недостаточность и общая интоксикация. На поздних стадиях заболевания возникают признаки тяжелой легочной недостаточности и хронического легочного сердца.
Ведущим клиническим синдромом является синдром бронхиальной обструкции, характеризующийся малой вариабельностью в течение суток и лишь частичной обратимостью после пробы с b2-агонистами короткого действия. Из года в год с течением времени происходит неуклонное снижение показателей легочной вентиляции, увеличение степени бронхиальной обструкции. Основной жалобой у больных является одышка различной степени выраженности, как правило, экспираторного характера. На поздних стадиях заболевания, когда патологический процесс осложняется эмфиземой легких, пневмосклерозом и легочно-сердечной недостаточностью, одышка приобретает смешанный характер. Клинической особенностью одышки является ее относительно постоянный характер на протяжении суток в состоянии покоя и усиление после физических нагрузок, а также при плохих погодных условиях. Чем ниже порог физической нагрузки, вызывающей усиление одышки и ее непереносимость, тем значительнее ограничение жизнедеятельности пациента, ухудшение качества его жизни. На поздних стадиях заболевания происходит потеря трудоспособности, возникают признаки инвалидности.
Характерными клиническими симптомами мукоцилиарной недостаточности являются кашель и выделение мокроты. Кашель больше беспокоит по утрам. Иногда больные в течение дня так редко кашляют, что просто не замечают своего кашля. Мокроты обычно мало и выделяется она тяжело, больше по утрам после приступа длительного кашля. В период ремиссии мокрота обычно слизистого характера, очень вязкая.
Обострение болезни у абсолютного большинства больных возникает на фоне так называемой простуды. Большое значение имеет общее переохлаждение организма или наличие контакта с больным гриппом.
Интоксикационный синдром характеризуется появлением симптомов общего характера: повышением температуры тела (часто только до субфебрильных цифр), потливостью, слабостью, головной болью, снижением работоспособности. Жалобы (насморк, боль в горле, ухе) и патологические изменения со стороны верхних дыхательных путей могут иметь место при поражении их респираторной вирусной инфекцией.
Относительно редко у больных ХОБЛ возникает кровохарканье как проявление легочного геморрагического синдрома. Оно чаще бывает при атрофических изменениях слизистой оболочки бронхов и чаще — при деформирующем бронхите. Кровохарканье никогда не бывает длительным и не переходит в легочное кровотечение. Наличие кровохарканья всегда требует тщательного обследования больного для исключения рака или туберкулеза легких.
При признаках эмфиземы легких часто определяется бочковидная грудная клетка, втяжение нижних межреберных промежутков, участие в дыхании вспомогательной мускулатуры. Аускультативно на фоне коробочного перкуторного тона прослушиваются на симметричных участках грудной клетки резко ослабленное везикулярне дыхание, рассеянные свистящие и жужжащие сухие хрипы.
С течением времени в легких развиваются пневмосклеротические изменения, нарастают признаки эмфиземы легких. Усиливается легочная недостаточность, вначале по обструктивному, а затем по смешанному типу. Изменяется внешний вид больных и их поведение. Характерным признаком является значительная потеря мышечной массы тела вплоть до кахексии. На поздних стадиях заболевания возникают явления застойной сердечной недостаточности — усиливаются сердцебиение и надчревная пульсация правого желудочка сердца, появляется и усиливается цианоз, набухают подкожные вены шеи, особенно яремная, увеличивается печень, появляются периферические отеки.
Классификация стабильного течения ХОБЛ по уровню спирометрических показателей:
| Степень тяжести течения ХОБЛ | Функциональные признаки ХОБЛ |
| I степень | ОФВ1/ФЖЕЛ>80% от должного |
| II степень | 50%<ОФВ1/ФЖЕЛ<80% от должного |
| III степень | 30%<ОФВ1/ФЖЕЛ<50% от должного |
| IV степень | ОФВ1<30% от должного |
Критерии определения группы риска ХОБЛ
| Группа риска | Характеристика критериев |
| А | низкий риск (ОФВ1 =I или II степень тяжести, количество обострений за последние 12 мес. =0-1), меньше симптомов (mMRS =0-1 или CAT<10) |
| В | низкий риск (ОФВ1 =I или II степень тяжести, количество обострений за последние 12 мес. =0-1), больше симптомов (mMRS >2 или CAT>10) |
| С | высоки риск (ОФВ1 =III или IV степень тяжести, количество обострений за последние 12 мес. >2), меньше симптомов (mMRS =0-1 или CAT<10) |
| Д | высокий риск (ОФВ1 =III или IV степень тяжести, количество обострений за последние 12 мес. >2), больше симптомов (mMRS >2 или CAT>10) |
Рекомендации GOLD по лечению ХОБЛ
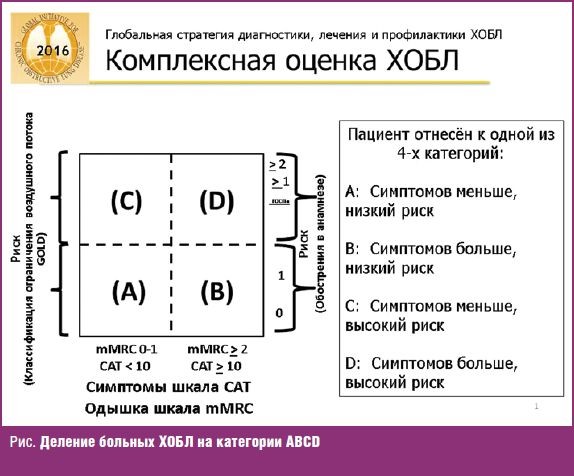
Оценка объективного статуса
 При осмотре: грудная клетка бочкообразной формы, ограничение экскурсии нижнего края легких, западение межреберных промежутков
При осмотре: грудная клетка бочкообразной формы, ограничение экскурсии нижнего края легких, западение межреберных промежутков
 При перкуссии грудной клетки : коробочный перкуторный звук.
При перкуссии грудной клетки : коробочный перкуторный звук.
 При аускультации: ослабленное везикулярное дыхание, сухие, (преимущественно свистящие) хрипы, усиливающиеся при форсированном выдохе, имитации кашля.
При аускультации: ослабленное везикулярное дыхание, сухие, (преимущественно свистящие) хрипы, усиливающиеся при форсированном выдохе, имитации кашля.
Легкая ( I стадия)
Ø Среднетяжелая ( II стадия)
Ø Тяжелая ( III стадия)
Ø Крайне тяжелая ( IV стадия)
Объединяющий признак стадий ХОБЛ - пост-бронходилататорное снижение
ОФВ1/ФЖЕЛ < 70%, характеризующее ограниче-ние экспираторного воздушного потока.
Разделяющий признак – значение постбронхолитического показателя ОФВ1.
ЛЕЧЕНИЕ ХОБЛ
Центральным звеном терапии ХОБЛ являются бронхолитические средства, назначаемые по потребности или регулярно, для профилактики или уменьшения симптомов (уровень А)
Организационные и лечебные мероприятия
Ø Обучение пациентов
Ø Бронходилатирующая (базисная) терапия
Ø Противовоспалительная терапия (ГКС)
Ø Мукорегуляторная терапия
Ø Противоинфекционная терапия
Ø Коррекция дыхательной недостаточности
Ø Реабилитационная терапия
Ø
Антигипертензивные препараты
Основные
- иАПФ
- блокаторы рецепторов АТ1 (БРА)
- Антагонисты кальция
- Тиазидные диуретики
- β-адреноблокаторы
Дополнительные (в составе комбинированной терапии)
- α-адреноблокаторы
- агонисты имидазолиновых рецепторов
- прямые ингибиторы ренина
Каптоприл (капотен) – короткодействующий ИАПФ, эффективен для купирования гипертонического криза (в течение 30 мин).
(1) ИАПФ или (2) БРА должны включаться в любую схему лечения АГ, так как не только снижают артериальное давление, но и максимально обеспечивают органопротекцию сердца, сосудов, почек и эф. лечение АЗ (снижение смертности).
(3) БКК (дигидропиридиновые пролонгированные вазодилататоры) – амлодипин, фенлодипин. Короткодействующие нифедипины не принимать для длительного лечения АГ – риск осложнений (коринфар). (а недигидропиридиновые БКК действуют на проводящую систему сердца)
Побочные эффекты от нифедипина: резкое увеличение ЧСС – провокация ишемии – стенокардия и др. (ИБС)
Для купирования ГК не используют нифедипин, если есть подозрение на наличие ишемии миокарда или тахикардии. Для купирования ГК: моксонидин (физиотенз) 0,2-0,4 мг и каптоприл (капотен).
(4) Тиазидные диуретики: гидрохлортиазид, индопамид, хлоитамидон
(5) β-адреноблокаторы: метопролол, бисопролол, атенолол
+ (7) α-адреноблокаторы: алфузозин, празозин, доксазозин, тамсулозин, теразозин
+ (8) агонисты имидазолиновых рецепторов: моксонидин (физиотенз), рилменидин (альборен)
(9) прямые ингибиторы ренина: алескирен
Для лечения АГ не назначать ИАПФ и(?) сартаны, так как нарушается функция почек(!)
ИАПФ/БРА + БАБ/диуретик/БКК
Дата: 2019-07-24, просмотров: 353.