ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ДЕТЕЙ
Введение
Врожденные пороки сердца (ВПС) являются одной из самых частых аномалий развития, встречаются с частотой 8-12 на 1000 живорожденных детей. Причины возникновения врождённых пороков сердца разнообразны. Наиболее уязвимый период – 3-9 недель беременности, это есть время, когда происходит закладка и формирование структур сердца. Большое значение имеют тератогенные факторы внешней среды, соматические заболевания матери и отца, инфекции, особенно вирусные (вирус краснухи, ЦМВ, ВПГ, вирус гриппа, энтеровирус, вирус Коксаки В и др.), а также алкоголизм родителей, приём наркотических веществ, курение матери, профессиональные вредности. Ассоциированы с врождёнными пороками сердца многие хромосомные заболевания (синдромы Дауна, Патау, Эдвардса, Шерешевского-Тернера и т.д.).
Классификация врожденных пороков сердца
Существует несколько классификаций врождённых пороков сердца. Создание единой классификации врождённых пороков сердца связано с определенными трудностями в связи с огромным количеством разновидностей пороков и принципов, которые могут быть положены в её основу.
Классификация, в которой врождённые пороки сердца распределены с учётом анатомических особенностей и гемодинамических нарушений удобна для использования в практической деятельности врача. В данной классификации все пороки разделяют на три группы:
1. врождённые пороки сердца бледного типа с артериовенозным шунтом, т.е. со сбросом крови слева направо: ДМЖП, ДМПП, ОАП.
2. врождённые пороки сердца синего типа с веноартериальным сбросом, т.е. со сбросом крови справа налево: полная транспозиция магистральных сосудов, тетрада Фалло.
3. врождённые пороки сердца без сброса, но с препятствием к выбросу крови из желудочков (стенозы лёгочной артерии, стеноз аорты, коарктация аорты).
Существуют еще врождённые пороки сердца, не входящие по своим гемодинамическим характеристикам ни в одну из трёх представленных групп. Это пороки без сброса крови и без стеноза: врождённая недостаточность клапанов сердца, аномалия развития трёхстворчатого клапана Эбштейна, корригированная транспозиция магистральных сосудов.
К наиболее часто встречающимся ВПС относят пороки «большой пятерки»: дефект межжелудочковой перегородки (ДМЖП), коарктацию аорты (КА), транспозицию магистральных артерий (ТМА), открытый артериальный проток (ОАП) и тетраду Фалло (ТФ).
Вестественном течении ВПС выделяют следующие фазы:
Фаза адаптации
Во внутриутробном периоде при большинстве ВПС не развивается декомпенсация. С рождением ребенка и первым вдохом начинает функционировать малый круг кровообращения с последующим постепенным закрытием фетальных коммуникаций: артериального протока, открытого овального окна и разобщение кругов кровообращения. В периоде адаптации происходит становление как общей, так и внутрисердечной гемодинамики. При неадекватной гемодинамике (резкое обеднение кровообращения в малом круге кровообращения (МКК), полное разобщение кругов кровообращения, выраженный застой в МКК) состояние ребенка прогрессивно и резко ухудшается, что заставляет проводить экстренные паллиативные вмешательства.
Фаза компенсации
Для этого периода характерно подключение большого количества компенсаторных механизмов с целью обеспечения существования организма в условиях нарушенной гемодинамики. Выделяют кардиальные и экстракардиальные компенсаторные механизмы. К кардиальным относится: увеличение активности ферментов цикла аэробного окисления (сукцинатдегидрогеназы), вступление в действие анаэробного обмена, закон Франка-Старлинга, гипертрофия кардиомиоцитов. К экстракардиальным механизмам компенсации относится активация симпатического звена ВНС, что приводит к увеличению числа сердечных сокращений и централизации кровообращения, а также повышение активности ренин-ангиотензин-альдостероновой системы. Вследствие активации последней повышение артериального давления сохраняет адекватное кровоснабжение жизненно важных органов, а задержка жидкости приводит к увеличению объёма циркулирующей крови. Задержке излишней жидкости в организме и формированию отеков противостоит предсердный натрийуретический фактор. Стимуляция эритропоэтина приводит к увеличению количества эритроцитов и гемоглобина и, таким образом, повышению кислородной ёмкости крови.
3. Фаза мнимого благополучия – это период, который обеспечивается компенсаторными возможностями организма. Именно 2 и 3 фазы течения ВПС – оптимальное время для проведения радикальных оперативных вмешательств.
Фаза декомпенсации
Для этого периода характерно истощение компенсаторных механизмов и развитие рефрактерной к лечению сердечной недостаточности, формирование необратимых изменений во внутренних органах.
Клинические проявления ВПС в основном представлены двумя синдромами: артериальной гипоксемии и застойной сердечной недостаточности.
Синдром артериальной гипоксемии может проявляться с рождения. В его генезе может участвовать целый ряд факторов, таких как асфиксия, респираторный дистресс-синдром, аспирация в родах, врожденная пневмония, ателектаз легкого, пневмоторакс, диафрагмальная грыжа, метгемоглобинемия, полицитемия, сепсис. Цианоз может иметь и центральное происхождение вследствие кровоизлияния в желудочки мозга. Снижается содержание кислорода и рН в капиллярной крови. В норме рО2 составляет 60-80 мм.рт.ст., а SO2 96-98%. Артериальная гипоксемия характеризуется снижением рО2 до 50 мм.рт.ст., а цианоз становится заметным при уровне насыщения гемоглобина менее 75-85%. У новорожденного с высоким уровнем фетального гемоглобина цианоз будет явным при относительно меньшей величине рО2. При длительной и резко выраженной гипоксемии в тканях включаются механизмы анаэробного гликолиза, происходит накопление кислых продуктов метаболизма и развивается метаболический ацидоз.
В формировании артериальной гипоксемии при ВПС могут играть роль три основных механизма: 1) внутрисердечный сброс крови справа налево и её поступление в аорту; 2) сниженный легочный кровоток и уменьшенный легочный возврат артериальной крови к сердцу; 3) разобщение большого и малого кругов кровообращения. При большинстве ВПС цианотического типа артериальная гипоксемия связана с первыми двумя механизмами. Для дифференциальной диагностики происхождения цианоза применяется тест с дыханием 100% кислородом. Оценку результатов теста проводят через 10-15 минут дыхания 100% кислородом. У больных с «сердечным» цианозом рО2 возрастает не более чем на 10-15 мм.рт.ст., так как величина концентрации О2 в легких практически не влияет на величину примеси венозной крови к артериальной на уровне внутрисердечных сообщений. При характеристике артериальной гипоксемии необходимо оценивать её уровень (рО2, SO 2), тяжесть (степень ацидоза), а также наличие вторичной дисфункции жизненно важных органов, что и будет определять комплекс лечебных мероприятий.
Сердечная недостаточность – это патологическое состояние, при котором сердце не способно обеспечить кровообращение, необходимое для обеспечения потребностей организма. Чаще всего развивается либо в связи с повышенной нагрузкой на сердце объёмом крови или давлением, либо вследствие снижения сократимости миокарда при гипоксии или воспалительном процессе в сердечной мышце. Основными симптомами сердечной недостаточности являются тахикардия, одышка, признаки застоя по малому или большому кругу кровообращения. У маленьких детей сердечная недостаточность почти всегда носит бивентрикулярный характер.
Для оценки степени сердечной недостаточности применяется классификация Василенко-Стражеско. В классификации сердечной недостаточности, разработанной А.С. Шарыкиным (2000 г.) и адаптированной к новорожденным детям, выделяется:
1 степень – умеренные тахикардия и одышка (до 120% от нормы) в покое или при небольшой физической нагрузке (кормление); печень выступает из-под края реберной дуги по средне-ключичной линии на +3 см. Размеры сердца могут быть не увеличены. С помощью медикаментозной терапии удается добиться компенсации показателей.
2 степень – нарастание тахикардии и одышки до 125-150% от нормы; печень выступает из-под края реберной дуги более чем +3 см. Возможны отёки на стопах и на лице, беспокойство, затрудненное кормление, периодически прослушиваются непостоянные застойные хрипы в легких. Рентгенологически и при ЭхоКГ – заметная дилатация полостей желудочков. Медикаментозная терапия позволяет уменьшить симптомы до уровня 1 степени.
3 степень – тахикардия и одышка достигают 160% и более, плотная увеличенная печень (более +3 см), периферические отёки и асцит; постоянные застойные хрипы в лёгких. Ребёнок вял, заторможен. Размеры сердца значительно увеличены. Стандартная медикаментозная терапия малоэффективна. Нередко требуется проведение ИВЛ для стабилизации состояния.
4 степень (кардиогенный шок) – артериальная гипотония, декомпенсированный ацидоз, периферический спазм (снижено наполнение капилляров кровью, бледность, холодные конечности), резкое угнетение ЦНС, олигурия. Возможна брадикардия.
Осложнения ВПС:
1. Сердечная недостаточность.
2. Бактериальный эндокардит (чаще отмечается при цианотических ВПС).
3. Ранние затяжные пневмонии на фоне застоя в малом круге кровообращения.
4. Высокая легочная гипертензия или синдром Эйзенменгера (характерна для ВПС с обогащением малого круга кровообращения).
5. Синкопэ вследствие синдрома малого выброса вплоть до развития нарушения мозгового кровообращения (по ишемическому типу - при цианотических ВПС и стенозе аорты; по геморрагическому типу – при коарктации аорты).
6. Стенокардитический синдром и инфаркты миокарда (наиболее характерны для стенозов аорты, аномального отхождения левой коронарной артерии).
7. Одышечно-цианотические приступы (встречаются при тетраде Фалло с инфундибулярным стенозом легочной артерии, транспозиции магистральных артерий и др.).
8. Релятивная анемия – при цианотических ВПС.
Рисунок 1. Высокий дефект межжелудочковой перегородки
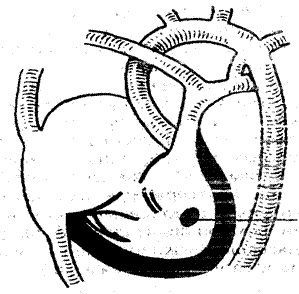
Рисунок 2. Низкий дефект межжелудочковой перегородки
Диаметр отверстия бывает от 1 до 30 мм. Дефекты могут быть единичными или множественными. Большинство из них имеют перимембранозную локализацию (до 80%). На долю мышечных ДМЖП приходится около 20%. Мелкие дефекты размером 1-2 мм, расположенные в мышечной части МЖП, называются болезнью Толочинова–Роже. Вследствие хорошей аускультативной картины и отсутствия гемодинамических нарушений для их характеристики уместно выражение: «много шума из ничего». Отдельно выделяют множественные большие дефекты МЖП, по типу «швейцарского сыра», имеющие неблагоприятное прогностическое значение. 60% больных кроме ДМЖП обычно имеют сопутствующие аномалии сердца: дефект межпредсердной перегородки, ОАП, коарктация аорты, стеноз лёгочного или аортального клапана, аортальная недостаточность.
Гемодинамика
Гемодинамические нарушения при ДМЖП начинают формироваться спустя некоторое время после рождения, как правило, на 3-5 сутки жизни. В раннем неонатальном периоде шум в сердце может отсутствовать вследствие одинакового давления в правом и левом желудочках из-за так называемой неонатальной легочной гипертензии. Постепенное падение давления в системе легочной артерии и в правом желудочке создаёт разность (градиент) давлений между желудочками, вследствие чего появляется сброс крови слева-направо. Дополнительный объём крови, поступающий в правый желудочек и легочную артерию, приводит к переполнению сосудов малого круга кровообращения, где развивается легочная гипертензия. В связи с повышенным возвратом крови в левые отделы развивается объёмная перегрузка левого предсердия и левого желудочка. Размеры сердца увеличиваются.
Клиническая симптоматика при ДМЖП заключается в симптомокомплексе сердечной недостаточности. Дефекты с большим сбросом слева направо обычно проявляются клинически с 4-8 недель жизни, сопровождаются задержкой роста и развития, повторными респираторными инфекциями, снижением толерантности к физической нагрузке, сердечной недостаточностью со всеми классическими симптомами (повышенная потливость, тахипноэ, застойные хрипы в лёгких, тахикардия, гепатомегалия, отёчный синдром). ДМЖП может манифестировать ранними и тяжелыми пневмониями.
Кожные покровы бледные с небольшим периферическим цианозом. При физикальном исследовании сердечно-сосудистой системы обнаруживают бистернальный килевидный сердечный «горб», образуемый счёт увеличения правого желудочка («грудь Дэвиса»). Верхушечный толчок разлитой, усиленный; определяется патологический сердечный толчок. Можно обнаружить систолическое дрожание в третьем-четвёртом межреберье слева, свидетельствующее о сбросе крови в правый желудочек. Границы относительной сердечной тупости расширены в обе стороны, особенно влево. В течение первых недель жизни шум может полностью отсутствовать в связи с высокой резистентностью лёгочных сосудов и отсутствием сброса крови через дефект. Характерный аускультативный признак порока – постепенное появление и нарастание скребущего систолического шума с максимальной точкой выслушивания в третьем-четвёртом межреберье слева от грудины. По мере развития большого сброса II тон на лёгочной артерии становится усиленным и расщеплённым.
При ДМЖП в мышечной части (болезнь Толочинова-Роже) жалобы, клинические проявления порока отсутствуют, за исключением скребущего систолического шума средней интенсивности, выслушиваемого в четвёртом-пятом межреберье слева от грудины. Лёгочная гипертензия не развивается, возможно спонтанное закрытие дефекта.
ЭКГ имеет свои закономерности, тесно связанные с фазой течения ВПС и степенью лёгочной гипертензии. Сначала выявляются признаки перегрузки левого желудочка – повышение его активности, затем развитие его гипертрофии. С течением времени присоединяются признаки перегрузки и гипертрофии правых отделов сердца – как предсердия, так и желудочка, - это свидетельствует о высокой лёгочной гипертензии. Электрическая ось сердца всегда отклонена вправо. Могут встречаться нарушения проводимости – от признаков неполной блокады правой ножки пучка Гиса до полной атрио-вентрикулярной блокады.
Рентгенография органов грудной клетки позволяет выявить гиперволемию малого круга кровообращения. Увеличение тени сердца связано, в основном, с левым желудочком и левым предсердием, в меньшей степени — с правым желудочком.
При Допплер-ЭхоКГ уточняется место расположения дефекта, его размер, определяется давление в правом желудочке и лёгочной артерии.
Лечение
Тактику лечения определяет гемодинамическая значимость порока и известный для него прогноз. Лечение данного порока подразумевает консервативную терапию сердечной недостаточности и хирургическую коррекцию порока сердца. Консервативное лечение складывается из препаратов инотропной поддержки (симпатомиметики, сердечные гликозиды), мочегонных препаратов, кардиотрофиков. В случаях высокой легочной гипертензии назначаются ингибиторы ангиотензинпревращающего фермента – капотен или каптоприл. Оперативные вмешательства подразделяются на паллиативные операции (в случае ДМЖП – операция суживания лёгочной артерии по Мюллеру) и радикальную коррекцию порока – пластика дефекта межжелудочковой перегородки в условиях искусственного кровообращения.
Осложнения
Осложнение дефекта межжелудочковой перегородки – синдром Эйзенменгера, характеризующийся значительным повышением давления в лёгочной артерии, когда оно становится равным или превышает давление в аорте. Самым характерным признаком синдрома Эйзенменгера является постепенное нарастание цианоза, – сначала периферического, а в дальнейшем и диффузного. В этой гемодинамической ситуации шум основного порока может ослабевать или полностью исчезать, нарастает акцент II тона на лёгочной артерии, часто приобретая «металлический» оттенок звучания. На этом фоне можно зафиксировать появление нового диастолического шума, обусловленного недостаточностью клапанов лёгочной артерии (шум Грехема-Стилла). Сосуды малого круга кровообращения могут претерпевать морфологические изменения, склерозироваться – наступает склеротическая стадия лёгочной гипертензии. Направление сброса крови может измениться: кровь начинает сбрасываться справа налево, и порок бледного типа трансформируется в порок синего типа. Чаще всего подобная ситуация возникает при позднем выявлении порока, при отсутствии своевременной кардиохирургической помощи. При развитии синдрома Эйзенменгера больные с врождённым пороком сердца становятся неоперабельными.
Рисунок 3. Первичный дефект межпредсердной перегородки
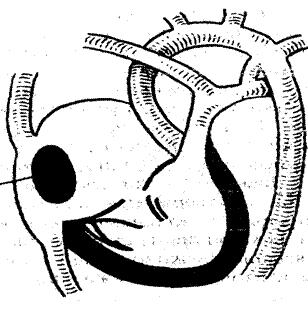
Рисунок 4. Вторичный дефект межпредсердной перегородки
Если вторичные ДМПП встречаются в изолированном виде, то первичные, как правило, входят в состав более сложных комбинированных ВПС (ООАВК, ТАДЛВ, ТМА и т.д.).
Открытое овальное окно не считается врождённым пороком сердца, не вызывает гемодинамических нарушений, не требует хирургической коррекции и встречается у 30% здоровых людей.
Гемодинамические изменения при ДМПП развиваются постепенно вследствие разницы в давлениях в большом и малом кругах кровообращения, из-за чего формируется лево-правый сброс крови через дефект. Из-за поступления избыточного количества крови в правое предсердие и правый желудочек со временем развиваются их дилатация, гипертрофия. Формируется гемодинамический стеноз лёгочной артерии, шум которого выслушивается при аускультации. Изменения в сосудах малого круга кровообращения происходят гораздо более медленно, чем при ДМЖП, медленнее прогрессирует сердечная недостаточность.
Клиника. Заподозрить ДМПП в периоде новорожденности сложно. Невыраженная аускультативная картина трактуется как персистирующие фетальные коммуникации. Признаки недостаточности кровообращения развиваются, как правило, значительно позже – на 1-3 годах жизни, когда происходит увеличение двигательной активности ребенка.
Верхушечный толчок ослабленный, неразлитой. Границы относительной сердечной тупости могут быть расширены расширены в обе стороны за счёт правых отделов: левая граница – из-за смещения влево увеличенным правым желудочком левого, правая граница – за счёт правого предсердия.
Для ДМПП характерен слабый или среднеинтенсивный систолический шум во II-III межреберье слева от грудины. Со временем развивается акцент и/или расщепление II тона над лёгочной артерией. У детей появляется цианоз носогубного треугольника при физической нагрузке и одышка. Показатели физического развития у детей с ДМПП, как правило, соответствуют возрастной норме. Для пациентов раннего возраста характерны частые респираторные заболевания, сопровождающиеся бронхообструктивным синдромом. Признаки высокой лёгочной гипертензии развиваются поздно – к 16-25 годам.
Диагностика ДМПП базируется на данных обследования.
Рентгенологическое исследование малоинформативно, особенно в раннем детском возрасте. Изменение размеров сердца на рентгенограме определяется величиной сброса. Отмечается лишь небольшое увеличение кардиоторакального индекса с незначительными признаками усиления лёгочного рисунка.
На ЭКГ электрическая ось отклонена вправо. Со временем формируются признаки перегрузки правых отделов сердца – предсердия (высокий остроконечный зубец Р) и желудочка (возрастание амплитуды зубца R в отведениях aVR, V1,2) и глубокие зубцы S в отведениях V5,6.
Первичные ДМПП могут сопровождаться нарушениями сердечного ритма (НСР), такими как суправентрикулярная пароксизмальная тахикардия и трепетание предсердий. Нарушения сердечного ритма на фоне ВПС отличаются резистентностью к антиаритмической терапии.
Основным методом диагностики является ЭхоКГ.
Лечение
При наличии сердечной недостаточности терапия направлена на уменьшение гиперволемии малого круга кровообращения. Назначают диуретики и сердечные гликозиды. Традиционная хирургическая коррекция заключена в ушивании дефекта или его пластике. В последнее десятилетие интенсивно развиваются эндоваскулярные методы закрытия дефектов.
Лечение
Медикаментозное лечение направлено на купирование признаков сердечной недостаточности, включает мочегонные средства, дигоксин, ингибиторы АПФ. Поскольку при полной форме АВ-канала быстро развивается высокая лёгочная гипертензия со склеротическими изменениями сосудов, показана первичная радикальная коррекция порока – закрытие дефектов МЖП и МПП и пластика АВ-клапана.
При неполной (частичной) форме ООАВК имеется первичный дефект межпредсердной перегородки с расщеплением передней медиальной створки митрального клапана и/или перегородочной створки трикуспидального клапана, что формирует так называемый «косой канал». Атриовентрикулярные кольца сформированы правильно. Данная форма порока считается прогностически более благоприятной.
Гемодинамика определяется наличием ДМПП и недостаточностью одного из атриовентрикулярных клапанов. Имеет место сброс крови через дефект из левого предсердия в правое, а через расщепление створки – из желудочка в предсердие (правое и левое). При данной сердечной аномалии происходит перегрузка правых отделов сердца, особенно предсердия. Митральная недостаточность умеренная. Большой артериовенозный сброс приводит к развитию гиперволемии в лёгких.
Клинические признаки появляются с первых месяцев жизни: дети начинают отставать в физическом развитии, рано развиваются одышка и тахикардия при физической нагрузке. Характерны склонность к рецидивирующим бронхолёгочным заболеваниям и развитие недостаточности кровообращения, в основном, по правожелудочковому типу.
При осмотре можно выявить наличие деформации грудной клетки по типу сердечного «горба». Границы сердца расширены, как правило, в обе стороны. Первый тон усилен, второй – расщеплён и акцентуирован над лёгочной артерией. Аускультативная картина характеризуется наличием двух различных шумов: систолического шума ДМПП средней интенсивности с эпицентром во II-III межреберье слева от грудины; и второго – интенсивного, «дующего» тембра, выслушивающегося на верхушке сердца и проводящегося в аксиллярную область.
На ЭКГ регистрируется отклонением ЭОС влево, наличием комбинированной гипертрофии обоих желудочков и правого предсердия. Достаточно часто встречаются АВ-блокады 1-2 степени.
Рентгенологически выявляется кардиомегалия, талия сердца сглажена, выбухает дуга лёгочной артерии, усиление лёгочного рисунка за счёт артериального русла.
Лечение
Лекарственное лечение направлено на купирование признаков сердечной недостаточности. Оперативное лечение заключается в пластике ДМПП и ушивании расщепленных створок атриовентрикулярных клапанов.
Открытый артериальный (Боталлов) проток
ОАП – проток, соединяющий начальную часть нисходящей дуги аорты с лёгочной артерией (рисунок 5). В норме ОАП обязательно присутствует у плода, но закрывается вскоре после рождения (не более 15-20 часов). Анатомическое закрытие продолжается в течение 2-8 недель. Проток превращается в артериальную связку. Если же этого не происходит, говорят о наличии порока сердца (ОАП). Персистирование протока и его гемодинамическая значимость в значительной мере зависят от степени доношенности ребёнка; чем меньше масса тела, тем чаще отмечают данную патологию. Синдром дыхательных расстройств, врождённая пневмония, асфиксия в родах препятствуют закрытию ОАП.
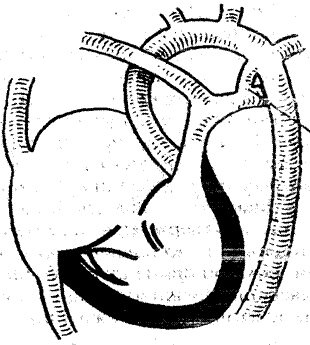
Рисунок 5. Открытый артериальный (Боталлов) проток
Гемодинамика
Дополнительный объём крови, сбрасываемый из аорты в лёгочную артерию, приводит к развитию диастолической перегрузки и дилатации левых отделов сердца, особенно левого предсердия, гиперволемии в лёгких с формированием легочной гипертензии.
Клиническая симптоматика при ОАП зависит от размера протока. Маленький проток, как правило, протекает бессимптомно, и обнаруживают его случайно при плановом обследовании. При ОАП с большим сбросом первые симптомы заболевания – тахикардия и одышка.
В неонатальном периоде у ребенка выслушивается систолический шум во II межреберье слева от грудины. Диастолический компонент шума отсутствует из-за неонатальной лёгочной гипертензии, характерной для этого периода жизни. По той же причине в неонатальном периоде через ОАП может происходить перекрёстный сброс крови, что клинически будет выражаться в появлении цианотической окраски кожных покровов во время крика, сосания, натуживания ребенка. По мере снижения давления в малом круге кровообращения лево-правый сброс крови осуществляется как в систолу, так и в диастолу, что приводит к феномену звучного систоло-диастолического шума («машинный шум», «шум мельничного колеса»). В старшем возрасте по мере прогрессирования лёгочной гипертензии диастолический компонент шума вновь ослабевает вплоть до полного исчезновения. К аускультативным особенностям ОАП можно отнести также усиление и расщепление II тона над легочной артерией. В конечной стадии естественного течения порока можно отметить появление диастолического шума недостаточности лёгочной артерии – шума Грехема-Стилла. При большом сбросе крови слева направо появляется тахипноэ, возможны застойные хрипы в легких, увеличение печени и селезенки.
Лечение
Специфическая терапия у новорожденных заключается в введении ингибиторов синтеза простагландина Е, способствующих спазму протока с последующей его облитерацией. Применяют индометацин 0,1 мг/кг внутривенно 3-4 раза в день в течение 1-3 дней. Результативность лечения составляет в среднем 70-80%. Во время терапии необходимо контролировать выделительную функцию почек и концентрацию билирубина. В последнее время появились сообщения, что ибупрофен обладает меньшим токсическим действием на почки при той же эффективности в отношении ОАП.
Хирургическое закрытие ОАП в раннем возрасте показано при наличии гемодинамических последствий: нарушения функций лёгких, объёмная перегрузка сердца. У маленьких детей нередко прибегают к клипированию сосуда с использованием тораковидеоскопической техники.
Тетрада Фалло
Тетрада Фалло (ТФ) относится к наиболее распространённым порокам сердца синего типа. Доля данного порока среди всех врождённых аномалий сердца составляет 6-7%, среди пороков синего типа — 50-75%.
Тетрада Фалло включает четыре компонента (рисунок 6):
1. подаортальный (высокий мембранозный) дефект межжелудочковой перегородки;
2. стеноз лёгочной артерии (обструкция выхода из правого желудочка);
3. гипертрофия миокарда правого желудочка;
4. декстрапозиция аорты.
Порок относится к ВПС цианотического типа с обеднением малого круга кровообращения.
Клинико-анатомические варианты порока:
1) «крайняя», цианотическая форма (ТФ с атрезией устья лёгочной артерии);
2) классическая форма (сужение выводного отдела правого желудочка на различных уровнях, дефект межжелудочковой перегородки, гипертрофия миокарда правого желудочка и декстрапозиция аорты);
3) «бледная», ацианотическая форма (ТФ с минимальным стенозом легочной артерии.
Выделяют триаду Фалло, когда отсутствует дефект межжелудочковой перегородки (рисунок 6).
При сочетании с ДМПП вариант называется пентадой Фалло(рисунок 6).
Гемодинамика
Во время систолы кровь из обоих желудочков поступает в аорту, в меньшем количестве (в зависимости от степени стеноза) — в лёгочную артерию. Расположение аорты «верхом» на дефекте межжелудочковой перегородки приводит к беспрепятственному выбросу крови из правого желудочка, поэтому правожелудочковая недостаточность не развивается. Из-за большого дефекта межжелудочковой перегородки давление в обоих желудочках одинаковое. Степень гипоксии и тяжесть состояния больных коррелируют с выраженностью стеноза лёгочной артерии.
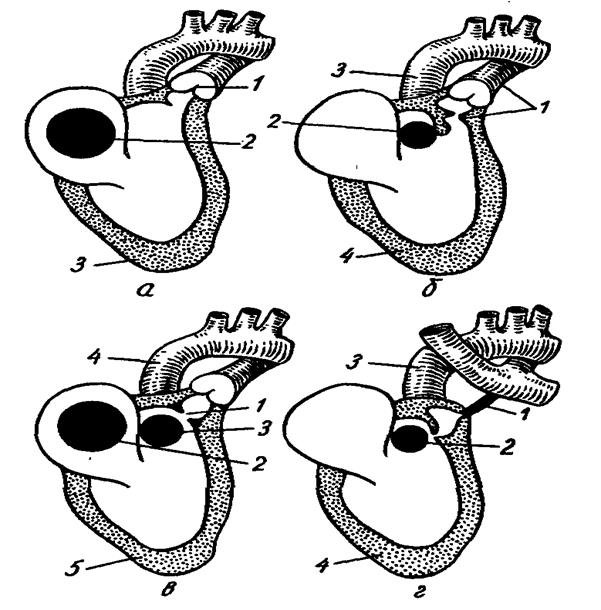
Рисунок 6. Четыре варианта болезни Фалло
а – триада: 1 – клапанный стеноз легочной артерии, 2 – дефект межпредсердной перегородки, 3 – гипертрофия стенки правого желудочка;
б – тетрада: 1 – инфундибулярный стеноз, 2 – дефект межжелудочковой перегородки, 3 – «верхом сидящая аорта», 4 – гипертрофия стенки правого желудочка;
в – пентада: 1 – инфундибулярный стеноз, 2 – дефект межпредсердной перегородки,3 – дефект межжелудочковой перегородки,4 – «верхом сидящая аорта», 5 – гипертрофия стенки правого желудочка;
Клиника
Цианоз – основной симптом тетрады Фалло. Степень цианоза и время его появления зависит от выраженности стеноза лёгочной артерии. У детей первых дней жизни по признаку цианоза диагностируются только тяжелые формы порока – «крайняя» форма тетрады Фалло. В основном, характерно постепенное развитие цианоза (к 3 мес-1 году), имеющего различные оттенки (от нежно-голубоватого до «сине-малинового» или «чугунно-синего»): сначала возникает цианоз губ, затем слизистых оболочек, кончиков пальцев, кожи лица, конечностей и туловища. Цианоз нарастает с ростом активности ребенка. Рано развиваются «барабанные палочки» и «часовые стекла». Постоянным признаком является одышка по типу диспноэ (углублённое аритмичное дыхание без выраженного увеличения частоты дыхания), отмечающаяся в покое и резко возрастающая при малейшей физической нагрузке. Развивается задержка физического развития. Практически с рождения выслушивается грубый систолический шум вдоль левого края грудины.
Грозным клиническим симптомом при тетраде Фалло, обуславливающим тяжесть состояния больных, являются одышечно-цианотические приступы. Возникают они, как правило, в возрасте от 6 до 24 месяцев на фоне абсолютной или релятивной анемии. Приступ провоцирует физическое или эмоциональное напряжение. При ухудшении самочувствия и нарастании гипоксии дети принимают вынужденное положение на корточках. Патогенез возникновения приступа связан с резким спазмом инфундибулярного отдела правого желудочка, в результате чего вся венозная кровь поступает в аорту, вызывая резчайшую гипоксию ЦНС. Насыщение крови кислородом во время приступа падает до 35%. Интенсивность шума при этом резко уменьшается вплоть до полного исчезновения. Ребенок становится беспокойным, выражение лица испуганное, зрачки расширены, одышка и цианоз нарастают, конечности холодные; затем следует потеря сознания, судороги и возможно развитие гипоксической комы и летальный исход. Приступы различны по тяжести и продолжительности (от 10-15 секунд до 2-3 минут). В послеприступном периоде больные длительно остаются вялыми и адинамичными. Иногда отмечается развитие гемипарезов и тяжёлых форм нарушения мозгового кровообращения. К 4-6 годам частота возникновения и интенсивность приступов значительно уменьшается или они исчезают. Связано это с развитием коллатералей, через которые происходит более или менее адекватное кровоснабжение легких.
В зависимости от особенностей клиники выделяют три фазы течения порока:
I фаза – относительного благополучия (от 0 до 6 месяцев), когда состояние пациента относительно удовлетворительное, нет отставания в физическом развитии;
II фаза - одышечно-цианотических приступов (6-24 месяцев), для которой характерно большое число мозговых осложнений и летальных исходов;
III фаза – переходная, когда клиническая картина порока начинает принимать взрослые черты.
При физикальном обследовании у больных с тетрадой Фалло грудная клетка чаще уплощена. Не характерны формирование сердечного горба и кардиомегалия. Во II – III межреберьях слева от грудины может определяться систолическое дрожание. Аускультативно I тон не изменен, II-ой – значительно ослаблен над лёгочной артерией, что связано с гиповолемией малого круга кровообращения. Во II-III межреберьях слева выслушивается грубый скребущий систолический шум стеноза лёгочной артерии. При инфундибулярном или сочетанном стенозе шум выслушивается в III-IV межреберьях, проводится на сосуды шеи и на спину в межлопаточное пространство. Шум ДМЖП может быть как очень умеренным, так и не прослушиваться вовсе из-за небольшого градиента давления между желудочками или его отсутствия. На спине в межлопаточном пространстве выслушивается систоло-диастолический шум средней интенсивности вследствие функционирования открытого артериального протока и/или коллатералей.
Рентгенологическое исследование органов грудной полости позволяет выявить характерную для этого порока картину: легочный рисунок обеднён, форма сердечной тени, не увеличенной в размерах, носит название «голландского башмачка», «сапожка», «валенка» с выраженной талией сердца и приподнятой над диафрагмой верхушкой.
Наиболее типичным признаком на ЭКГ является существенное отклонение ЭОС вправо (120-180°). Имеют место признаки гипертрофии правого желудочка, правого предсердия, нарушения проводимости по типу неполной блокады правой ножки пучка Гиса.
Лечение.
Оперативное лечение в зависимости от анатомической структуры порока может быть паллиативным (наложение аорто-лёгочного анастомоза) или радикальным (устранение стеноза и пластика межжелудочковой перегородки).
Одышечно-цианотический приступ купируют с помощью оксигенотерапии, внутримышечного введения промедола и кордиамина, коррекции ацидоза и улучшения состояния микроциркуляторного русла внутривенным капельным введением соответствующих растворов. Возможно применение седативных и сосудорасширяющих препаратов. К специфической терапии относят β-адреноблокаторы, которые сначала вводят медленно внутривенно (0,1 мг/кг), а затем применяют внутрь в суточной дозе 1 мг/кг. Больным с тетрадой Фалло не следует назначать дигоксин, так как он увеличивает инотропную функцию миокарда, повышает вероятность спазма инфундибулярного отдела правого желудочка.
Важным профилактическим аспектом является предупреждение развития анемии (пероральные формы препаратов железа), одышечно-цианотических приступов (обзидан – из расчета 0,5–1мг/кг, per os), борьба с дегидратацией в случае развития рвоты и/или диареи (обильное питьё, в/в введение жидкости), подбор антиагрегантной (аспирин, курантил, фенилин) или антикоагулянтной терапии (гепарин, фраксипарин, варфарин).
Рисунок 7.Транспозиция магистральных артерий
Клиническая картина при полной ТМА развивается сразу после рождения, достаточно специфична и представлена синдромом артериальной гипоксемии. Основным признаком является выраженный тотальный цианоз кожных покровов, имеющий фиолетовый оттенок, который часто называют «чугунным». При крайней степени выраженности цианоза у детей могут отмечаться гипоксические приступы. Рано развиваются деформации концевых фаланг, гипотрофия, отставание в физическом развитии. Постоянным признаком является одышка. Шум не всегда проявляется в первые дни. Он соответствует расположению сопутствующей коммуникации. Пальпаторно выявляют систолическое дрожание. Кардиомегалия проявляется формированием «сердечного горба». Почти у всех детей имеют место признаки тотальной сердечной недостаточности.
От размеров коммуникаций зависят степень гипоксемии и величина перекрёстного сброса. Возможно сочетание данного порока со стенозом лёгочной артерии, тогда отсутствует гиперволемия малого круга кровообращения, возникают жалобы на одышечные приступы, аналогичные таковым при тетраде Фалло. Для гиперволемии по малому кругу кровообращения характерны повторные пневмонии застойного характера.
Для рентгенологической картины наиболее характерным признаком является овоидная форма сердечной тени («яйцо, лежащее на боку») с узким сосудистым пучком в прямой проекции и широким – в косой проекции. Лёгочный рисунок может быть нормальным (при небольших коммуникациях), усиленным (при больших) или обеднённым (при сочетании со стенозом лёгочной артерии). Характерна кардиомегалия.
Изменения на ЭКГ зависят от размеров коммуникаций и величины лёгочного кровотока. Как правило, ЭОС отклонена вправо, к 3-4 неделям жизни развиваются признаки гипертрофии правых отделов сердца, либо сочетанная гипертрофия обоих желудочков.
ЭхоКГ позволяет идентифицировать главные магистральные сосуды, желудочки и клапанный аппарат. Характерным является параллельный ход магистральных сосудов в апикальной позиции по длинной оси левого желудочка.
При естественном течении данного порока сердца прогноз неблагоприятный. При полной ТМА большинство детей погибает после закрытия фетальных коммуникаций в течение первого месяца жизни. Максимальная продолжительность жизни – 3 месяца. При наличии сопутствующих коммуникаций дети могут доживать до 2-5-летнего возраста.
Лечение
Оперативное лечение – единственный способ сохранить жизнь ребенку, его проводят, как правило, в первый месяц жизни. Существует два основных варианта хирургического лечения: переключение кровотока на уровне предсердий и переключение кровотока на уровне магистральных артерий.
Стенозы аорты
Стенозы аорты (СА) – это группа врождённых пороков сердца, сопровождающихся деформацией створок клапана и/или сужением клапанного, надклапанного или подклапанного отверстия. При этом затрудняется отток крови из левого желудочка в аорту и большой круг кровообращения.
Частота встречаемости данного вида ВПС колеблется от 2 до 7%. Порок чаще встречается у лиц мужского пола.
Клапанный стеноз аорты образуется за счёт сужения, как самого клапанного кольца, так и за счёт сращения створок клапана по комиссурам. Сам аортальный клапан может быть трех-, двух- и одностворчатым. Как правило, при клапанном стенозе существует постстенотическое расширение аорты.
Подклапанный стеноз (фиброзный субаортальный стеноз) образуется серповидной складкой фиброзной соединительной ткани, расположенной непосредственно под аортальным клапаном и закрывающей 1/2–2/3 выходного отдела.
Надклапанный стеноз может встречаться в виде мембраны, располагающейся выше клапана аорты, над синусами Вальсальвы. Сужение аорты имеет вид «часового стекла». Постстенотического расширения при этом не отмечается.
Гемодинамика
В связи с наличием препятствия кровотоку из левого желудочка в аорту усиливается его работа. Левый желудочек гипертрофируется, делается более ригидным при наполнении, что приводит к диастолической перегрузке. Одновременно повышается давление в левом предсердии, лёгочных венах и лёгочной артерии. В большой круг кровообращения поступает меньше крови, чем в норме. Критическим сужением устья аорты считается, если его диаметр равен 2/3 от должного размера. Важной особенностью стенозов аорты является недостаточность коронарного кровотока.
Клиническая картина данного порока сердца напрямую зависит от степени сужения устья аорты. При выраженной степени стеноза (критический стеноз аорты с градиентом давления между аортой и левым желудочком более 70 мм.рт.ст.), Дети с аортальным стенозом рождаются, как правило, с нормальными массо-ростовыми показателями, так как функцию компенсирующего сосуда выполняет открытый артериальный проток. Однако признаки тяжелой сердечной недостаточности развиваются рано. Характерны выраженная бледность, одышка, утомляемость, затруднения при кормлении, приступы внезапного беспокойства (стенокардитические боли).
При лёгкой и умеренной степени стеноза (градиент от 20 до 60 мм.рт.ст.) первые жалобы могут возникнуть в школьном возрасте при усилении физических нагрузок. Появляются одышка, сердцебиение, утомляемость, снижение работоспособности. Позже – боли в области сердца, имеющие колющий, сжимающий характер (ангинозные боли).
Также характерны синкопальные состояния вследствие либо малого сердечного выброса, либо острых нарушений сердечного ритма. Окраска кожных покровов остаётся бледной даже при физических нагрузках.
При физикальном обследовании больного с аортальным стенозом верхушечный толчок усилен, смещён влево и вниз. Характерно несоответствие между усиленным верхушечным толчком и слабым наполнением пульса. Границы относительной сердечной тупости расширены влево. Аускультативно первый тон усилен, второй тон не изменен, выслушивается грубый систолический шум изгнания во II межреберье справа от грудины и в точке Боткина-Эрба. Интенсивность шума прямо пропорциональна степени стеноза аорты. В местах выслушивания шума определяется систолическое дрожание. Периферическая пульсация снижена как на верхних, так и на нижних конечностях. Артериальное давление снижено.
На рентгенограмме при выраженном клапанном стенозе аорты характерно увеличение тени сердца шаровидной формы (кардиомегалия), постстенотическое выбухание аорты. Верхушка сердечной тени приподнята и образует острый угол с диафрагмой. При недостаточности левого желудочка может отмечаться усиление лёгочного рисунка по венозному руслу. При умеренном аортальном стенозе лёгочный рисунок не изменен. Тень сердца с выраженной талией, умеренно увеличен кардио-торакальный индекс.
Изменения на ЭКГ также зависят от степени выраженности аортального стеноза, стадии течения порока сердца, наличия компенсаторных изменений. При лёгких и умеренных степенях стеноза отклонений на ЭКГ может не быть. При выраженном стенозе выявляются: отклонение электрической оси сердца влево, признаки гипертрофии левого желудочка (высокие по амплитуде зубцы R в V5-6, глубокие зубцы S в V1-2, ST-T-изменения в левых грудных отведениях, иногда появление патологического зубца Q, неспецифические нарушения проводимости).
Допплер-ЭхоКГ позволяет определить наличие стеноза, уровень его расположения и градиент давлений в системе «левый желудочек - аорта».
Лечение. В консервативной терапии сердечной недостаточности необходимо с осторожностью применять кардиотонические средства из-за резко выраженной гипертрофии. Предпочтение отдается мочегонным препаратам.
Оперативное лечение у детей раннего возраста заключается в транслюминальной баллонной вальвулопластике аортального клапана.
Коарктация аорты
Коарктация аорты (КА) – это врождённое сегментарное сужение аорты в области дуги, перешейка, нижнего грудного или брюшного отделов. Частота встречаемости порока — 6-15% всех врождённых сердечных аномалий. В 3-5 раз чаще порок встречается у мальчиков.
Варианты коарктации аорты:
1. изолированная коарктация (взрослый тип);
2. коарктация аорты в сочетании с открытым артериальным протоком (детский тип).
По отношению к ОАП коарктация аорты подразделяется следующим образом (рисунок 8):
1. предуктальная коарктация аорты – сужение проксимальнее места отхождения ОАП;
2. юкстадуктальная коарктация аорты – сужение на уровне отхождения ОАП;
3. постдуктальная коарктация аорты – сужение дистальнее отхождения ОАП.
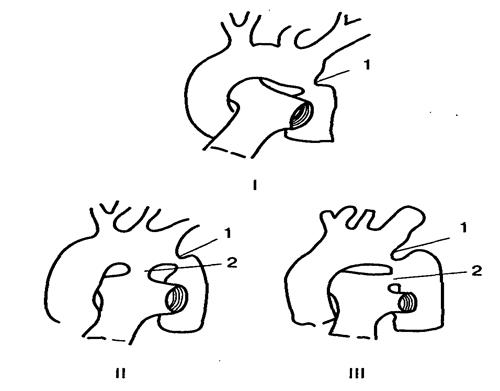
Рисунок 8. Коарктация аорты
Инструментальные методы
ЭКГ выявляет признаки перегрузки левого желудочка с явлениями его субэндокардиальной ишемии (смещение конечной части желудочкового комплекса вниз). Возможно отклонение электрической оси сердца влево.
Рентгенологически можно выявить узурацию нижних краёв рёбер вследствие давления резко расширенных и извитых межрёберных артерий. Сердце может иметь шаровидную или «аортальную», овоидную конфигурацию с приподнятой верхушкой.
Допплер-ЭхоКГ выявляет как прямые признаки порока (визуализация коарктации, измерение градиента давлений на уровне сужения), так и косвенные (гипертрофия левого желудочка).
Хирургическое лечение заключается в резекции суженного участка аорты и наложении на этот участок синтетической заплаты.
Рисунок 9. Изолированный стеноз легочной артерии
Нарушения гемодинамики обусловлены препятствием кровотоку из правого желудочка в суженную лёгочную артерию, что увеличивает систолическую нагрузку на правый желудочек. Правый желудочек гипертрофируется, со временем развиваются признаки правожелудочковой недостаточности.
Клиническая картина ИСЛА зависит от степени стеноза. При умеренном стенозе дети развиваются нормально. Однако по мере роста ребёнка нарастает одышка при физической нагрузке, которая быстро исчезает в покое. Цианоза никогда не бывает. Единственным признаком является интенсивный систолический шум стенотического тембра во II межреберье слева от грудины с одновременным ослаблением II тона над лёгочной артерией. Интенсивность шума, как правило, пропорциональна степени стеноза. При выраженном стенозе отмечается быстрая утомляемость, одышка. Достаточно быстро формируется деформация грудной клетки по типу «сердечного горба». Пальпаторно определяется систолическое дрожание в месте выслушивания шума. Сердечный толчок, как правило, выражен. При тяжелом стенозе первые признаки порока сердца проявляются уже в раннем грудном возрасте. Дети отстают в физическом развитии, наблюдаются одышка и затруднения при кормлении. Со временем появляется цианоз, деформация терминальных фаланг пальцев («барабанные палочки») или ногтей («часовые стекла»). Могут развиваться нарушения сердечного ритма.
Рентгенологически выявляется обеднение лёгочного рисунка. Сердце, как правило, умеренно дилатировано за счёт правого желудочка. Возможно постстенотическое расширение лёгочной артерии.
При ЭКГ определяется отклонение ЭОС сердца вправо, признаки гипертрофии правого предсердия и желудочка. ЭхоКГ позволяет выявлять увеличение и гипертрофию правых отделов сердца, а Допплер-ЭхоКГ - регистрировать турбулентный кровоток через суженный клапан лёгочной артерии.
Лечение
Медикаментозное лечение малоэффективно. У новорождённых для поддержания лёгочного кровотока возможно использование простагландинов. Хирургическое лечение предполагает транслюминальную баллонную вальвулопластику.
Общий артериальный ствол
Общий артериальный ствол (ОАС) – порок цианотического типа, характеризующийся отхождением единого крупного сосудистого ствола через единый клапан (с аномальным количеством створок) от двух желудочков сердца, который обеспечивает кровообращение как в большом, так и в малом кругах кровообращения. В состав данного врожденного порока сердца обязательно входит субаортальный большой дефект межжелудочковой перегородки.
В зависимости от характера дальнейшего ветвления ОАС различают следующие его типы:
1 тип – после выхода ОАС делится на два крупных сосуда, один из которых является аортой, а другой – лёгочной артерией;
2 и 3 тип характерно отхождение ветвей лёгочной артерии прямо от ОАС;
4 тип называют «ложным» общим артериальным стволом, так как по сути имеется только один сосуд – аорта; лёгочная артерия и её ветви отсутствуют. Кровообращение лёгких при этой разновидности порока осуществляется только за счёт коллатералей. Частота встречаемости данного ВПС невысока и составляет от 0,2-0,8% до 1,7-4,7%. Невысокая частота порока может объясняться тем, что большинство детей с ОАС погибает в первую неделю жизни. Одинаково часто встречается как у мальчиков, так и у девочек. Характерно наличие сопутствующих ВПС (КА, АДЛВ, ЕЖС, ООАВК), экстракардиальных пороков развития в виде скелетных аномалий, урогенитальных пороков развития, неправильных поворотов кишечника.
Гемодинамика
Из-за большого ДМЖП в общий артериальный ствол поступает смешанная кровь из обоих желудочков. Степень нарушения гемодинамики будет зависеть от величины сосудов, снабжающих лёгкие. При их больших размерах развивается гемодинамическая катастрофа. Уже на первой неделе жизни лёгкие буквально «захлёбываются» кровью (выраженная гиперволемия МКК), развивается бивентрикулярная, рефрактерная к лечению сердечная недостаточность, от которой пациенты и погибают.
Несколько иная гемодинамическая картина развивается при сопутствующем стенозе ветвей лёгочной артерии: умеренно суженные или гипоплазированные ветви лёгочной артерии предотвращают большой сброс крови в МКК и создается уравновешенная гемодинамика. Больные дети могут дожить до года или более.
Клиническая картина при классическом варианте ОАС достаточно специфична: дети рождаются с нормальными массо-ростовыми показателями, но сразу после рождения очень быстро нарастают одышка и тахикардия, появляется умеренный цианоз, развивается недостаточность кровообращения. Состояние больных может стать критическим уже с первых дней жизни. Большинство пациентов умирают в первые 2 недели жизни. При осмотре ребенка можно отметить рано формирующийся сердечный «горб», сердечный толчок, выраженное расширение границ относительной сердечной тупости. Аускультативная картина зависит от многих факторов, но, как правило, тоны сердца напряжены, очень громкие, систолический шум грубый. Отмечается гепатоспленомегалия.
Рентгенологическое исследование фиксирует изменения в лёгких гиперволемического характера (вплоть до отёка легких) и кардиомегалию.
ЭКГ не имеет специфических изменений. Чаще всего отмечаются признаки перегрузки обоих желудочков.
Основную информацию, помимо клинической картины, даёт ЭхоКГ, выявляющее большой общий сосуд, отходящий от обоих желудочков и, как бы, «сидящий верхом» на межжелудочковой перегородке. Такая картина создаётся из-за большого подаортального ДМЖП.
Очень важно при ЭхоКГ определить тип ОАС и количество створок на трункусе, а также признаки стеноза или недостаточности общего клапана.
Показанием к операции является критическое состояние больного и отсутствие эффекта от консервативной терапии.
Рисунок 10. Атрезия трикуспидального клапана
Клиническая картина специфична: ребенок рождается с цианотической окраской кожных покровов, которая имеет фиолетово-серый колорит. Артериальной гипоксемии сопутствуют стабильные одышка и тахикардия. Быстро развиваются «барабанные палочки» и «часовые стёкла». Дети отстают в физическом развитии. Развивается сердечный горб. При осмотре выявляется расширение границ относительной сердечной тупости больше влево.
Аускультативно выслушивается грубый систолический шум вдоль левого края грудины (шум ДМЖП и/или стеноза лёгочной артерии, открытого артериального протока).
Рентгенологическая картина напоминает таковую при ТМА: форма сердца часто напоминает «яйцо, лежащее на боку», но может отмечаться и кардиомегалия. В зависимости от наличия сопутствующего стеноза лёгочной артерии может быть характерный лёгочный рисунок (гиперволемия при отсутствии стеноза, гиповолемия – при его наличии).
Важную информацию даёт ЭКГ: сочетание цианоза с рождения с отклонением электрической оси сердца влево и признаками перегрузки предсердий – очень специфический симптом при АТК. В дальнейшем появляются и нарастают признаки перегрузки и гипертрофии левого желудочка.
ЭхоКГ характеризуется отсутствием типичного эхо-сигнала от трёхстворчатого клапана, гипоплазированной полостью правого желудочка, наличием сопутствующих аномалий.
Прогноз при данном пороке очень серьёзный. Течение прогрессирующее. С возрастом усиливается гипоксия и признаки сердечной недостаточности. Большинство больных умирают в первые 6 месяцев жизни.
Хирургическая коррекция АТК подразделяется на паллиативные операции и гемодинамическую коррекцию.
Аномалия Эбштейна
Аномалия Эбштейна – это порок развития трёхстворчатого клапана, при котором одна из створок (передняя) прикреплена к фиброзному кольцу правильно, а другие (задняя и септальная) – к стенке правого желудочка. При этом створки бывают деформированы, утолщены и создают ситуацию недостаточности клапана. Кроме того, из-за смещения створок уменьшается (иногда значительно) полость правого желудочка. Правое предсердие значительно увеличено в размерах. Часто имеется открытое овальное окно или дефект межпредсердной перегородки. Левые отделы сердца не изменены.
Гемодинамические нарушения определяются степенью смещения трикуспидального клапана и уменьшением полости правого желудочка, а так же недостаточностью трикуспидального клапана. Из-за уменьшения диастолического наполнения правого желудочка уменьшается выброс венозной крови в лёгочную артерию. Параллельно развивается застой крови в правом предсердии. При наличии ДМПП из правого предсердия венозная кровь будет сбрасываться в левое и в клинической картине будет отмечаться цианоз.
Клиническая картина при выраженных анатомических вариантах порока проявляется уже в роддоме или в первые недели и месяцы жизни: наличие цианоза, имеющего малиновый или синюшный оттенки, размеры сердца увеличены, больше вправо (вплоть до «cor bovinum»), формируется сердечный горб. Аускультативная картина минимальная - выслушивается недостаточность или стеноз трёхстворчатого клапана, шум ДМПП. Характерным признаком аномалии Эбштейна являются нарушения сердечного ритма по типу суправентрикулярной пароксизмальной тахикардии, трепетания предсердий. Стертые варианты порока с незначительным или умеренным смещением трикуспидального клапана длительное время могут оставаться недиагностированными или выявляются случайно.
Рентгенологически выявляется увеличение сердечной тени шаровидной формы, обеднение легочного рисунка.
На ЭКГ может определяться перегрузка и гипертрофия правого предсердия, причём степень увеличения зубца Р различна: от минимального увеличения до гигантского, превышающего по амплитуде зубец R.
ЭхоКГ позволяет оценить степень смещения трикуспидального клапана и определить сопутствующие аномалии.
Прогноз при аномалии Эбштейна зависит от степени гемодинамических нарушений. Прогностически неблагоприятными считаются кардиомегалия, сердечная недостаточность и аритмии. В тяжёлых случаях показано протезирование трикуспидального клапана, пластика ДМПП.
ОГЛАВЛЕНИЕ
| 1. | Введение ………………………………….......................................... | 3 |
| 2. | Классификация врожденных пороков сердца……………………... | 3 |
| 3. | Врожденные пороки сердца бледного типа ………………………. | 7 |
| 4. | Дефект межжелудочковой перегородки…………………………… | 7 |
| 5. | Дефект межпредсердной перегородки…………………………….. | 10 |
| 6. | Общий открытый атриовентирикулярный канал…………………. | 12 |
| 7. | Открытый артериальный (Боталлов) проток……………………… | 15 |
| 8. | Врожденные пороки сердца синего типа………………………….. | 17 |
| 9. | Тетрада Фалло……………………………………………………….. | 17 |
| 10. | Транспозиция магистральных артерий ……………………………. | 21 |
| 11. | Врожденные пороки сердца с препятствием к выбросу крови из желудочков……………………………………………………...... | 23 |
| 12. | Стенозы аорты……………………………………………………….. | 23 |
| 13. | Коарктация аорты…………………………………………………… | 25 |
| 14. | Изолированный стеноз легочной артерии…………………………. | 27 |
| 15. | Аномальный дренаж легочных вен ………………………………... | 28 |
| 16. | Общий артериальный ствол………………………………………… | 30 |
| 17. | Атрезия трикуспидального клапана………………………………... | 32 |
| 18. | Аномалия Эбштейна ………………………………………………... | 33 |
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА У ДЕТЕЙ
Введение
Врожденные пороки сердца (ВПС) являются одной из самых частых аномалий развития, встречаются с частотой 8-12 на 1000 живорожденных детей. Причины возникновения врождённых пороков сердца разнообразны. Наиболее уязвимый период – 3-9 недель беременности, это есть время, когда происходит закладка и формирование структур сердца. Большое значение имеют тератогенные факторы внешней среды, соматические заболевания матери и отца, инфекции, особенно вирусные (вирус краснухи, ЦМВ, ВПГ, вирус гриппа, энтеровирус, вирус Коксаки В и др.), а также алкоголизм родителей, приём наркотических веществ, курение матери, профессиональные вредности. Ассоциированы с врождёнными пороками сердца многие хромосомные заболевания (синдромы Дауна, Патау, Эдвардса, Шерешевского-Тернера и т.д.).
Дата: 2019-05-28, просмотров: 347.