Газы. Силы притяжения между атомами и молекулами достаточно разреженных газов практически отсутствуют, т.к. частицы газов находятся друг от друга на расстояниях, превышающих радиус молекулярного действия. Частицы движутся равномерно и прямолинейно до тех пор, пока они не сталкиваются между собой или со стенками сосуда. Эти столкновения носят случайный характер. Тепловое движение молекул газов является беспорядочным и, в среднем, в любом произвольном направлении внутри газа в любой момент времени движется одинаковое число молекул.
Твердые (кристаллические) тела характеризуются значительными силами взаимодействия между частицами твердых тел (атомами, молекулами, ионами). Совместное действие сил притяжения и отталкивания между этими частицами приводит к тому, что частицы твердых тел совершают колебания около средних равновесных положений, называемых узлами кристаллической решетки.
Жидкости. Тепловое движение молекул жидкости имеет промежуточный характер между газами и твердыми телами. Молекула жидкости определенное время колеблется около некоторого положения равновесия и находится в оседлом положении. По истечении некоторого времени положение равновесия молекулы смещается и образуется новое оседлое положение. Происходят, одновременно, медленные перемещения молекул и их колебания внутри малых объемов.
Методы исследования
Статистический метод основан на использовании теории вероятностей и определенных моделях строения вещества. Раздел теоретической физики, использующий статистический метод, называется статистической физикой (физической статистикой).
В совокупном поведении большого числа частиц проявляются особые закономерности, называемые статистическими закономер ностями. В системе, состоящей из большого числа частиц, существуют некоторые средние значения физических величин, характеризующих всю совокупность частиц в целом.
Термодинамический метод не учитывает внутреннее строение веществ тех тел (систем) и характер движения отдельных частиц. Термодинамический метод основан на изучении различных превращений энергии, происходящих в системе.
Давление и температура газов определяются и в статистической физике и в термодинамике:
| Статистическая физика | Термодинамика |
Температура
Давление
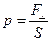
Такие газы как водород, гелий, кислород, азот и воздух считаются идеальными при плотностях, соответствующих нормальным условиям.
Понятие «идеальный газ» можно ввести также двумя методами:
| Статистическая физика | Термодинамика |
| Идеальный газ – это модель газа, в которой: - собственным объемом молекул можно пренебречь по сравнению с объемом сосуда, в котором находится газ, - между молекулами нет сил межмолекулярного взаимодействия (сил притяжения и отталкивания), - молекулы ведут себя при столкновениях как абсолютно упругие шарики | Идеальный газ – это газ, поведение которого подчиняется изотермическому, изобарному и изохорному законам. |
При описании термодинамической системы используются макро- и микропараметры термодинамической системы:
| МИКРОПАРАМЕТРЫ (определяются косвенно) | МАКРОПАРАМЕТРЫ (определяются с помощью приборов) |
масса молекулы 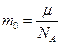
| объем - мера вместимости вещества, обозначается V, единицы [м3], 1 л=10-3 м3 |
концентрация молекул -число молекул в единице объема 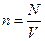 , [ , [ 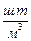 =м-3]; =м-3];
| давление 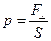 , [Па[8]], 1 мм рт ст = 133,3 Па.
Нормальные условия: 1атм = 760 мм рт ст = 1,01325∙105 Па , [Па[8]], 1 мм рт ст = 133,3 Па.
Нормальные условия: 1атм = 760 мм рт ст = 1,01325∙105 Па  105 Па 105 Па
|
скорость молекулы
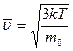
| температура обозначается Т[К] (Кельвин[9]) . Связь между термодинамической (абсолютной) температурой Т и температурой по стоградусной шкале Цельсия[10]: T=273,15+t. Температура Т=0 (t=-273,15°С) называется абсолютным нулем температуры. Нормальные условия: 0°С = 273,15 К. |
масса – мера инертности тела, 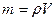 , единицы [кг] , единицы [кг]
|
Дата: 2019-04-23, просмотров: 335.