В разделе физики, называемом молекулярной физикой, изучаются зависимости строения и физических свойств тел от характера движения и взаимодействия между частицами, из которых состоят тела.
Молекулярная физика основывается на молекулярно-кинетической теории строения вещества.
Основные положения МКТ:
1.Все вещества образованы из мельчайших частиц – молекул.
2.Молекулы находятся в непрерывном хаотическом движении.
3.Частицы взаимодействуют друг с другом силами межмолекулярного взаимодействия притяжения и отталкивания.
Экспериментальными подтверждениями молекулярно-кинетической теории являются:
-броуновское движение – движение частиц краски, пыли, пыльцы, взвешенных в жидкости или в газе,
-явления переноса в различных агрегатных состояниях вещества (диффузия, вязкость, теплопроводность).
Основные формулы
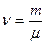
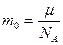 N = NA n
N = NA n
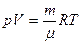
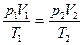
Параметры воздуха при нормальных условиях:
р =101325 Па≈ 105 Па, Т = 273,15 К≈273 К; μ = 0,029 кг/моль; V=22,413 996(39) л ≈ 22,4 л
Законы термодинамики
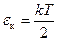
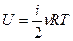
| Одноатомный газ | Двухатомный газ | Многоатомный газ | |
| i | 3 | 5 | 6 |
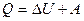
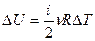
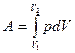
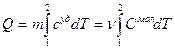
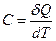
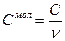
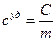
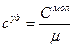
Газовые процессы:
| Изотермический | Изохорный | Изобарный | Адиабатный |
| T = const | V = const | p = const | Q = 0 |
| pV= const | p/T= const | V/T= const | pVγ = const; TVγ-1= const |
| 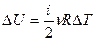
| 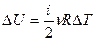
| 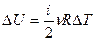
|
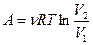
| A = 0 | А=ν RΔT
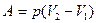
| 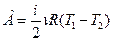
|
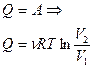
| 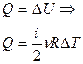
| 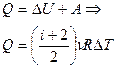
| Q = 0 ΔU=-A |
 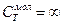
| 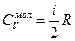
| 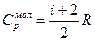
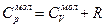
|
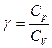
|
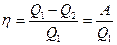
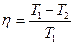
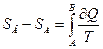
p = 
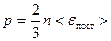 p = nkT
p = nkT 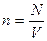
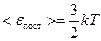
Распределения Максвелла
число молекул, скорости которых заключены в пределах от  до до 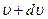
| число молекул, относительные скорости которых заключены в пределах от u до u + du |
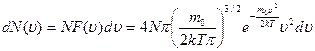
| 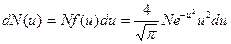
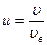
|
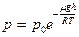
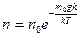
Характеристики движения молекул газа:
| Скорость молекул | ||
| средняя квадратичная | средняя арифметическая | наиболее вероятная |
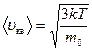
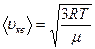
| 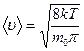
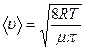
| 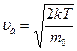

|
| Величина | Единица | ||
| Обозначение | Наименование | ||
| n | количество вещества | моль | моль |
| m | масса вещества | кг | кг |
| μ | молярная масса | кг/моль | кг/моль |
| m0 | масса молекулы | кг | кг |
| N | число молекул | - | - |
| p | давление | Па (паскаль) | кг/(м∙с2) |
| V | объем | м3 | м3 |
| Т | абсолютная температура | К (кельвин) | К |
| n | концентрация молекул | м-3 | м-3 |
| Ek | среднее значение кинетической энергии теплового движения молекул | Дж (джоуль) | кг∙м2/ с2 |
| f(v) | функция распределения молекул по модулям скоростей | ||
| f(v) | функция распределения по относительным скоростям | ||
| Q | количество теплоты | Дж (джоуль) | кг∙м2/с2 |
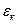
| энергия движения, приходящаяся на одну степень свободы | Дж (джоуль) | кг∙м2/с2 |
| U | внутренняя энергия | Дж (джоуль) | кг∙м2/с2 |
| i | степень свободы | - | - |
| ΔU | изменение внутренней энергии | Дж (джоуль) | кг∙м2/с2 |
| А | работа газа | Дж (джоуль) | кг∙м2/с2 |
| С | теплоемкость вещества | Дж/К | кг∙м2/(К∙с2) |
| суд | удельная теплоемкость | Дж/(кг∙К) | м2/(К∙с2) |
| Смол | молярная теплоемкость | Дж/(моль∙К) | кг∙м2/(мольК∙с2) |
| γ | показатель адиабаты | - | - |
| SB - SA | разность энтропий двух состояний В и А | Дж/К | кг∙м2/(К∙с2) |
| η | коэффициент полезного действия | - | - |
| S | площадь | м2 | м2 |
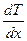
| градиент температуры | K/м | K/м |
| k | теплопроводность (коэффициент теплопроводности) | Вт/(м∙К) | кг∙м2/(с3∙м∙К) |
NА= 6,02×1023 моль-1 – число Авогадро
k = 1,38×10-23 Дж/К – постоянная Больцмана
R = 8,31 Дж/(моль∙ К)– универсальная газовая постоянная
Масса и размеры молекул
Размеры молекул различных веществ неодинаковы, но все они порядка 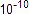 м, т.е. очень малы.
м, т.е. очень малы.
Масса молекулы (молекулярная масса) : 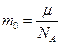 , [кг].
, [кг].
Молярная масса (масса моля): обозначается 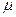 , единицы [
, единицы [ 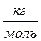 ].
].
Число Авогадро[7] показывает число молекул в одном моле ЛЮБОГО вещества 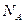 =6,02×1023 моль-1.
=6,02×1023 моль-1.
Количество вещества (число молей) : 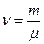 или
или 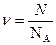 , [моль].
, [моль].
Число молекул (количество молекул): 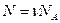 или
или 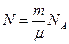 .
.
Число Авогадро показывает, что в одном моле любого вещества находится 6,02∙1023 молекул N А= 6,02×1023 моль-1 .
Дата: 2019-04-23, просмотров: 256.