Функциями состояния называются физические величины, характеризующие состояние системы.
Простейшими функциями состояния системы являются ее внутренняя энергия и энтропия.
Внутренней энергией тела или термодинамической системы называется энергия движения и взаимодействия частиц тела,
обозначается U, единицы [Дж].
Внутренняя энергия зависит только от термодинамического состояния тела. Если тело неподвижно и не находится во внешних силовых полях, то внутренняя энергия совпадает с полной энергией. Внутренняя энергия совпадает также с энергией покоя тела.
Например, внутренняя энергия газа многоатомных молекул (аммиак, углекислый газ и т. п,) состоит из:
а)кинетической энергии теплового поступательного и вращательного движения молекул;
б)кинетической и потенциальной энергии колебаний атомов в молекулах;
в)потенциальной энергии, обусловленной межмолекулярными взаимодействиями;
г)энергии электронных оболочек атомов и ионов;
д)кинетической энергии и потенциальной энергии взаимодействия нуклонов в ядрах атомов.
Слагаемые г) и д) обычно не изменяются в процессах, происходящие при не очень высоких температурах, когда ионизация и возбуждение не играют существенной роли. В этих условиях слагаемые г) и д) не учитываются в балансе внутренней энергии. Для идеального газа не учитывается также слагаемое в).
Внутренняя энергия является однозначной функцией термодинамического состояния системы (значение внутренней энергии в любом состоянии не зависит от того, с помощью какого процесса система пришла в данное состояние).
Изменение внутренней энергии при переходе системы из состояния 1 в состояние 2 равно 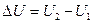 и не зависит от вида процесса перехода
и не зависит от вида процесса перехода 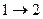 . Если система совершает круговой процесс, то полное изменение ее внутренней энергии равно нулю:
. Если система совершает круговой процесс, то полное изменение ее внутренней энергии равно нулю: 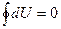 .
.
Математически это означает, что элементарное изменение dU внутренней энергии является полным (точным) дифференциалом.
Изменять внутреннюю энергию можно двумя путями: при совершении работы, либо с помощью теплообмена. Следовательно, Работа и теплота являются энергетическими характеристиками процессов изменения состояния термодинамических системы.
Работа в термодинамике
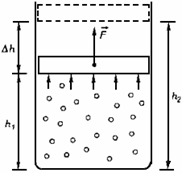
Работой совершенной над системой, называется количество энергии, переданной системе внешними телами при силовом взаимодействии между ними.
По закону сохранения энергии работа А', совершаемая над системой внешними силами, численно равна и противоположна по знаку работе А, которую сама система совершает над внешней средой, т. е. против внешних сил: А'= -А.
|
Элементарная работа расширения: 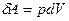 , где dV - элементарное изменение объема системы.
, где dV - элементарное изменение объема системы.
Покажем это. 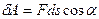 . В нашем случае:
. В нашем случае: 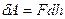 , но т.к.
, но т.к. 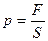 , то
, то 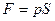 . Следовательно,
. Следовательно, 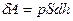 и
и 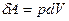 .
.
|
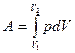 .
.
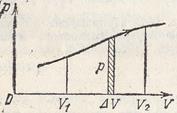
Работу, совершенную газом можно определить по площади фигуры под графиком
давления.
|
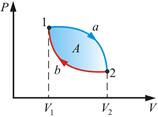
Работа по замкнутому циклу равна площади фигуры, ограни ченном диаграммой газа в координатах pV. Результирующая положительная работа измеряется заштрихованной площадью.
Количество теплоты
Количеством теплоты, сообщенной системе, называется количество энергии, переданной системе внешними телами путем теплообмена.
Существуют три вида теплообмена: конвективный теплообмен, теплопроводность и теплообмен излучением.
Обозначение Q, единицы [Дж].
Теплоемкостью тела называется физическая величина, равная отношению количества теплоты, сообщаемого телу, к изменению его температуры
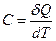 , [Дж/К] .
, [Дж/К] .
Теплоемкость зависит от массы тела, его химического состава, термодинамического состояния и процесса, в котором сообщается теплота. Следовательно, 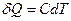 .
.
Удельной теплоемкостью называется теплоемкость единицы массы вещества. Для однородного тела:
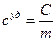
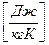 ,
,
Следовательно, 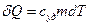 .
.
Молярной теплоемкостью называется теплоемкость одного моля вещества:
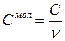 или
или 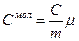 или
или 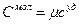
 ,
,
где μ- молярная масса вещества, 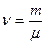 – количество вещества.
– количество вещества.
Следовательно, 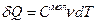 или
или 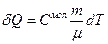 .
.
Дата: 2019-04-23, просмотров: 256.