1. Сплавление натриевых солей ароматических сульфокислот со щелочами:
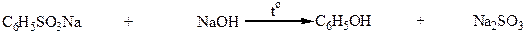
Na – соль бензосульфокислоты
|
|
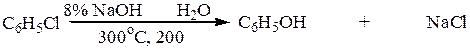
3. “Кумольный” способ (из бензола и пропилена):
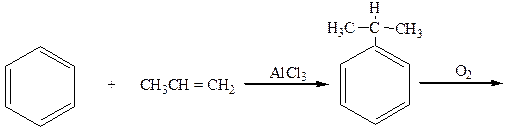
бензол пропилен изопропилбензол (кумол)
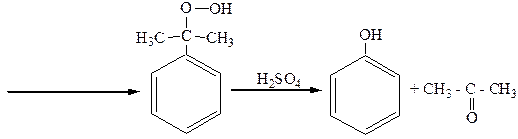
гидроперекись изопропилбензола фенол ацетон
4. Из солей диазония, например: из хлористого фенилдиазония:
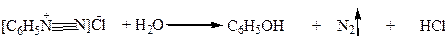
ХИМИЧЕСКИЕ СВОЙСТВА
Важнейшим свойством фенолов, отличающих их от спиртов, является их кислотность. Кислотные свойства фенолов обусловлены той относительной легкостью, с которой фенол теряет протон:
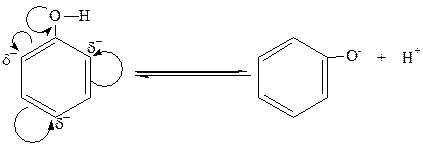
феноксид-ион
В фенольном гидроксиле свободная пара электронов атома кислорода взаимодействует с π-электронами бензольного кольца, сдвигаясь в сторону кольца. Атом кислорода,поскольку его отрицательный заряд уменьшается, а положительный несколько увеличивается, сильнее притягивает к себе электронную пару атома водорода гидроксильной группы. Это облегчает отщепление водорода в виде протона, то есть процесс диссоциации. Однако кислотные свойства фенола все же слабее, что следует из сравнения констант диссоциации Kд фенола и самой слабой минеральной кислоты-угольной (H2CO3): KдH2CO3 =4,9·10-7; KдС6Н5ОН = 1,3∙10-10.
Из сопоставления данных констант видно, что KдС6Н5ОН примерно в 3300 раз меньше, чем KдH2CO3. Тем не менее, кислотные свойства ощутимо сильнее, чем у алифатических спиртов, так как последние не реагируют с NaOH, а фенолы с этим веществом взаимодействуют.
Поскольку фенолы имеют ароматическое ядро и одну или несколько ОН-групп, для них характерны два основных типа реакций;
- по гидроксильной группе;
- по ароматическому ядру.
РЕАКЦИИ ПО ГИДРОКСИЛЬНОЙ ГРУППЕ
1. Фенолы, как и спирты, взаимодействуют со свободными щелочными и щелочноземельными металлами с образованием фенолятов, так же, как спирты образуют алкоголяты:
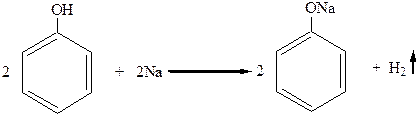
фенолят натрия

алкоголят
натрия
Проявляя кислотные свойства, фенолы взаимодействуют и с гидроксидами этих металлов:
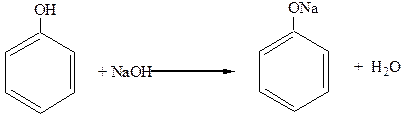
В последнюю реакцию алифатические спирты не вступают, демонстрируя очень слабые кислотные свойства.
2. Образование простых эфиров (идет через феноляты, а не через фенолы):
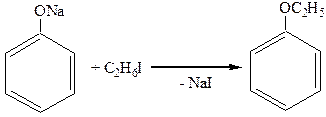
этилфениловый эфир (фенетол)

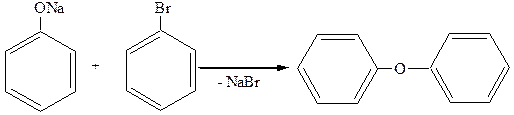
дифениловый эфир
3. Образование сложных эфиров (через галогенангидриды кислот):
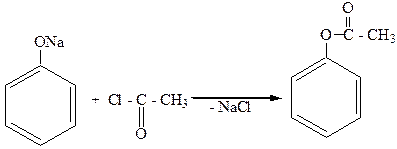
фенилуксусный эфир
РЕАКЦИИ АРОМАТИЧЕСКОГО ЯДРА
1.Галогенирование.
При действии галогенов, даже бромной воды (Br2+H2O), три атома водорода в ядре очень легко замещаются, давая тригалогензамещенные фенолы:
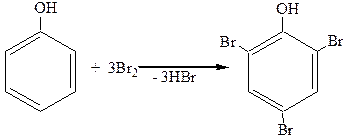
2,4,6-трибромфенол
2. Нитрование.
Фенолы легко нитруются. При действии даже очень разбавленной HNO3 получается смесь орто- и пара-нитрофенолов:
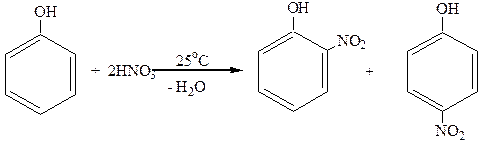
о-нитрофенол п-нитрофенол
NO2Å –сильная электрофильная частица. Она способствует в большей степени диссоциации атома водорода в гидроксильной группе. Введение второй NO2-группы требует уже кипячения с концентрированной HNO3:
|
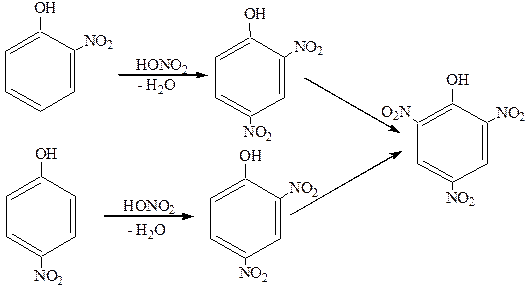
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) нужно использовать смесь HNO3 и H2SO4 или 2-3 суток кипятить в концентрированной азотной кислоте.
3. Сульфирование.
Фенолы легко сульфируются:
|
|
|
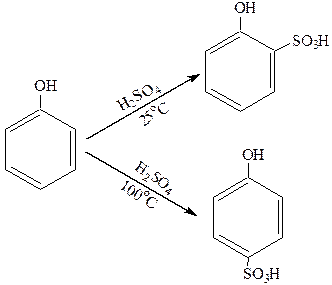
2. Алкилирование (по Фриделю-Крафтсу):
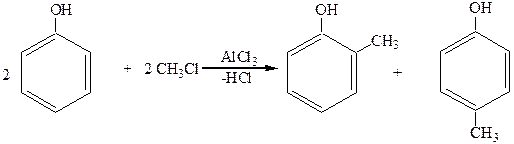
о-крезол п-крезол
3. Поликонденсация:
|

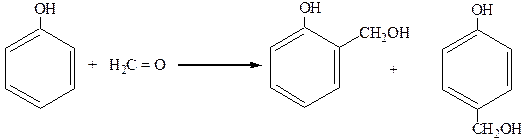
о-оксибензиловый п-оксибензиловый
спирт спирт
далее идет конденсация с выделением воды:
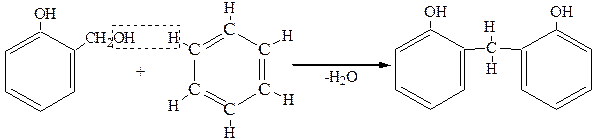
В итоге образуется сетчатая структура (фенольно-формальдегидные смолы):

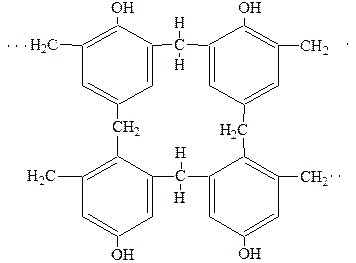
6.Окисление.
При энергичном окислении образуются хиноны:
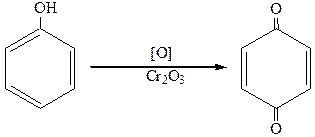
п-бензохинон
7.Восстановление.
Восстановление фенола в присутствии катализаторов дает циклогексанол:
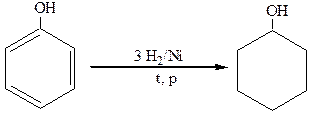
фенол циклогексанол
НАФТОЛЫ
Нафтолами называются гидроксипроизводные нафталина. Различают a и β-нафтолы. Они могут быть получены всеми обычными методами получения фенолов.
Промышленным способом их получения является сплавление с щелочами натриевых солей сульфокислот:
|
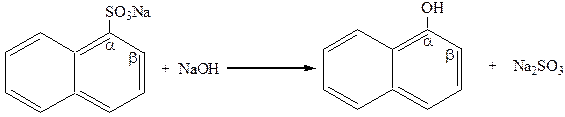
натриевая соль a-нафтол
a-нафталинсульфокислоты
|
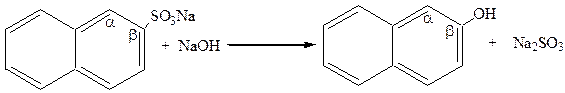
натриевая соль b-нафтол
b-нафталинсульфокислоты
Оба нафтола – кристаллические вещества. β-нафтол имеет более высокую температуру плавления. Оба вещества трудно растворяются в воде, хорошо – в едких щелочах.
Реакции замещения нафтолов идут сначала в том ядре, где находится гидроксигруппа. При галогенировании. Нитровании и сульфировании a-нафтола получается п-производные, например:
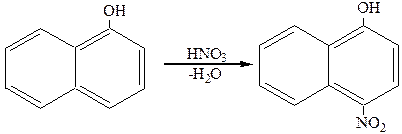
4-нитронафтол
В случае β-нафтола вступление нового заместителя идет только в α-положение, например:

1-нитронафтол
Нафтолы применяют как вторые компоненты в реакциях азосочетания.
Эфиры нафтолов обладают приятным запахом. Метиловый эфир β-нафтола применяется в парфюмерии.
Динитро-a-нафтол применяется как желтый краситель. Он легко получается нитрованием a-нафтола:
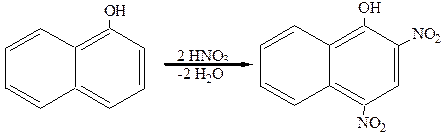
Из дигидроксипроизводных нафталина наибольший интерес представляет 1,8-дигидрокси-3,6-нафталиндисульфокислота (хромотроповая кислота). Синтез ее осуществляется по следующей схеме:
|
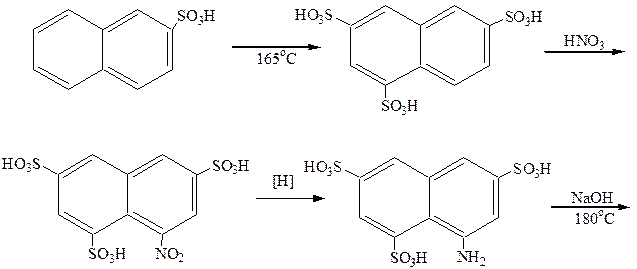
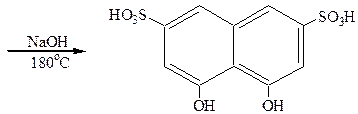
Хромотроповая кислота применяется для приготовления различных красителей. Дающих на ткани лаки с солями металлов. Азокраситель, полученный сочетанием диазотированного анилина с хромотроповой кислотой, окрашивает ткань в красный цвет по аммониевой протраве и в фиолетовый – по хромовой протраве.
АРОМАТИЧЕСКИЕ СПИРТЫ
Ароматическими спиртами называются ароматические углеводороды, которые содержат гидроксильную группу в боковой цепи. В зависимости от положения гидроксильной группы ароматические спирты, как и алифатические спирты, делятся на первичные, вторичные и третичные.
Первично-спиртовая группа – СН2ОН;
 Вторично-спиртовая группа – СНОН;
Вторично-спиртовая группа – СНОН;

Третично- спиртовая группа –
МЕТОДЫ ПОЛУЧЕНИЯ
1.Спирты с гидроксилом у соседнего с ядром углеродного атома (то есть в α-положении) легко получают гидролизом соответствующих галогенпроизводных при кратоковременном нагревании с раствором соды :

бензилхлорид бензиловый спирт
2.Спирты с гидроксилом в β-положении по отношению к ядру получают из ароматических углеводородов и оксидов:

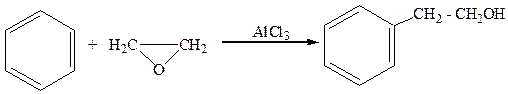
бензол окись этилена a-фенилэтиловый спирт
 (2-фенилэтанол)
(2-фенилэтанол)
3.Спирты с γ-положением гидроксила по отношению к ядру получают гидрированием непредельных ароматических спиртов или кислот:

коричная кислота a-фенилпропиловый спирт
(3-фенилпропанол)
4.Восстановление соответствующих альдегидов:

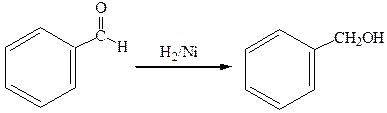
бензойный альдегид бензиловый спирт
5.Расщепление эфиров кислот металлическим натрием:
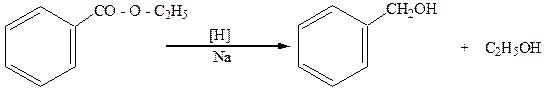
этиловый эфир бензойной кислоты
6.Непредельные ароматические спирты могут быть получены восстановлением соответствующих альдегидов:

коричный альдегид коричный спирт
ХИМИЧЕСКИЕ СВОЙСТВА
По химическим свойствам ароматические спирты очень похожи на предельные алифатические спирты:
1. В отличие от фенолов они не реагируют со щелочами, но дают алкоголяты (как и спирты жирнрго ряда) при действии щелочных металлов:
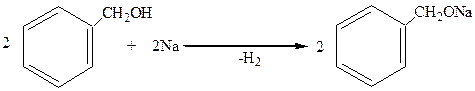
бензиловый спирт бензилат натрия
2. Образуют сложные эфиры с органическими кислотами:
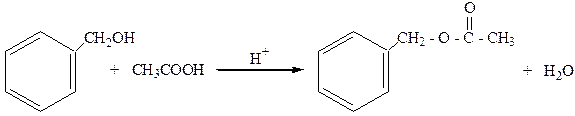
бензилацетат
3. Спирты с a-положением гидроксильной группы по отношению к ядру легко замещают гидроксил на галоген при действии галогеноводородных кислот:
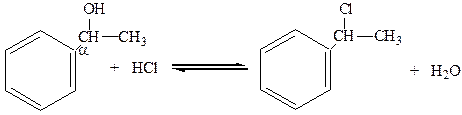
a-фенилэтиловый спирт 2-фенил-2-хлорпропан
4. Спирты с гидроксилом в в β-положении легко дегидратируются с образованием арилолефинов:
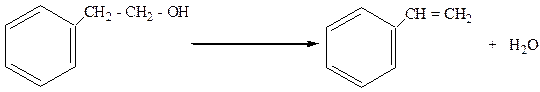
b-фенилэтиловый спирт стирол
ФЕНОЛОСПИРТЫ
В природе широко встречаются вещества, являющиеся одновременно спиртами и фенолами. Важнейшим из них является салигенин (2-оксиметилфенол):
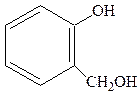
Он в виде глюкозида салицина содержится в листьях и коре ивы.
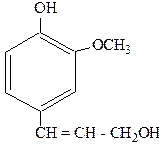
Конифериловый спирт, входящий в состав соков хвойных деревьев, имеет большое значение для построения лигнина (основная составная часть древесины). При окислении лигнина нитробензолом получают известную ароматизирующую добавку – ванилин (промышленный способ получения этого вещества).
ВЫСШИЕ СПИРТЫ. ВОСКИ
Высшими называются одноатомные высокомолекулярные спирты, углеродная цепочка которых имеет 14-30 атомов углерода (табл. 2).
Восками называются сложные эфиры высших жирных одноосновных и высших спиртов. Так, пчелиный воск содержит мирициловый эфир пальмитиновой кислоты С15Н31СО-О-С31Н63, а китайский воск – цериловый эфир церотиновой кислоты С25Н51СО-О-С26Н53.
Воски широко распространены в природе. В зависимости от происхождения различают растительные, животные, воски, вырабатываемые насекомыми, и ископаемые. Из растительных восков промышленное значение имеют воски, покрывающие листья пальм (карнаубский воск), воски липидов риса и подсолнечника. Из восков животного происхождения наибольшую роль играют спермацет и спермацетовое масло, шерстяной жир. Из восков насекомых наиболее употребителен пчелиный воск. Спермацет и спермацетовое масло выделяют из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Твердый кристаллический продукт белого цвета, состоящий главным образом из цетилового эфира пальмитиновой кислоты С17Н31СО-О-С16Н33, называется спермацетом. Жидкий продукт, оставшийся после его выделения, называется спермацетовым маслом.
“Шерстяной жир” – жиропот овечьей шерсти, от желтого до темно-коричневого цвета, с резким неприятным запахом. В шерсти овец содержится 5-6% “шерстяного жира”.
Таблица 2 | |||
ОСНОВНЫЕ ВЫСШИЕ СПИТРЫ
Номенклатура
Число углеводородных атомов
Формула
Пчелиный воск получают из пчелиных сот вытапливанием или экстракцией после удаления меда.
Ископаемые воски (горный воск, воск бурых углей) включает 70% сложных эфиров кислот и спиртов с числом атомов углерода больше 24.
В химическом отношении воски (особенно содержащие остатки насыщенных жирных кислот) отличаются значительной стойкостью; с трудом омыляются, устойчивы к действию кислорода воздуха.
Дата: 2019-04-23, просмотров: 674.