Таблица 1
2-метил-пропан
Бутан
Пропан
Название по систематиче-ской номен-клатуре
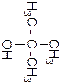
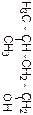
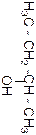
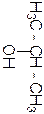
Формула
Одноатомные спирты
Номенклатура
tкип.оС
Плотность

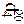
бутиловые, изобутиловый и третичный бутиловый спирты. Изомеры бутилового спирта отличаются между собой как строением углеродной цепи, так и положением гидроксильной группы в молекуле.
МЕТОДЫ ПОЛУЧЕНИЯ
Предельные одноатомные спирты можно получить следующими методами:
1. Окисление насыщенных углеводородов.
Алканы при каталитическом (например, солей марганца) окислении могут образовывать ряд кислородсодержащих соединений, в том числе и спирты.
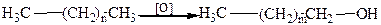 , где m < n.
, где m < n.
Этот метод имеет промышленное значение для получения высших жирных спиртов.
2. Гидролизом галогеналканов, который приводит к замещению атома галогена на гидроксильную группу.
 .
.
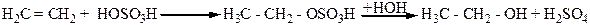 3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например:
3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например: 
4. Восстановлением альдегидов, кетонов, карбоновых кислот и сложных эфиров водородом в присутствии катализаторов (Ni, Pt, Pd).
Альдегиды, карбоновые кислоты и сложные эфиры при этом присоединяют водород и образуют первичные спирты, а кетоны в аналогичных условиях – вторичные спирты.
Как восстановители этих веществ используют также комплексные гидраты металлов, например литийалюминийгидрид (LiAlH4).
|
|
|
|
|
|

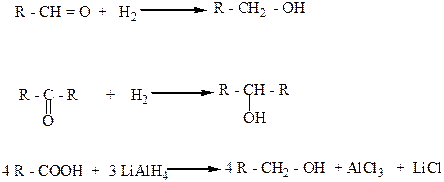
5. Взаимодействие альдегидов, кетонов, сложных эфиров с металлорганическими веществами, главным образом магнийорганическими (реактивами Гриньяра). При этом из муравьиного альдегида образуются первичные спирты, из других альдегидов – вторичные, а из кетонов и сложных эфиров – третичные спирты.
|
|
|
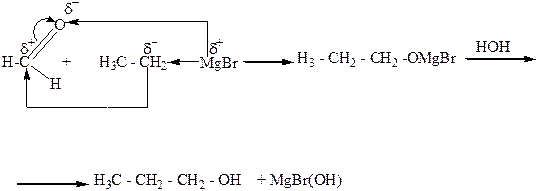

|
|
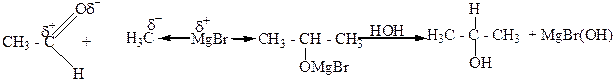
|
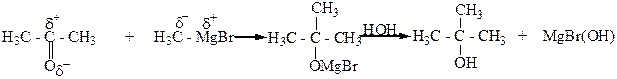
|
|
|
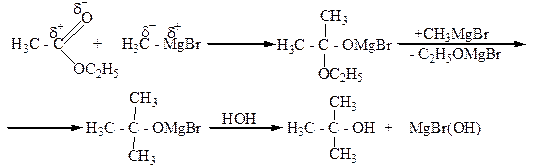
6.Щелочным или кислотным гидролизом сложных карбоновых кислот:

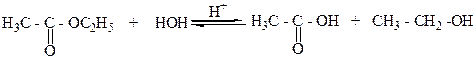
этилацетат уксусная кислота этанол
ФИЗИЧЕСКИЕ СВОЙСТВА.
Предельные одноатомные спирты от С1 до С10 в обычных условиях жидкости. Высшие спирты, начиная с С11 – твердые вещества. Все спирты легче воды. Их плотность меньше единицы. Низшие спирты, от С1 до С3, смешиваются с водой в любых соотношениях; спирты от С4 до С10 трудно растворяются в воде, а высшие спирты от в ней практически не растворяются. Запах низших спиртов алкогольный, начиная с С4 – неприятный. Высшие спирты запаха не имеют. Температура кипения спиртов повышается по мере увеличения их молекулярной массы (табл.1). Следует отметить, что температуры кипения спиртов значительно выше, чем температуры кипения соответствующих предельных углеводородов и их галогенпроизводных с таким же количеством углеродных атомов, как и в спирте. Например, этан кипит при -88,3оС, а бромистый этил С2Н5Br – при +38,0оС, а этиловый спирт С2Н5ОН - при +78,5оС, хотя молекулярная масса бромистого этила выше, чем этилового спирта. Такое повышение температуры кипения спиртов объясняется тем, что молекулы спирта, как и молекулы воды, хотя и в меньшей степени, являются ассоциированными и соединенными между собой водородными связями:

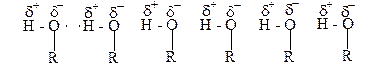
 Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
 Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
 Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол,
Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол,  образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
ХИМИЧЕСКИЕ СВОЙСТВА.
 Спирты являются высокореакционными соединениями благодаря присутствию в их молекуле функциональной группы ОН. В молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко вступают в разнообразные реакции.
Спирты являются высокореакционными соединениями благодаря присутствию в их молекуле функциональной группы ОН. В молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко вступают в разнообразные реакции.
 1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ
1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ
 Присутствие в молекулах спиртов гидроксильной группы обуславливает их кислотно-основные свойства. Поскольку атом кислорода этой группы более электроотрицателен, чем атомы углерода и водорода, то электронная плотность смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:
Присутствие в молекулах спиртов гидроксильной группы обуславливает их кислотно-основные свойства. Поскольку атом кислорода этой группы более электроотрицателен, чем атомы углерода и водорода, то электронная плотность смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:

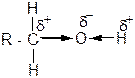
Поэтому в химических реакциях спирты могут отдавать протон и проявлять, таким образом, кислотные свойства. Кроме того, на атоме кислорода гидроксильной группы спирта есть свободные пары электронов. За счет этих электронов (в реакциях проявляет активность только одна электронная пара) спирты могут также присоединять протон к атому кислорода ОН-группы и проявлять при этом основные свойства. Таким образом, спирты. Согласно теории Бренстеда-Лоури, имеют кислотно-основные свойства.
Для спиртов существуют реакции, которые осуществляются как с участием атома водорода гидроксильной группы (кислотные свойства), так и с участием всей гидроксильной группы (основные свойства). Однако как кислотные, так и основные свойства у них выражены слабо. Поэтому растворы спиртов в воде нейтральны и не изменяют цвет индикаторов. Константа ионизации для метилового спирта приблизительно 1ּ10-17, для этилового спирта - 1ּ10-18, а для воды – 1,8ּ10-16, то есть спирты в сравнении с водой имеют более слабые кислотные свойства.
Дата: 2019-04-23, просмотров: 342.