Спирты, молекулы которых содержат две гидроксильные группы, называют двухатомными или гликолями. Общая формула двухатомных спиртов CnH2n(OH)2. Двухатомные спирты образуют гомологический ряд, который можно легко написать, используя гомологический ряд насыщенных углеводородов, заменяя в их молекуле два атома водорода на гидроксильные группы.
Первым и наиболее важным представителем двухатомных спиртов является этиленгликоль НОСН2-СН2ОН (Ткип.=197оС). Из него изготовляют антифриз.
Устойчивыми являются гликоли, в молекулах которых гидроксильные группы расположены возле разных углеродных атомов. Если две гидроксильные группы находятся возле одного углеродного атома, то такие двухатомные спирты неустойчивы, легко разлагаются, отщепляя за счет гидроксильных групп воду и превращаются в альдегиды или кетоны:
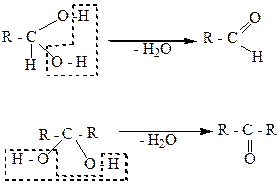
альдегид
кетон
НОМЕНКЛАТУРА
В зависимости от взаимного положения гидроксильных групп различают α-гликоли (у них гидроксильные группы расположены возле соседних углеродных атомов, которые стоят рядом, в положении 1,2), β-гликоли (ОН-группы у них расположены в положении 1,3), γ-гликоли (ОН-группы – в положении 1,4), δ-гликоли (ОН-группы – в положении 1,5) и т.д.
Например : α-гликоль - CH2OH-CHOH-CH2-CH3
β-гликоль - CH2OH-CH2-CHOH-CH3
γ-гликоль - CH2OH-CH2-CH2-CH2OH
По рациональной номенклатуре название α-гликолей образуют от названия соответствующего этиленового углеводорода, к которому добавляют слово гликоль. Например, этиленгликоль, пропиленгликоль и т.д.
По систематической номенклатуре название гликолей образуются от названия насыщенного углеводорода, к которому прибавляют суффикс –диол, указывая номера углеродных атомов. Возле которых находятся гидроксильные группы. Например, этиленгликоль СН2-ОН-СН2ОН по номенклатуре ИЮПАК – этандиол-1,2, а пропиленгликоль СН3-СНОН-СН2ОН – пропандиол-1,2.
ИЗОМЕРИЯ
Изомерия двухатомных спиртов зависит от строения углеродной цепи:
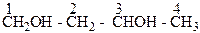
| бутанол-1,3 |
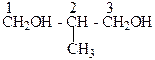
| 2-Метилпропандиол-1,3, а также от |
положения гидроксильных групп в молекуле спирта, например, пропандиол-1,2 и пропандиол-1,3.
МЕТОДЫ ПОЛУЧЕНИЯ
Гликоли можно получить следующими методами: 
1.Гидролиз дигалогенопроизводных насыщенных углеводородов:

2.Гидролиз галогеноспиртов:

3.Окисление этиленовых углеводородов перманганатом калия или надмуравьиной кислотой:
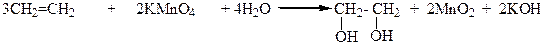
4.Гидратацией α-оксидов:
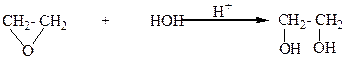
5.Бимолекулярным восстановлением карбонильных соединений:
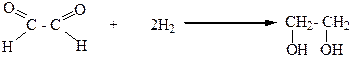
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства гликолей аналогичны свойствам одноатомных спиртов и определяется присутствием в их молекулах двух гидроксильных групп. Причем в реакциях могут принимать участие одна или обе гидроксильные группы. Однако вследствие взаимного влияния одной гидроксильной группы на другую (особенно у α-гликолей) кислотно-основные свойства гликолей несколько отличаются от аналогичных свойств одноатомных спиртов. В связи с тем, что гидроксил проявляет отрицательный индукционный эффект, одна гидроксильная группа оттягивает электронную плотность от другой аналогично тому, как это делает атом галогена в молекулах замещенных одноатомных спиртов. В результате такого влияния кислотные свойства двухатомных спиртов по сравнению с одноатомными повышаются:



 Н-О СН2 СН2 О Н
Н-О СН2 СН2 О Н
Поэтому гликоли, в отличие от одноатомных спиртов, легко вступают в реакцию не только со щелочными металлами, но и со щелочами и даже с гидроксидами тяжелых металлов. Со щелочными металлами, щелочами гликоли образуют полные и неполные алкоголяты (гликоляты):
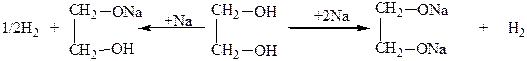
С гидроксидами некоторых тяжелых металлов, например с гидроксидом меди, гликоли образуют комплексные гликоляты. При этом нерастворимый в воде Cu(OH)2 в гликоле легко растворяется:
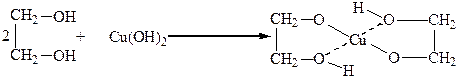
Медь в этом комплексе образует с атомами кислорода две ковалентные связи и две – координационные. Реакция является качественной на двухатомные спирты.
Гликоли могут образовывать полные и неполные простые и сложные эфиры. Так, при взаимодействии неполного гликолята щелочного металла с галоидными алкилами получают неполные простые эфиры, а из полного гликолята – полный простой эфир:
|
|

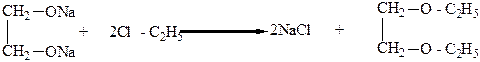
|
Метил- и этилцеллозольвы применяют в качестве растворителя в производстве лаков, бездымного пороха (пироксилина), ацетатного шелка и т.д.
С органическими и минеральными кислотами двухатомные спирты образуют два ряда сложных эфиров:
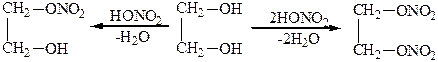
Мононитрат этиленгликоля Динитрат этиленгликоля
Динитрат этиленгликоля – сильное взрывчатое вещество, которое используют вместо нитроглицерина.
Окисление гликолей осуществляется ступенчато, с участием одной или обеих гидроксильных групп одновременно с образованием следующих продуктов:
|
|
|
|
|
|
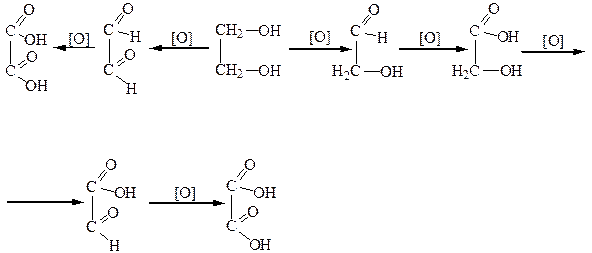
Двухатомные спирты вступают в реакцию дегидратации. Причем α-, β- и γ-гликоли, в зависимости от условий реакций, по-разному отщепляют воду. Отщепление воды от гликолей может осуществляться внутри- и межмолекулярно. Например:
Внутримолекулярное отщепление воды:
|
|
|
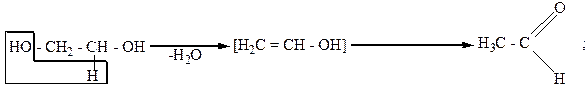
|
|
|
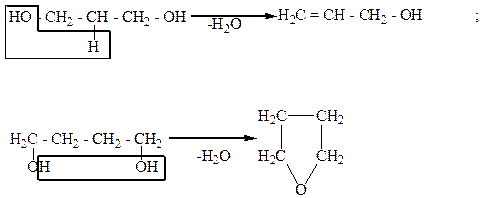
|
Межмолекулярное отщепление воды.
В 1906 г. А. Е. Фаворский, перегоняя этиленгликоль с серной кислотой, получил циклический простой эфир-диоксан:

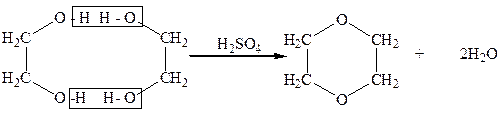
 Диоксан
Диоксан
Диоксан – жидкость, которая кипит при 101оС, смешивается с водой в любых соотношениях, применяется как растворитель и как полупродукт в некоторых синтезах.
При межмолекулярном отщеплении воды от гликолей могут образовываться оксиэфиры (спиртоэфиры), как, например, диэтиленгликоль:
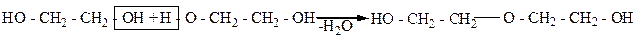
Диэтиленгликоль
 Диэтиленгликоль получают также взаимодействием этиленгликоля с оксидом этилена:
Диэтиленгликоль получают также взаимодействием этиленгликоля с оксидом этилена:
Диэтиленгликоль – жидкость с температурой кипения 245,5оС; используется как растворитель, для заполнения гидравлических приборов, а также в текстильной промышленности.
Широкое применение как хороший растворитель нашел диметиловый эфир диэтиленгликоля (диглим) Н3С-О-СН2-СН2-О-СН2-СН2-О-СН3.
|
|
|
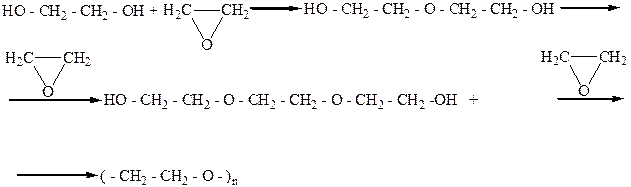 Полиэтиленгликоль
Полиэтиленгликоль
Полигликоли используются как компоненты разных синтетических моющих средств.
Широкое применение получили полиэфиры этиленгликоля с двухосновными кислотами, которые используются в производстве синтетических волокон, например лавсана (название „лавсан” образовано из начальных букв следующих слов – лаборатория высокомолекулярных соединений Академии наук):
|
|
|
|
|
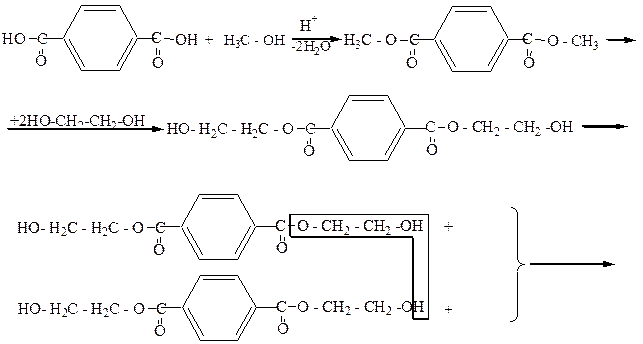
|
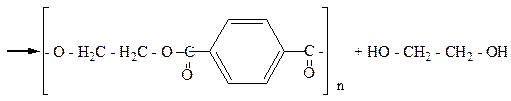
С метанолом терефталиевая кислота образует диметиловый эфир (диметилтерефталат, Ткип.=140оС), который далее путем переэтерификации превращается в этиленгликольтерефталат. При поликонденсации этиленгликольтерефталата образуется полиэтилентерефталат с молекулярной массой 15000-20000. Волокно лавсан не мнется, устойчиво к разным погодным условиям.
Дата: 2019-04-23, просмотров: 357.