Кафедра органической, физической и коллоидной химии
Дистанционное
Обучение
Хим.орг. – 1.22.2701.очн.плн. Хим.орг. – 1.22.2701.вчр.плн. Хим.орг. – 1.22.2701.зчн.скр. Хим.орг. – 1.22.2701.зчн.плн.
Хим.орг. – 1.22.2703.очн.плн. Хим.орг. – 1.22.2703.вчр.плн. Хим.орг. – 1.22.2703.зчн.скр. Хим.орг. – 1.22.2703.зчн.плн.
Хим.орг. – 1.22.2704.очн.плн. Хим.орг. – 1.22.2704.вчр.плн. Хим.орг. – 1.22.2704.зчн.скр. Хим.орг. – 1.22.2704.зчн.плн.
Хим.орг. – 1.22.2705.очн.плн. Хим.орг. – 1.22.2705.вчр.плн. Хим.орг. – 1.22.2705.зчн.скр . Хим.орг. – 1.22.2705.зчн.плн.
Хим.орг. – 1.22.2707.очн.плн. Хим.орг. – 1.22.2707.вчр.плн. Хим.орг. – 1.22.2707.зчн.скр. Хим.орг. – 1.22.2707.зчн.плн.
Хим.орг. – 1.22.2708.очн.плн. Хим.орг. – 1.22.2708.вчр.плн. Хим.орг. – 1.22.2708.зчн.скр. Хим.орг. – 1.22.2708.зчн.плн.
Хим.орг. – 1.22.2710.очн.плн. Хим.орг. – 1.22.2710.вчр.плн. Хим.орг. – 1.22.2710.зчн.скр. Хим.орг. – 1.22.2710.зчн.плн.
Хим.орг. – 1.22.2712.очн.плн. Хим.орг. – 1.22.2712.вчр.плн. Хим.орг. – 1.22.2712.зчн.скр. Хим.орг. – 1.22.2712.зчн.плн.
Хим.орг. – 1.22.0135.очн.плн. Хим.орг. – 1.22.0135.вчр.плн. Хим.орг. – 1.22.0135.зчн.скр. Хим.орг. – 1.22.0135.зчн.плн.
Хим.орг. – 1.22.3117.очн.плн. Хим.орг. – 1.22.3117.вчр.плн. Хим.орг. – 1.22.3117.зчн.скр. Хим.орг. – 1.22.3117.зчн.плн.
В.А. Домбровский, В.С. Падалкина,
А.М. Евтушенко, И.Г. Крашенинникова
ОРГАНИЧЕСКАЯ ХИМИЯ
СПИРТЫ, ФЕНОЛЫ И НАФТОЛЫ.
Учебно-практическое пособие для студентов технологических специальностей, всех
форм обучения

www.msta . ru
Москва - 2004 4130
УДК: 547
© Домбровский В.А., Падалкина В.С., Евтушенко А.М., Крашенинникова И.Г. Органическая химия. Спирты, фенолы и нафтолы: Учебно-практическое пособие. – М., МГУТУ, 2004.
Учебное пособие содержит материал по разделу «Спирты», а также по разделам «Фенолы», Нафтолы». Указаны способы получения, химические свойства и применение. Для закрепления материала даны контрольные вопросы и тесты.
Пособие предназначено для студентов технологических специальностей 2, 3 курсов всех форм обучения.
Авторы: Домбровский Владимир Андреевич, Падалкина Валентина Стефановна, Евтушенко Анатолий Михайлович, Крашенинникова Ирина Геннадьевна.
Рецензенты: Профессор, д.х.н. каф. «Синтез полимеров» МГАТХТ им. М.В. Ломоносова Прокопов Н.И..
Доцент, к.х.н. каф. «Органической химии» МГУПБ Фонский Д.Ю.
Редактор: Свешникова Н.И.
© Московский государственный университет технологий и управления, 2004
109004, Москва, Земляной вал,73.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.. 4
1. АЛКАНОЛЫ (СПИРТЫ) 4
1.1. КЛАССИФИКАЦИЯ.. 4
1.2. ОДНОАТОМНЫЕ СПИРТЫ. 5
1.3. НОМЕНКЛАТУРА. 5
1.4. ИЗОМЕРИЯ.. 5
1.5. МЕТОДЫ ПОЛУЧЕНИЯ.. 7
1.6. ФИЗИЧЕСКИЕ СВОЙСТВА. 9
1.7. ХИМИЧЕСКИЕ СВОЙСТВА. 10
 1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ.. ..10
1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ.. ..10
1.7.2. РЕАКЦИИ С УЧАСТИЕМ ВОДОРОДА ГИДРОКСИЛЬНОЙ ГРУППЫ... 10
1.7.3. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ ГИДРОКСИЛЬНОЙ ГРУППЫ... 12
1.7.4. РЕАКЦИЯ С ГАЛОГЕНОВОДОРОДАМИ.. 12
1.7.5. ВЗАИМОДЕЙСТВИЕ С ГАЛОИДНЫМИ СОЕДИНЕНИЯМИ ФОСФОРА И С ХЛОРИСТЫМ ТИОНИЛОМ... 14
1.7.6. РЕАКЦИЯ ЭТЕРИФИКАЦИИ.. 15
1.7.7. ДЕГИДРАТАЦИЯ СПИРТОВ.. 15
1.7.8. ПРАВИЛО ЗАЙЦЕВА.. 16
1.7.9. АЛКИЛИРОВАНИЕ СПИРТОВ.. 16
1.7.10. ОКИСЛЕНИЕ СПИРТОВ.. 17
1.7.11. ИДЕНТИФИКАЦИЯ СПИРТОВ.. 19
1.7.12. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ.. 19
1.8. ВЫСШИЕ СПИРТЫ... 21
2.НЕПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ... 22
3. ДВУХАТОМНЫЕ СПИРТЫ (ГЛИКОЛИ) 24
3.1. НОМЕНКЛАТУРА.. 25
3.2. ИЗОМЕРИЯ.. 25
3.3. МЕТОДЫ ПОЛУЧЕНИЯ.. 25
3.4. ХИМИЧЕСКИЕ СВОЙСТВА.. 26
3.4.1. ПЕРЕГРУППИРОВКА 1,2-ГЛИКОЛЕЙ.. 30
4. ТРЕХАТОМНЫЕ СПИРТЫ (ГЛИЦЕРИН) 31
4.1. МЕТОДЫ ПОЛУЧЕНИЯ.. 31
4.2. ХИМИЧЕСКИЕ СВОЙСТВА.. 32
4.2.1. ДИХЛОРГИДРИНЫ ГЛИЦЕРИНА.. 33
5. ФЕНОЛЫ... 34
5.1. МЕТОДЫ ПОЛУЧЕНИЯ ОДНОАТОМНЫХ ФЕНОЛОВ.. 35
5.2. ХИМИЧЕСКИЕ СВОЙСТВА.. 35
5.2.1. РЕАКЦИИ ПО ГИДРОКСИЛЬНОЙ ГРУППЕ.. 36
5.2.2. РЕАКЦИИ АРОМАТИЧЕСКОГО ЯДРА.. 37
6. НАФТОЛЫ... 40
7. АРОМАТИЧЕСКИЕ СПИРТЫ... 42
7.1. МЕТОДЫ ПОЛУЧЕНИЯ.. 42
7.2. ХИМИЧЕСКИЕ СВОЙСТВА.. 43
8. ФЕНОЛОСПИРТЫ... 44
9. ВЫСШИЕ СПИРТЫ. ВОСКИ.. 45
10. ПРИМЕНЕНИЕ В ПИЩЕВЫХ БИОТЕХНОЛОГИЯХ.. 46
ВОПРОСЫ И УПРАЖНЕНИЯ ДЛЯ САМОКОНТРОЛЯ.. 48
ТЕСТ ПО ТЕМЕ.. 499
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ... 550
ВВЕДЕНИЕ
Трудно назвать объекты народного хозяйства, где бы ни использовались органические соединения, содержащие одну или несколько гидроксильных групп. Например, этиловый спирт используется для получения синтетического каучука, уксусной кислоты, органических красителей, диэтилового эфира, сложных эфиров (фруктовых эссенций), фармацевтических препаратов и т.д. Этанол – прекрасный растворитель. Для органической химии он имеет такое же значение, как для неорганической химии – вода. Используют этиловый спирт также в парфюмерии, пищевой промышленности.
Спирты с длинными цепями встречаются в восках растений и найдены в насекомых и некоторых животных. Например, фенетиловый спирт PhCH2CH2OH является главным летучим компонентом розового масла, цетиловый спирт С16Н33ОН в виде эфира пальмитиновой кислоты найден в спермацете, а мирициловый спирт С30Н61ОН присутствует в воске. Большой интерес, проявляемый в последнее время к ненасыщенным спиртам, во многом обусловлен изучением феромонов насекомых (стимуляторов поведения).
В данном учебном пособии изложен материал по строению, свойствам и нахождению в природе одно-, двух-, трехатомных алифатических и ароматических спиртов.
Даны тестовые вопросы и упражнения для самостоятельной работы, приведен список рекомендуемой литературы.
Применение отдельных спиртов в пищевой промышленности выделено в отдельный раздел.
АЛКАНОЛЫ (СПИРТЫ)
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на соответствующее количество гидроксильных групп – ОН. Спирты называют еще алкоголятами (от арабского ,,алкоголь” – спирт).
КЛАССИФИКАЦИЯ
Спирты классифицируют по количеству гидроксильных групп, которые содержатся в его молекуле, а также по характеру его углеродного атома (первичного, вторичного, третичного), с которым соединена гидроксильная группа. Количество гидроксильных групп в молекуле спирта называют его атомностью. По атомности спирты разделяют на одно-, двух-, трех- и многоатомные. Одноатомные спирты имеют одну гидроксильную группу, двухатомные – две, трехатомные – три гидроксильные группы и т.д. Спирты, которые имеют четыре и больше гидроксильных групп, называют многоатомными. Примером одноатомного спирта является этиловый спирт Н3С-СН2-ОН, двухатомного – этиленгликоль НО-СН2-СН2-ОН, трехатомного – глицерин СН2(ОН)-СН(ОН)-СН2-ОН, многоатомного – гексит СН2(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН2-ОН.
В зависимости от того, с каким углеродным атомом – первичным, вторичным или третичным – соединена гидроксильная группа, различают первичные, вторичные и третичные спирты. Например, первичный бутиловый спирт Н3С – СН2 – СН2 – СН2 – ОН, вторичный бутиловый спирт Н3С – СН2 – СН(ОН) – СН3, третичный бутиловый спирт (Н3С)3С – ОН. Ознакомление с классом спиртов начнем с простейших – насыщенных (предельных) одноатомных спиртов, которые имеют общую формулу CnH2n+1 – OH.
ОДНОАТОМНЫЕ СПИРТЫ.
Одноатомные спирты образуют гомологический ряд, который можно легко записать, используя гомологический ряд насыщенных (предельных) углеводородов, заменяя в них один атом водорода на гидроксильную группу (табл.1).
НОМЕНКЛАТУРА.
Одноатомные спирты называют по исторической (тривиальной или эмпирической), рациональной и систематической (международной или ИЮПАК) номенклатурам (табл.1). По исторической номенклатуре название одноатомного спирта происходит от названия радикала, с которым соединена гидроксильная группа. Например, метиловый спирт, этиловый спирт, пропиловый спирт и т.д. По рациональной номенклатуре спирты рассматривают как замещенные самого простого из спиртов – метилового, который называют карбинолом. Например, метилкарбинол, этилкарбинол и т. д. По систематической номенклатуре название спирта образуют от названия соответствующего предельного углеводорода, прибавляя к нему суффикс – ол. Положение гидроксильной группы обозначают номером атома углерода, возле которого она расположена. Углеводородную цепь нумеруют так, чтобы атом углерода с гидроксильной группой имел наименьшее числовое значение. Например:
|
|

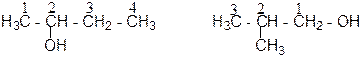
Некоторые спирты имеют еще эмпирические названия, которые связаны с историей открытия или получения этого спирта из того или другого природного продукта. Например, метиловый спирт часто называют древесным, поскольку его получают сухой перегонкой древесины, этиловый спирт называют винным, поскольку его впервые обнаружили в виноградном вине и длительное время получали перегонкой вина. Отсюда пошло и латинское название этого спирта – Spiritus Vini - ,,дух вина”.
1.4. ИЗОМЕРИЯ
Изомерия спиртов может быть обусловлена разветвлением углеводородной цепи ее молекулы, положением гидроксильной группы в этой цепи, а также конформацией. Первые два члена гомологического ряда спиртов (табл. 1) - метиловый Н3С-ОН и этиловый Н3С-СН2-ОН – изомеров не имеют. Пропиловый спирт существует в виде двух изомеров – первичного и вторичного (изо-)пропилового спирта. Легко заметить, что эти спирты отличаются один от другого положением гидроксильной группы в молекуле. У бутилового спирта четыре изомера (табл. 1) – первичный и вторичный
|
| Н3С – СН2 – СН2 – СН3 | Н3С – СН2 – СН3 | Н3С – СН3 | СН4 | 1 | Формула | Насыщенные (предельные) углеводороды | |||||
|
|
|
|
|
|

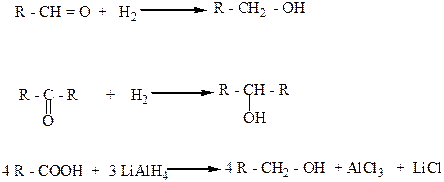
5. Взаимодействие альдегидов, кетонов, сложных эфиров с металлорганическими веществами, главным образом магнийорганическими (реактивами Гриньяра). При этом из муравьиного альдегида образуются первичные спирты, из других альдегидов – вторичные, а из кетонов и сложных эфиров – третичные спирты.
|
|
|
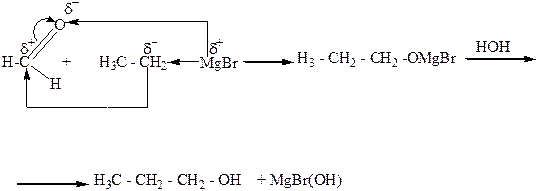

|
|
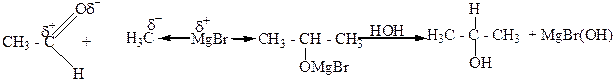
|
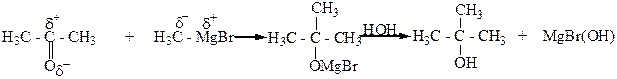
|
|
|
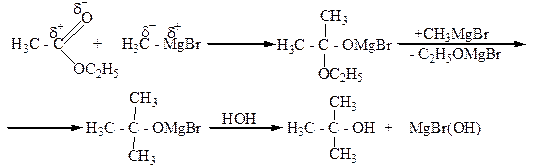
6.Щелочным или кислотным гидролизом сложных карбоновых кислот:

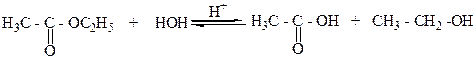
этилацетат уксусная кислота этанол
ФИЗИЧЕСКИЕ СВОЙСТВА.
Предельные одноатомные спирты от С1 до С10 в обычных условиях жидкости. Высшие спирты, начиная с С11 – твердые вещества. Все спирты легче воды. Их плотность меньше единицы. Низшие спирты, от С1 до С3, смешиваются с водой в любых соотношениях; спирты от С4 до С10 трудно растворяются в воде, а высшие спирты от в ней практически не растворяются. Запах низших спиртов алкогольный, начиная с С4 – неприятный. Высшие спирты запаха не имеют. Температура кипения спиртов повышается по мере увеличения их молекулярной массы (табл.1). Следует отметить, что температуры кипения спиртов значительно выше, чем температуры кипения соответствующих предельных углеводородов и их галогенпроизводных с таким же количеством углеродных атомов, как и в спирте. Например, этан кипит при -88,3оС, а бромистый этил С2Н5Br – при +38,0оС, а этиловый спирт С2Н5ОН - при +78,5оС, хотя молекулярная масса бромистого этила выше, чем этилового спирта. Такое повышение температуры кипения спиртов объясняется тем, что молекулы спирта, как и молекулы воды, хотя и в меньшей степени, являются ассоциированными и соединенными между собой водородными связями:

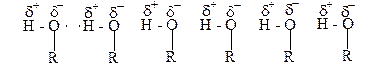
 Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
Электроотрицательный атом кислорода, который имеет еще и свободные электронные пары, одной молекулы спирта притягивает атом водорода гидроксила другой молекулы спирта, на котором есть заряд δ+. Такое межмолекулярное взаимодействие приводит к ассоциации молекул спирта, что является причиной высокой температуры кипения этих веществ. Чем меньше алкильных групп окружает гидроксил в молекуле спирта, тем легче проявляются водородные связи и тем в большей мере осуществляется ассоциация молекул спирта, а отсюда, тем выше температура кипения спирта. Поэтому первичные спирты кипят при более высокой температуре, чем изомерные ему вторичные, а третичные спирты по этой же причине имеют ещё более низкую температуру кипения (табл.1). Таким образом, спирты с нормальным строением кипят при более высокой температуре, чем спирты с разветвлённой углеродной цепочкой.
 Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
Энергия водородных связей намного меньше, чем энергия обычной ковалентной связи, и равняется 20,934-41,868 кДж/моль, в то время как энергия обычной связи О-Н составляет 456,36 кДж/моль. Во время кипения все водородные связи разрушаются.
 Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол,
Молекулы спиртов полярны и имеют дипольные моменты. Например, дипольный момент метилового спирта равняется 1,69 D. Валентный угол, 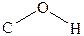 образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
образованный связями атома кислорода в молекуле спирта, , составляет 110о25/.
ХИМИЧЕСКИЕ СВОЙСТВА.
 Спирты являются высокореакционными соединениями благодаря присутствию в их молекуле функциональной группы ОН. В молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко вступают в разнообразные реакции.
Спирты являются высокореакционными соединениями благодаря присутствию в их молекуле функциональной группы ОН. В молекулах спиртов содержатся полярные связи О – Н и С – О, которые легко вступают в разнообразные реакции.
 1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ
1.7.1. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА СПИРТОВ
 Присутствие в молекулах спиртов гидроксильной группы обуславливает их кислотно-основные свойства. Поскольку атом кислорода этой группы более электроотрицателен, чем атомы углерода и водорода, то электронная плотность смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:
Присутствие в молекулах спиртов гидроксильной группы обуславливает их кислотно-основные свойства. Поскольку атом кислорода этой группы более электроотрицателен, чем атомы углерода и водорода, то электронная плотность смещается от этих атомов к кислороду. Связи О – Н и С – О поляризуются:

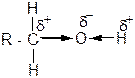
Поэтому в химических реакциях спирты могут отдавать протон и проявлять, таким образом, кислотные свойства. Кроме того, на атоме кислорода гидроксильной группы спирта есть свободные пары электронов. За счет этих электронов (в реакциях проявляет активность только одна электронная пара) спирты могут также присоединять протон к атому кислорода ОН-группы и проявлять при этом основные свойства. Таким образом, спирты. Согласно теории Бренстеда-Лоури, имеют кислотно-основные свойства.
Для спиртов существуют реакции, которые осуществляются как с участием атома водорода гидроксильной группы (кислотные свойства), так и с участием всей гидроксильной группы (основные свойства). Однако как кислотные, так и основные свойства у них выражены слабо. Поэтому растворы спиртов в воде нейтральны и не изменяют цвет индикаторов. Константа ионизации для метилового спирта приблизительно 1ּ10-17, для этилового спирта - 1ּ10-18, а для воды – 1,8ּ10-16, то есть спирты в сравнении с водой имеют более слабые кислотные свойства.
РЕАКЦИЯ ЭТЕРИФИКАЦИИ
Спирты вступают в реакцию с минеральными и органическими кислотами. Продуктами такого взаимодействия являются соответствующие сложные эфиры. Если в реакцию со спиртами вступает многоосновная кислота, то в зависимости от соотношения кислоты и спирта, введенных в реакцию, могут образовываться или кислые, или сложные эфиры:
|
|
|
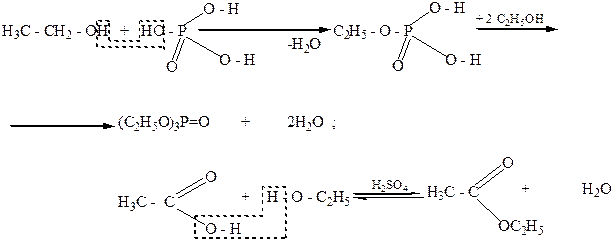
ДЕГИДРАТАЦИЯ СПИРТОВ
Дегидратация спиртов может осуществляется в двух направлениях: внутримолекулярно и межмолекулярно. Направление дегидратации зависит от природы спирта и условий проведения реакции.
При внутримолекулярной дегидратации спирта образуется ненасыщенный этиленовый углеводород, в результате межмолекулярной дегидратации – простой эфир. Так, при нагревании спиртов с такими водоотнимающими веществами, как концентрированная H2SO4, H3PO4, безводная щавелевая кислота, оксид алюминия и т.д., образуются ненасыщенные соединения этиленового ряда.
Реакционная способность спиртов к дегидратации, то есть к образованию из них этиленовых соединений, изменяется в таком порядке:
третичные спирты > вторичные спирты >первичные спирты
Некоторые третичные спирты дегидратируются настолько легко, что их можно перегнать только в случае, если предотвратить попадание в них даже лабораторного воздуха, который содержит в незначительных количествах пары кислот.
Дегидратация спиртов в присутствии концентрированной H2SO4 в зависимости от температуры, соотношения объемов спирта и кислоты может осуществляться с образованием разных продуктов. Например, этиловый спирт при 105оС образует с серной кислотой кислый сложный эфир – этилсерную кислоту (реакция 1). При избытке спирта и более высокой температуре (130 –140оС) осуществляется межмолекулярная дегидратация, главным продуктом которой является диэтиловый эфир (простой эфир; реакция 2). При температуре выше 160оС этилсерная кислота разлагается с образованием этилена (реакция 3):
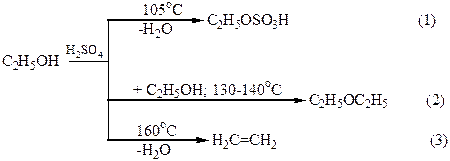
ПРАВИЛО ЗАЙЦЕВА
А.М.Зайцев (1875 г.) установил, что при отщеплении воды от спиртов образуются наиболее алкилированные этиленовые углеводороды (правило Зайцева). Например, при дегидратации 3-метилбутанола-2 отщепление воды осуществляется за счет гидроксила и атома водорода, который находится у соседнего наименее гидрогенизованного β-углеродного атома. В результате образуется 2-метилбутен-2:
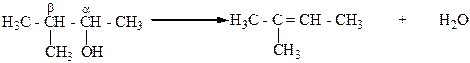
Отщепление воды от спиртов по правилу Зайцева связано с образованием в ходе реакции промежуточных наиболее устойчивых карбкатионов, которые потом превращаются в наиболее алкилированные этиленовые углеводороды, термодинамически более устойчивые, чем менее алкилированные алкены.
Спирты легко дегидратируются и в газовой фазе над нагретым оксидом алюминия или пористой глиной. Например, из этилового спирта по этому методу получают этилен с высоким выходом:
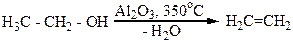
АЛКИЛИРОВАНИЕ СПИРТОВ
Алкилированием называют реакции введения в молекулы органических веществ алкильных радикалов. При введении алкильного радикала в молекулу спирта вместо атома водорода ОН-группы получают простые эфиры. Алкилировать спирты можно спиртами, как это осуществляется при их межмолекулярной дегидратации:
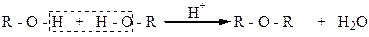
Можно алкилировать спирты галоидными алкилами. Однако спирты являются слабыми нуклеофилами и с галоидными алкилами реагируют чрезвычайно медленно. Если реакцию галоидных алкилов проводить не со спиртами, а с алкоголятами, то простые эфиры образуются быстрее, поскольку алкоголят-ионы – сильные нуклеофилы и алкилирование в этом случае осуществляется очень активно:

метилэтиловый эфир
Алкилировать алкоголяты можно и диалкилсульфатами:

Взаимодействие алкоголятов с алкилгалогенидами является общим методом получения простых эфиров, известным под названием „синтеза Вильямсона”.
Реакция алкоголятов с галогеналкилами осуществляется по SN2 – механизму:
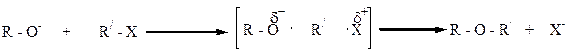
ОКИСЛЕНИЕ СПИРТОВ
Спирты при 300-400оС и в присутствии медных и других катализаторов окисляются кислородом воздуха. Такие окислители, как KMnO4, хромовая смесь, окисляют спирты уже при комнатной температуре. В зависимости от того, какой это спирт – первичный, вторичный или третичный – при окислении образуются разные продукты.
Первичные спирты при окислении дают альдегиды с таким же количеством углеродных атомов, как и в молекуле исходного спирта. Альдегиды в этих условиях могут окисляться в карбоновые кислоты. Чтобы избежать дальнейшего окисления, альдегиды необходимо быстро выводить из реакционной смеси:
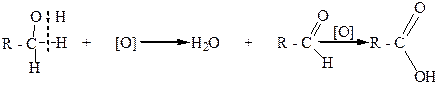
альдегид карбоновая кислота
Окисление спиртов хромовой смесью сопровождается изменением оранжево-красного окрашивания реакционной смеси (ионы Cr2O72-) на зеленое (ионы Cr3+):

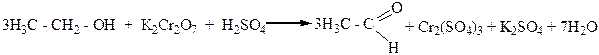
Первичные спирты можно также окислить в альдегиды мелко раздробленной медью. Нагретой до 280-300оС. В этих условиях от молекулы спирта отщепляются два атома водорода и в молекуле органического вещества, которая при этом образуется, появляется двойная связь углерод – кислород (>C=O). Такое превращение спиртов называется дегидрированием:
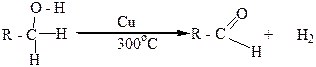
Вторичные спирты при окислении, а также при дегидрировании, превращаются в кетоны:
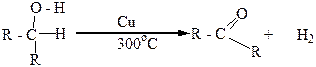
Например, втор-пропиловый спирт в этих условиях превращается в кетон, который называют ацетоном:
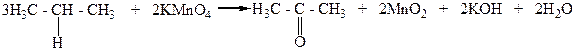
Диметилкетон
(ацетон)
Третичные спирты окисляются достаточно трудно с одновременным разрывом углеродной цепи их молекул и образования смеси карбоновых кислот и кетонов. Такое окисление этих спиртов связано с тем, что в условиях реакции окисления они дегидратируются и превращаются в этиленовые углеводороды, которые в присутствии сильного окислителя окисляются с разрывом молекулы по месту двойной С=C - связи.
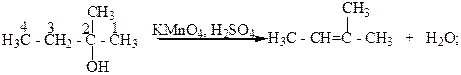
2- Метилбутанол-2 2-Метилбутен-2.
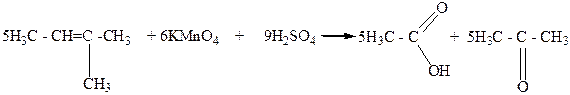
Уксусная Диемтилкетон
кислота (ацетон)
Таким образом, по продуктам окисления спиртов можно сделать вывод о строении спиртов.
ИДЕНТИФИКАЦИЯ СПИРТОВ
Спирты можно отличить от других классов органических веществ по цветной реакции с оксидом хрома (IV) в среде серной кислоты. Хромовый ангидрид CrO3 в водном растворе H2SO4 окисляет первичные и вторичные спирты, на протяжении приблизительно двух секунд прозрачный оранжевый раствор реакционной смеси становится голубовато-зеленым и мутнеет. Третичные спирты этой реакции не дают.
Для того, чтобы установить, каким является данный спирт – первичным, вторичным или третичным пользуются пробой Лукаса. Эта проба основана на разной реакционной способности спиртов относительно галогеноводородов. Спирты, молекулы которых содержат не больше шести углеродных атомов, растворяются в реактиве Лукаса, который представляет собой смесь концентрированной соляной кислоты и хлорида цинка. При растворении спирта в этом реактиве образуются соответствующие алкилхлориды, раствор мутнеет, поскольку алкилхлориды в реактиве Лукаса не ратсворяются. Время, необходимое для появления помутнения реактива Лукаса, является мерой реакционной способности спирта. Третичные спирты реагируют с реактивом Лукаса сразу же, вторичные спирты – на протяжении 5 минут, а первичные спирты прикомнатной температуре с этим реактивом почти не взаимодействуют.
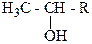 Этиловый спирт и спирты общей формулы взаимодействуют
Этиловый спирт и спирты общей формулы взаимодействуют
в щелочной среде с иодом и образуют иодоформ CHJ3 (иодоформная реакция). По способности давать иодоформную реакцию можно отличить данные спирты от других спиртов:
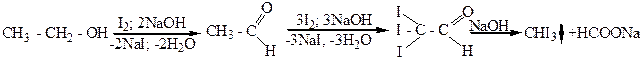
этиловый уксусный трииодуксусный иодоформ имеет
спирт альдегид альдегид неприятный запах
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Метиловый спирт, карбинол или древесный спирт, или метанол Н3С-ОН известен с 1834 г. Он представляет собой прозрачную жидкость со специфическим запахом, который напоминает запах этилового спирта. Смешивается с водой во всех соотношениях. Основным промышленным методом его получения является гидрирование оксида углерода (II), которое осуществляется под давлением в присутствии катализаторов (ZnO,Cr2O3) и температуре 400оС:
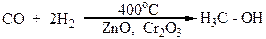
Раньше метиловый спирт получали сухой перегонкой древесины, отсюда его название „древесный спирт”.
Метиловый спирт широко используется в промышленности для получения формальдегида, органических красителей, фармацевтических препаратов и как растворитель лаков и политур. Его используют для введения метильной группы в различные органические соединения.
При работе с метиловым спиртом следует помнить, что он чрезвычайно ядовит !!! Попадание в организм нескольких граммов (~10 мл) метилового спирта вызывает слепоту, а несколько большие количества (~30 мл) – смерть. В связи с этим метиловый спирт используют только для технических нужд. На склянке с веществом следует обязательно делать надпись “Метанол – Яд ”.
Этиловый спирт (этанол) Н3С-СН2-ОН – бесцветная жидкость с характерным запахом. С водой этанол смешивается во всех соотношениях, с ней он образует азеотропную смесь состава: 95,57% спирта и 4,43% воды. Данную смесь нельзя разделить фракционной перегонкой. В процессе очистки (ректификации), которую проводят тщательной фракционной перегонкой, Получают 95% спирт – ректификат. Для получения безводного (абсолютного) спирта водный спирт нагревают в течение продолжительного времени с CaO, с безводным CuSO4 и другими веществами, которые химически связывают присутствующую в спирте воду. Обезводить этанол с помощью безводного CaCl2 не удается, поскольку спирт с хлоридом кальция образует комплекс CaCl2·4C2H5OH.
В технике и лабораторной практике концентрация этилового спирта равна объемной доле, выраженной в процентах или градусах. Концентрация спирта в градусах определяется ареометром (спиртометром), градуированным специальным образом.
Этиловый спирт – многотоннажный продукт химической промышленности. По объему производства он занимает первое место среди других органических продуктов. Его получают разными методами. Один из них – спиртовое брожение сахаристых веществ, например, глюкозы, в присутствии дрожжей:
|
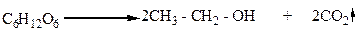
Глюкоза
Необходимая для этого процесса глюкоза или содержится в готовом виде, например в виноградном соке, или ее получают гидролизом крахмала. Спирт, полученный этим методом, называют винным, или пищевым. Крахмал содержится в таких продуктах, как пшеница, жито, ячмень, кукуруза, рис, картофель. В наше время для производства этанола для технических нужд пищевые продукты полностью заменены не пищевыми. Так, крахмал был заменен клетчаткой (целлюлозой), которая в больших количествах содержится в отходах деревообрабатывающей, целлюлозной и лесной промышленности (опилки, стружки, ветки, мусор и т.д.). Клетчатку сначала гидролизуют :
| |||
| |||
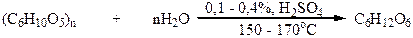
Полученную таким образом глюкозу подвергают брожению. Этиловый спирт, полученный этим методом, называют гидролизным. Гидролизный метод получения этанола более выгодный, поскольку дает возможность экономить большое количество пищевых продуктов. Из 1 т. опилок можно получить до 200 кг этанола. Однако гидролизный спирт содержит примеси, в том числе и ядовитый метанол, поэтому его используют только для технических нужд.
Широкое применение в промышленности получил метод получения этилового спирта путем гидратации этилена в присутствии H2SO4 или H3PO4:
H2C=CH2 + HOH 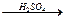 H3C – CH2 - OH
H3C – CH2 - OH
Этиловый спирт нашел широкое применение. Трудно назвать отрасль народного хозяйства, где бы не применялся этанол. Во-первых, он используется для получения синтетического каучука, уксусной кислоты, органических красителей, диэтилового эфира, сложных эфиров, пахучих веществ (фруктовые эссенции), фармацевтических препаратов и т.д. Этиловый спирт проявляет антисептические свойства и используется в медицине, в частности в хирургии для обеззараживания хирургических инструментов, рук хирурга, операционного поля.
Этанол – прекрасный растворитель. Для органической химии он имеет такое же значение, как для неорганической химии – вода. Применяют этиловый спирт также в парфюмерии, пищевой промышленности.
Этиловый спирт в небольших дозах вызывает опьянение, а в больших – вызывает состояние, близкое к наркозу, с общей нечувствительностью, которое может закончиться смертью. Таким образом, по действию на организм этиловый спирт является наркотиком и может вызывать заболевание, известное под названием алкоголизм.
ВЫСШИЕ СПИРТЫ
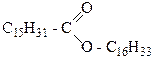 В природе встречаются цетиловый C16H33-OH (гексадеканол-1) и мирициловый C31H63-OH (триаконтанол-1). Первый из них в виде сложного эфира пальмитиновой кислоты составляет часть спермацета, который выделяют
В природе встречаются цетиловый C16H33-OH (гексадеканол-1) и мирициловый C31H63-OH (триаконтанол-1). Первый из них в виде сложного эфира пальмитиновой кислоты составляет часть спермацета, который выделяют
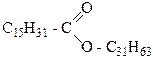 из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Спермацет используется как высококачественная смазка для прецизионных инструментов, а также в парфюмерной и текстильной промышленности. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Спермацет используется как высококачественная смазка для прецизионных инструментов, а также в парфюмерной и текстильной промышленности. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
НОМЕНКЛАТУРА
В зависимости от взаимного положения гидроксильных групп различают α-гликоли (у них гидроксильные группы расположены возле соседних углеродных атомов, которые стоят рядом, в положении 1,2), β-гликоли (ОН-группы у них расположены в положении 1,3), γ-гликоли (ОН-группы – в положении 1,4), δ-гликоли (ОН-группы – в положении 1,5) и т.д.
Например : α-гликоль - CH2OH-CHOH-CH2-CH3
β-гликоль - CH2OH-CH2-CHOH-CH3
γ-гликоль - CH2OH-CH2-CH2-CH2OH
По рациональной номенклатуре название α-гликолей образуют от названия соответствующего этиленового углеводорода, к которому добавляют слово гликоль. Например, этиленгликоль, пропиленгликоль и т.д.
По систематической номенклатуре название гликолей образуются от названия насыщенного углеводорода, к которому прибавляют суффикс –диол, указывая номера углеродных атомов. Возле которых находятся гидроксильные группы. Например, этиленгликоль СН2-ОН-СН2ОН по номенклатуре ИЮПАК – этандиол-1,2, а пропиленгликоль СН3-СНОН-СН2ОН – пропандиол-1,2.
ИЗОМЕРИЯ
Изомерия двухатомных спиртов зависит от строения углеродной цепи:
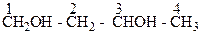
| бутанол-1,3 |
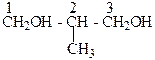
| 2-Метилпропандиол-1,3, а также от |
положения гидроксильных групп в молекуле спирта, например, пропандиол-1,2 и пропандиол-1,3.
МЕТОДЫ ПОЛУЧЕНИЯ
Гликоли можно получить следующими методами: 
1.Гидролиз дигалогенопроизводных насыщенных углеводородов:

2.Гидролиз галогеноспиртов:

3.Окисление этиленовых углеводородов перманганатом калия или надмуравьиной кислотой:
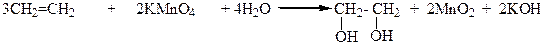
4.Гидратацией α-оксидов:
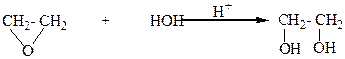
5.Бимолекулярным восстановлением карбонильных соединений:
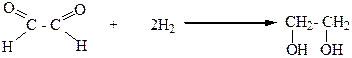
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства гликолей аналогичны свойствам одноатомных спиртов и определяется присутствием в их молекулах двух гидроксильных групп. Причем в реакциях могут принимать участие одна или обе гидроксильные группы. Однако вследствие взаимного влияния одной гидроксильной группы на другую (особенно у α-гликолей) кислотно-основные свойства гликолей несколько отличаются от аналогичных свойств одноатомных спиртов. В связи с тем, что гидроксил проявляет отрицательный индукционный эффект, одна гидроксильная группа оттягивает электронную плотность от другой аналогично тому, как это делает атом галогена в молекулах замещенных одноатомных спиртов. В результате такого влияния кислотные свойства двухатомных спиртов по сравнению с одноатомными повышаются:



 Н-О СН2 СН2 О Н
Н-О СН2 СН2 О Н
Поэтому гликоли, в отличие от одноатомных спиртов, легко вступают в реакцию не только со щелочными металлами, но и со щелочами и даже с гидроксидами тяжелых металлов. Со щелочными металлами, щелочами гликоли образуют полные и неполные алкоголяты (гликоляты):
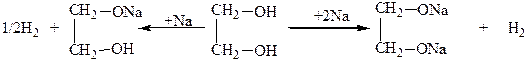
С гидроксидами некоторых тяжелых металлов, например с гидроксидом меди, гликоли образуют комплексные гликоляты. При этом нерастворимый в воде Cu(OH)2 в гликоле легко растворяется:
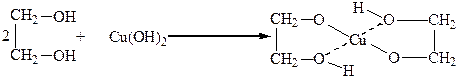
Медь в этом комплексе образует с атомами кислорода две ковалентные связи и две – координационные. Реакция является качественной на двухатомные спирты.
Гликоли могут образовывать полные и неполные простые и сложные эфиры. Так, при взаимодействии неполного гликолята щелочного металла с галоидными алкилами получают неполные простые эфиры, а из полного гликолята – полный простой эфир:
|
|

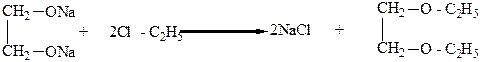
|
Метил- и этилцеллозольвы применяют в качестве растворителя в производстве лаков, бездымного пороха (пироксилина), ацетатного шелка и т.д.
С органическими и минеральными кислотами двухатомные спирты образуют два ряда сложных эфиров:
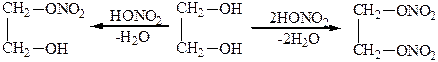
Мононитрат этиленгликоля Динитрат этиленгликоля
Динитрат этиленгликоля – сильное взрывчатое вещество, которое используют вместо нитроглицерина.
Окисление гликолей осуществляется ступенчато, с участием одной или обеих гидроксильных групп одновременно с образованием следующих продуктов:
|
|
|
|
|
|
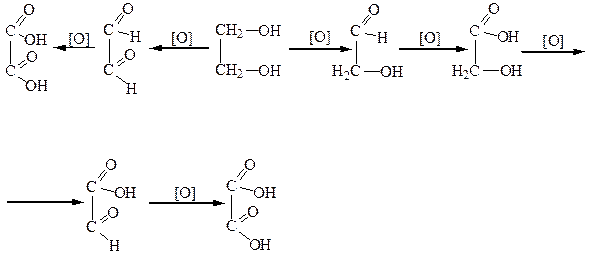
Двухатомные спирты вступают в реакцию дегидратации. Причем α-, β- и γ-гликоли, в зависимости от условий реакций, по-разному отщепляют воду. Отщепление воды от гликолей может осуществляться внутри- и межмолекулярно. Например:
Внутримолекулярное отщепление воды:
|
|
|
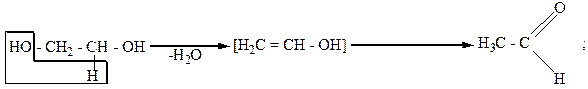
|
|
|
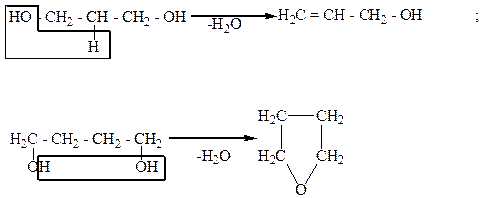
|
Межмолекулярное отщепление воды.
В 1906 г. А. Е. Фаворский, перегоняя этиленгликоль с серной кислотой, получил циклический простой эфир-диоксан:

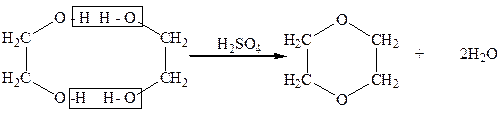
 Диоксан
Диоксан
Диоксан – жидкость, которая кипит при 101оС, смешивается с водой в любых соотношениях, применяется как растворитель и как полупродукт в некоторых синтезах.
При межмолекулярном отщеплении воды от гликолей могут образовываться оксиэфиры (спиртоэфиры), как, например, диэтиленгликоль:
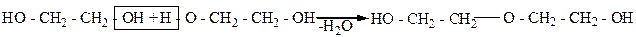
Диэтиленгликоль
 Диэтиленгликоль получают также взаимодействием этиленгликоля с оксидом этилена:
Диэтиленгликоль получают также взаимодействием этиленгликоля с оксидом этилена:
Диэтиленгликоль – жидкость с температурой кипения 245,5оС; используется как растворитель, для заполнения гидравлических приборов, а также в текстильной промышленности.
Широкое применение как хороший растворитель нашел диметиловый эфир диэтиленгликоля (диглим) Н3С-О-СН2-СН2-О-СН2-СН2-О-СН3.
|
|
|
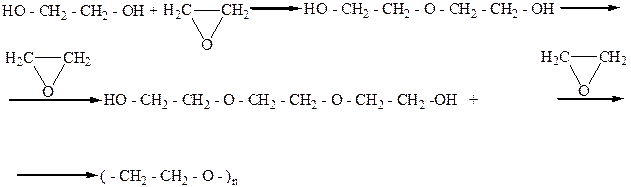 Полиэтиленгликоль
Полиэтиленгликоль
Полигликоли используются как компоненты разных синтетических моющих средств.
Широкое применение получили полиэфиры этиленгликоля с двухосновными кислотами, которые используются в производстве синтетических волокон, например лавсана (название „лавсан” образовано из начальных букв следующих слов – лаборатория высокомолекулярных соединений Академии наук):
|
|
|
|
|
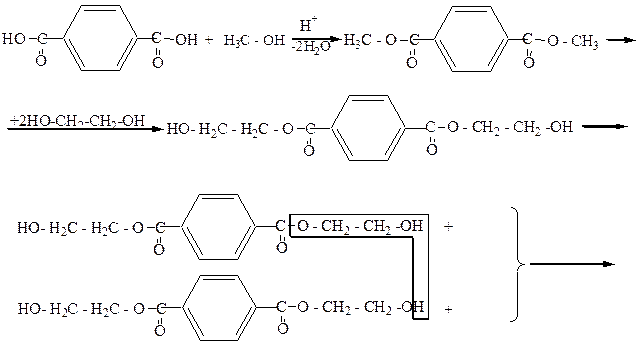
|
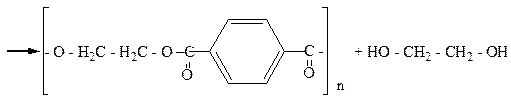
С метанолом терефталиевая кислота образует диметиловый эфир (диметилтерефталат, Ткип.=140оС), который далее путем переэтерификации превращается в этиленгликольтерефталат. При поликонденсации этиленгликольтерефталата образуется полиэтилентерефталат с молекулярной массой 15000-20000. Волокно лавсан не мнется, устойчиво к разным погодным условиям.
МЕТОДЫ ПОЛУЧЕНИЯ
1. Глицерин получают гидролизом (омылением жиров), который осуществляется в присутствии воды под влиянием кислот, щелочей или ферментов (например, липазы). В результате гидролиза жиры расщепляются на глицерин и соответствующие высшие карбоновые кислоты:
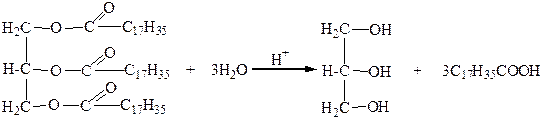
2. Синтезом из пропилена, который включает несколько стадий:
Аллиловый спирт
Хлористый аллил
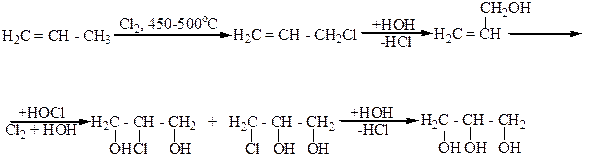
Монохлоргидрины глицерина
ХИМИЧЕСКИЕ СВОЙСТВА
Химические свойства глицерина аналогичны свойствам этиленгликоля и обусловлены присутствием в его молекуле трех гидроксильных групп. Благодаря взаимному влиянию гидроксильных групп кислотные свойства выражены более сильно по сравнению с одноатомными спиртами. Степень диссоциации глицерина приблизительно в 10 раз больше, чем у метилового спирта. Вследствие этого глицерин легко образует глицераты (алкоголяты) не только со щелочными металлами, но и со щелочами, и с гидроксидами железа, меди, кальция, бария и др. металлов. При этом нерастворимые в воде гидроксиды, например гидроксид меди, растворяются. Растворение Cu(OH)2 осуществляется с образованием комплексного соединения (глицерата меди) характерного синего цвета:
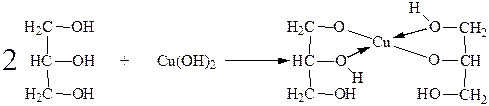
Глицерат меди
Эта реакция является качественной на глицерин и другие многоатомные спирты, с помощью этой реакции можно отличить от одноатомных. Поскольку одноатомные спирты с Cu(OH)2 не взаимодействуют.
Следует отметить, что способность этиленгликоля, глицерина и других многоатомных спиртов растворять Cu(OH)2 связана не только с повышением их кислотности, но также со способностью этих спиртов образовывать внутрикомплексные высокоустойчивые соединения.
Глицерин может вступать в реакцию с галогеноводородами (HCl, HBr). При этом в его молекуле одна или две гидроксильные группы замещается на галоген и образуются галогеноспирты, которые называют галогеногидринами глицерина:
Дихлоргидрины глицерина
Монохлоргидрины глицерина
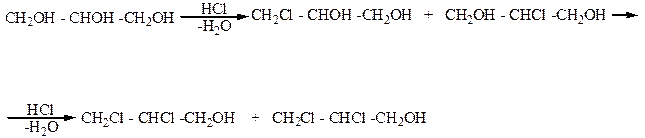
ДИХЛОРГИДРИНЫ ГЛИЦЕРИНА
Органические и минеральные кислоты образуют с глицерином сложные эфиры. В зависимости от количества введенной в реакцию кислоты образуются полные или неполные сложные эфиры. Например, при достаточном колическтве HNO3 образуется полный эфир азотной кислоты – тринитрат глицерина, который часто не совсем верно называют нитроглицерином:
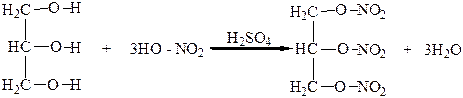
Тринитрат глицерина – взрывчатое вещество и используется для приготовления динамита. Тринитрат глицерина ядовит, однако в небольших количествах он расширяет кровеносные сосуды сердца. Поэтому его используют в медицине для лечения стенокардии.
Глицерин может образовывать полные и неполные сложные эфиры и с органическими кислотами, например с уксусной:
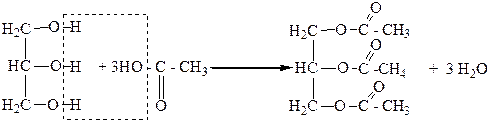
Глицеринтриацетат
Взаимодействие глицерина с высшими карбоновыми кислотами приводит к образованию сложных эфиров, которые называют жирами:
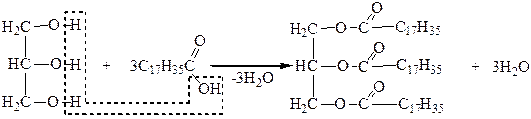
|
|
Глицерин, как и другие спирты, легко окисляется. Причем окислению могут подвергаться одна, две или все три гидроксильные группы. Первичные гидроксильные группы окисляются в альдегидные, а потом в карбоксильные группы. Вторичная ОН-группа окисляется в кетонную. Состав продуктов окисления зависит от природы окислителя.
При окислении глицерина можно получить такие вещества:
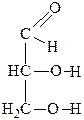
| 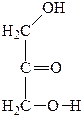
| 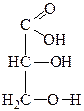
| 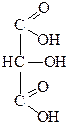
| 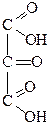
|
| Глицериновый альдегид | Диоксиацетон | Глицериновая кислота | Тартроновая кислота | Мезоксалевая кислота |
ФЕНОЛЫ
Фенолами называются гидроксильные производные ароматических углеводородов, у которых один или более атомов водорода бензольного кольца замещены гидроксильной группой.
В зависимости от количества гидроксильных групп фенолы делятся на одно-, двух- и трехатомные.
Простейшим фенолом является одноатомный фенол, или как его принято называть „карболовая кислота” C6H5OH. Из двух атомных фенолов или дигидроксибензолов большое значение имеют следующие:
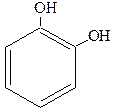
| 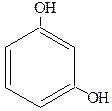
| 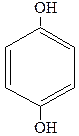
|
| Пирокатехин Орто-дигидроксибензол (1,2-дигидроксибензол) | Резорцин Мета-дигидроксибензол (1,3-дигидроксибензол) | Гидроксихинон Пара-дигидроксибензол (1,4-дигидроксибензол) |
Существуют и трехатомные фенолы, как, например, порогаллол, флоро-глюцин и гидроксигидрохинон:
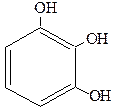
| 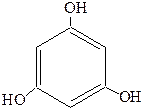
| 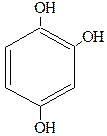
|
| Пирогаллол (1,2,3-тригидроксибензол) рядовой изомер | Флороглюцин (1,3,5-тригидроксибензол) симметричный изомер | Гидроксигидрохинон (1,2,4-тригидроксибензол) несимметричный изомер |
ХИМИЧЕСКИЕ СВОЙСТВА
Важнейшим свойством фенолов, отличающих их от спиртов, является их кислотность. Кислотные свойства фенолов обусловлены той относительной легкостью, с которой фенол теряет протон:
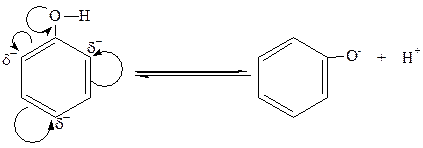
феноксид-ион
В фенольном гидроксиле свободная пара электронов атома кислорода взаимодействует с π-электронами бензольного кольца, сдвигаясь в сторону кольца. Атом кислорода,поскольку его отрицательный заряд уменьшается, а положительный несколько увеличивается, сильнее притягивает к себе электронную пару атома водорода гидроксильной группы. Это облегчает отщепление водорода в виде протона, то есть процесс диссоциации. Однако кислотные свойства фенола все же слабее, что следует из сравнения констант диссоциации Kд фенола и самой слабой минеральной кислоты-угольной (H2CO3): KдH2CO3 =4,9·10-7; KдС6Н5ОН = 1,3∙10-10.
Из сопоставления данных констант видно, что KдС6Н5ОН примерно в 3300 раз меньше, чем KдH2CO3. Тем не менее, кислотные свойства ощутимо сильнее, чем у алифатических спиртов, так как последние не реагируют с NaOH, а фенолы с этим веществом взаимодействуют.
Поскольку фенолы имеют ароматическое ядро и одну или несколько ОН-групп, для них характерны два основных типа реакций;
- по гидроксильной группе;
- по ароматическому ядру.
РЕАКЦИИ АРОМАТИЧЕСКОГО ЯДРА
1.Галогенирование.
При действии галогенов, даже бромной воды (Br2+H2O), три атома водорода в ядре очень легко замещаются, давая тригалогензамещенные фенолы:
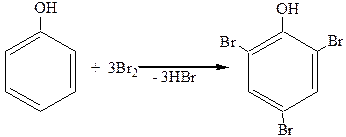
2,4,6-трибромфенол
2. Нитрование.
Фенолы легко нитруются. При действии даже очень разбавленной HNO3 получается смесь орто- и пара-нитрофенолов:
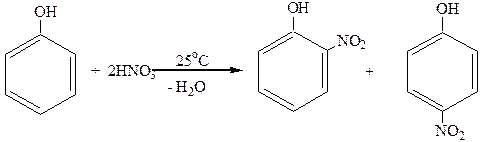
о-нитрофенол п-нитрофенол
NO2Å –сильная электрофильная частица. Она способствует в большей степени диссоциации атома водорода в гидроксильной группе. Введение второй NO2-группы требует уже кипячения с концентрированной HNO3:
|
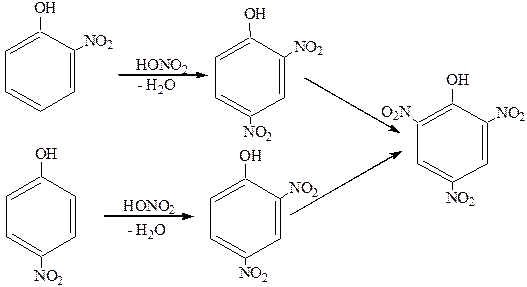
Для получения 2,4,6-тринитрофенола (пикриновой кислоты) нужно использовать смесь HNO3 и H2SO4 или 2-3 суток кипятить в концентрированной азотной кислоте.
3. Сульфирование.
Фенолы легко сульфируются:
|
|
|
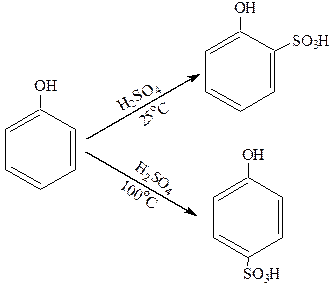
2. Алкилирование (по Фриделю-Крафтсу):
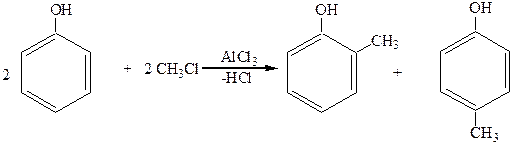
о-крезол п-крезол
3. Поликонденсация:
|

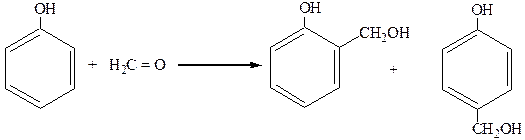
о-оксибензиловый п-оксибензиловый
спирт спирт
далее идет конденсация с выделением воды:
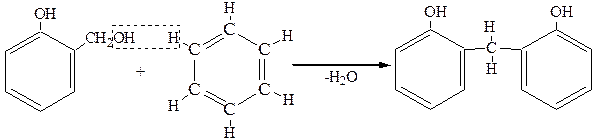
В итоге образуется сетчатая структура (фенольно-формальдегидные смолы):

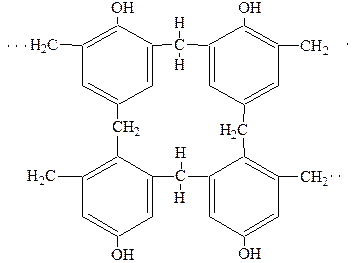
6.Окисление.
При энергичном окислении образуются хиноны:
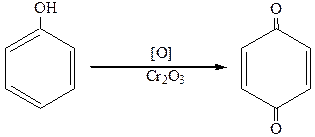
п-бензохинон
7.Восстановление.
Восстановление фенола в присутствии катализаторов дает циклогексанол:
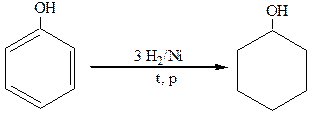
фенол циклогексанол
НАФТОЛЫ
Нафтолами называются гидроксипроизводные нафталина. Различают a и β-нафтолы. Они могут быть получены всеми обычными методами получения фенолов.
Промышленным способом их получения является сплавление с щелочами натриевых солей сульфокислот:
|
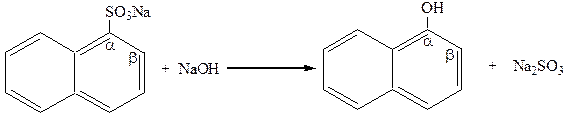
натриевая соль a-нафтол
a-нафталинсульфокислоты
|
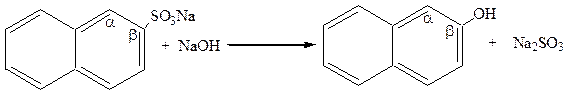
натриевая соль b-нафтол
b-нафталинсульфокислоты
Оба нафтола – кристаллические вещества. β-нафтол имеет более высокую температуру плавления. Оба вещества трудно растворяются в воде, хорошо – в едких щелочах.
Реакции замещения нафтолов идут сначала в том ядре, где находится гидроксигруппа. При галогенировании. Нитровании и сульфировании a-нафтола получается п-производные, например:
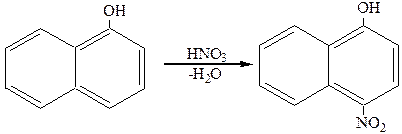
4-нитронафтол
В случае β-нафтола вступление нового заместителя идет только в α-положение, например:

1-нитронафтол
Нафтолы применяют как вторые компоненты в реакциях азосочетания.
Эфиры нафтолов обладают приятным запахом. Метиловый эфир β-нафтола применяется в парфюмерии.
Динитро-a-нафтол применяется как желтый краситель. Он легко получается нитрованием a-нафтола:
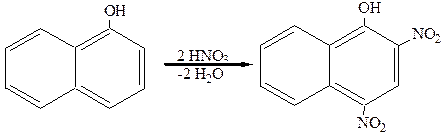
Из дигидроксипроизводных нафталина наибольший интерес представляет 1,8-дигидрокси-3,6-нафталиндисульфокислота (хромотроповая кислота). Синтез ее осуществляется по следующей схеме:
|
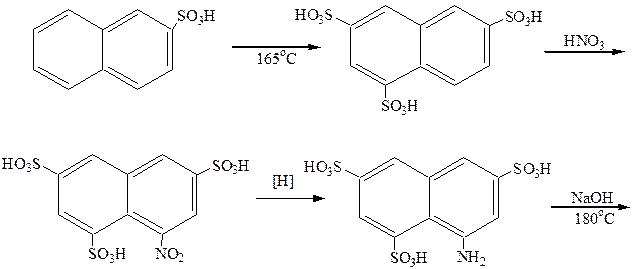
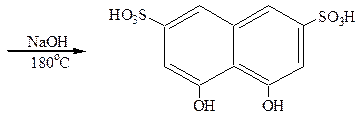
Хромотроповая кислота применяется для приготовления различных красителей. Дающих на ткани лаки с солями металлов. Азокраситель, полученный сочетанием диазотированного анилина с хромотроповой кислотой, окрашивает ткань в красный цвет по аммониевой протраве и в фиолетовый – по хромовой протраве.
АРОМАТИЧЕСКИЕ СПИРТЫ
Ароматическими спиртами называются ароматические углеводороды, которые содержат гидроксильную группу в боковой цепи. В зависимости от положения гидроксильной группы ароматические спирты, как и алифатические спирты, делятся на первичные, вторичные и третичные.
Первично-спиртовая группа – СН2ОН;
 Вторично-спиртовая группа – СНОН;
Вторично-спиртовая группа – СНОН;

Третично- спиртовая группа –
МЕТОДЫ ПОЛУЧЕНИЯ
1.Спирты с гидроксилом у соседнего с ядром углеродного атома (то есть в α-положении) легко получают гидролизом соответствующих галогенпроизводных при кратоковременном нагревании с раствором соды :

бензилхлорид бензиловый спирт
2.Спирты с гидроксилом в β-положении по отношению к ядру получают из ароматических углеводородов и оксидов:

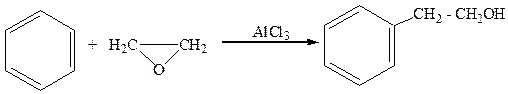
бензол окись этилена a-фенилэтиловый спирт
 (2-фенилэтанол)
(2-фенилэтанол)
3.Спирты с γ-положением гидроксила по отношению к ядру получают гидрированием непредельных ароматических спиртов или кислот:

коричная кислота a-фенилпропиловый спирт
(3-фенилпропанол)
4.Восстановление соответствующих альдегидов:

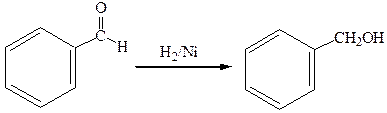
бензойный альдегид бензиловый спирт
5.Расщепление эфиров кислот металлическим натрием:
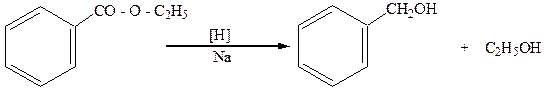
этиловый эфир бензойной кислоты
6.Непредельные ароматические спирты могут быть получены восстановлением соответствующих альдегидов:

коричный альдегид коричный спирт
ХИМИЧЕСКИЕ СВОЙСТВА
По химическим свойствам ароматические спирты очень похожи на предельные алифатические спирты:
1. В отличие от фенолов они не реагируют со щелочами, но дают алкоголяты (как и спирты жирнрго ряда) при действии щелочных металлов:
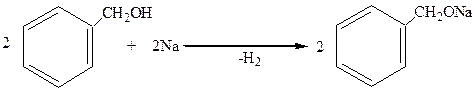
бензиловый спирт бензилат натрия
2. Образуют сложные эфиры с органическими кислотами:
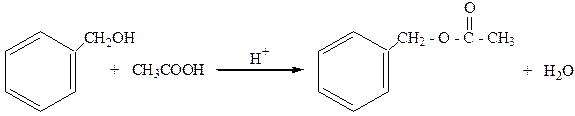
бензилацетат
3. Спирты с a-положением гидроксильной группы по отношению к ядру легко замещают гидроксил на галоген при действии галогеноводородных кислот:
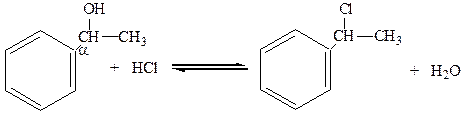
a-фенилэтиловый спирт 2-фенил-2-хлорпропан
4. Спирты с гидроксилом в в β-положении легко дегидратируются с образованием арилолефинов:
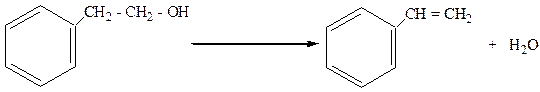
b-фенилэтиловый спирт стирол
ФЕНОЛОСПИРТЫ
В природе широко встречаются вещества, являющиеся одновременно спиртами и фенолами. Важнейшим из них является салигенин (2-оксиметилфенол):
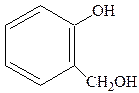
Он в виде глюкозида салицина содержится в листьях и коре ивы.
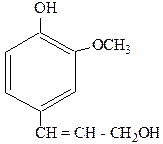
Конифериловый спирт, входящий в состав соков хвойных деревьев, имеет большое значение для построения лигнина (основная составная часть древесины). При окислении лигнина нитробензолом получают известную ароматизирующую добавку – ванилин (промышленный способ получения этого вещества).
ВЫСШИЕ СПИРТЫ. ВОСКИ
Высшими называются одноатомные высокомолекулярные спирты, углеродная цепочка которых имеет 14-30 атомов углерода (табл. 2).
Восками называются сложные эфиры высших жирных одноосновных и высших спиртов. Так, пчелиный воск содержит мирициловый эфир пальмитиновой кислоты С15Н31СО-О-С31Н63, а китайский воск – цериловый эфир церотиновой кислоты С25Н51СО-О-С26Н53.
Воски широко распространены в природе. В зависимости от происхождения различают растительные, животные, воски, вырабатываемые насекомыми, и ископаемые. Из растительных восков промышленное значение имеют воски, покрывающие листья пальм (карнаубский воск), воски липидов риса и подсолнечника. Из восков животного происхождения наибольшую роль играют спермацет и спермацетовое масло, шерстяной жир. Из восков насекомых наиболее употребителен пчелиный воск. Спермацет и спермацетовое масло выделяют из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Твердый кристаллический продукт белого цвета, состоящий главным образом из цетилового эфира пальмитиновой кислоты С17Н31СО-О-С16Н33, называется спермацетом. Жидкий продукт, оставшийся после его выделения, называется спермацетовым маслом.
“Шерстяной жир” – жиропот овечьей шерсти, от желтого до темно-коричневого цвета, с резким неприятным запахом. В шерсти овец содержится 5-6% “шерстяного жира”.
Таблица 2 | |||
ОСНОВНЫЕ ВЫСШИЕ СПИТРЫ
Номенклатура
Число углеводородных атомов
Формула
Пчелиный воск получают из пчелиных сот вытапливанием или экстракцией после удаления меда.
Ископаемые воски (горный воск, воск бурых углей) включает 70% сложных эфиров кислот и спиртов с числом атомов углерода больше 24.
В химическом отношении воски (особенно содержащие остатки насыщенных жирных кислот) отличаются значительной стойкостью; с трудом омыляются, устойчивы к действию кислорода воздуха.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
1. Петров А.А., Бальян Х.Б., Трощенко А.Г. Органическая химия, - Санкт-Перетбург.: “Иван Федоров”, 2002.
2. Перекалин В.В., Зонис С.А. Органическая химия.-М.: Просвещение, 1982.
3. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. – М.: Химия, 1970, т. 1, 2.
4. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М.: Медицина, 1985.
5. Росивал Л., Энгет Р., Соколай А. Посторонние вещества и пищевые добавки в продуктах. – М.: Высшая школа, 1991.
6. Скурихин И.М., Нечаев А.П. Все о пище с точки зрения химика. – М.: Высшая школа, 1991.
7. Теддер Дж., Нехватал А., Джубб А. Промышленная органическая химия. – М.: Мир, 1997.
Для замечаний
Домбровский Владимир Андреевич, Падалкина Валентина Стефановна,
Евтушенко Анатолий Михайлович, Крашенинникова Ирина Геннадьевна.
Спирты, фенолы и нафтолы.
Учебно-практическое пособие
Подписано к печати:
Тираж: 100
Заказ №
Кафедра органической, физической и коллоидной химии
Дистанционное
Обучение
Хим.орг. – 1.22.2701.очн.плн. Хим.орг. – 1.22.2701.вчр.плн. Хим.орг. – 1.22.2701.зчн.скр. Хим.орг. – 1.22.2701.зчн.плн.
Хим.орг. – 1.22.2703.очн.плн. Хим.орг. – 1.22.2703.вчр.плн. Хим.орг. – 1.22.2703.зчн.скр. Хим.орг. – 1.22.2703.зчн.плн.
Хим.орг. – 1.22.2704.очн.плн. Хим.орг. – 1.22.2704.вчр.плн. Хим.орг. – 1.22.2704.зчн.скр. Хим.орг. – 1.22.2704.зчн.плн.
Хим.орг. – 1.22.2705.очн.плн. Хим.орг. – 1.22.2705.вчр.плн. Хим.орг. – 1.22.2705.зчн.скр . Хим.орг. – 1.22.2705.зчн.плн.
Хим.орг. – 1.22.2707.очн.плн. Хим.орг. – 1.22.2707.вчр.плн. Хим.орг. – 1.22.2707.зчн.скр. Хим.орг. – 1.22.2707.зчн.плн.
Хим.орг. – 1.22.2708.очн.плн. Хим.орг. – 1.22.2708.вчр.плн. Хим.орг. – 1.22.2708.зчн.скр. Хим.орг. – 1.22.2708.зчн.плн.
Хим.орг. – 1.22.2710.очн.плн. Хим.орг. – 1.22.2710.вчр.плн. Хим.орг. – 1.22.2710.зчн.скр. Хим.орг. – 1.22.2710.зчн.плн.
Хим.орг. – 1.22.2712.очн.плн. Хим.орг. – 1.22.2712.вчр.плн. Хим.орг. – 1.22.2712.зчн.скр. Хим.орг. – 1.22.2712.зчн.плн.
Хим.орг. – 1.22.0135.очн.плн. Хим.орг. – 1.22.0135.вчр.плн. Хим.орг. – 1.22.0135.зчн.скр. Хим.орг. – 1.22.0135.зчн.плн.
Хим.орг. – 1.22.3117.очн.плн. Хим.орг. – 1.22.3117.вчр.плн. Хим.орг. – 1.22.3117.зчн.скр. Хим.орг. – 1.22.3117.зчн.плн.
Дата: 2019-04-23, просмотров: 426.
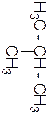
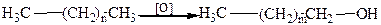 , где m < n.
, где m < n. .
.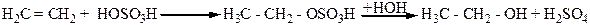 3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например:
3. Гидратацией этиленовых углеродов в присутствии таких катализаторов, как Н2SО4, H3PO4 и т.д. Реакция проходит через стадию присоединения минеральных кислот к алкену с образованием сложного эфира минеральной кислоты, который при гидролизе дает спирт и соответственно минеральную кислоту. Например: