Галоидные соединения фосфора при действии спирта легко замещают их гидроксильную группу на галоген :
3R – OH + PCl3 → 3R – Cl + H3PO3;
R – OH + PCl5→ R – Cl + HCl + POCl3.
При взаимодействии PCl3 с первичными спиртами в качестве побочного прдукта образуется сложный эфир фосфористой кислоты :
3R – OH + PCl3 → (RO)3P + HCl
Для реакции со спиртами можно брать не готовые PBr3и PJ3, а вводить в реакционную смесь отдельно фосфор и галоген. В этом случае со спиртами реагируют галогениды фосфора в момент их образования:
2P + 3I2 = 2PI3; 3R – OH + PI3 → 3R – I + H3PO3
Хлорпроизводные с высоким выходом получают при действии на спирты хлористого тионила SOCl2 :
R – OH + SOCl2 → R – Cl + HCl↑ + SO2↑.
В этом случае образуются газообразные HCl и SO2, которые легко отделяются от галогеналкана.
Считают, что спирт сначала взаимодействует с SOCl2 и образует алкилхлорсульфит (1), который затем образует внутреннюю ионную пару (II), а она далее разлагается с сохранением конфигурации:

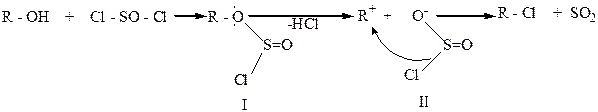
РЕАКЦИЯ ЭТЕРИФИКАЦИИ
Спирты вступают в реакцию с минеральными и органическими кислотами. Продуктами такого взаимодействия являются соответствующие сложные эфиры. Если в реакцию со спиртами вступает многоосновная кислота, то в зависимости от соотношения кислоты и спирта, введенных в реакцию, могут образовываться или кислые, или сложные эфиры:
|
|
|
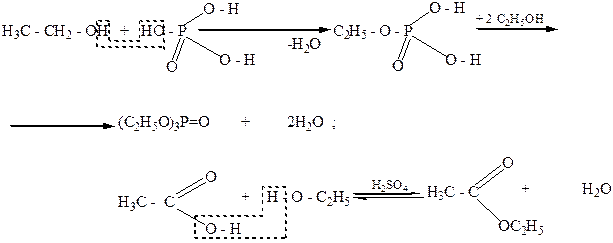
ДЕГИДРАТАЦИЯ СПИРТОВ
Дегидратация спиртов может осуществляется в двух направлениях: внутримолекулярно и межмолекулярно. Направление дегидратации зависит от природы спирта и условий проведения реакции.
При внутримолекулярной дегидратации спирта образуется ненасыщенный этиленовый углеводород, в результате межмолекулярной дегидратации – простой эфир. Так, при нагревании спиртов с такими водоотнимающими веществами, как концентрированная H2SO4, H3PO4, безводная щавелевая кислота, оксид алюминия и т.д., образуются ненасыщенные соединения этиленового ряда.
Реакционная способность спиртов к дегидратации, то есть к образованию из них этиленовых соединений, изменяется в таком порядке:
третичные спирты > вторичные спирты >первичные спирты
Некоторые третичные спирты дегидратируются настолько легко, что их можно перегнать только в случае, если предотвратить попадание в них даже лабораторного воздуха, который содержит в незначительных количествах пары кислот.
Дегидратация спиртов в присутствии концентрированной H2SO4 в зависимости от температуры, соотношения объемов спирта и кислоты может осуществляться с образованием разных продуктов. Например, этиловый спирт при 105оС образует с серной кислотой кислый сложный эфир – этилсерную кислоту (реакция 1). При избытке спирта и более высокой температуре (130 –140оС) осуществляется межмолекулярная дегидратация, главным продуктом которой является диэтиловый эфир (простой эфир; реакция 2). При температуре выше 160оС этилсерная кислота разлагается с образованием этилена (реакция 3):
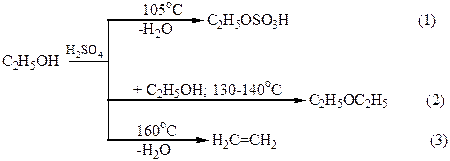
ПРАВИЛО ЗАЙЦЕВА
А.М.Зайцев (1875 г.) установил, что при отщеплении воды от спиртов образуются наиболее алкилированные этиленовые углеводороды (правило Зайцева). Например, при дегидратации 3-метилбутанола-2 отщепление воды осуществляется за счет гидроксила и атома водорода, который находится у соседнего наименее гидрогенизованного β-углеродного атома. В результате образуется 2-метилбутен-2:
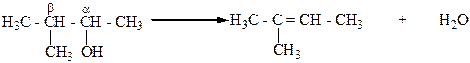
Отщепление воды от спиртов по правилу Зайцева связано с образованием в ходе реакции промежуточных наиболее устойчивых карбкатионов, которые потом превращаются в наиболее алкилированные этиленовые углеводороды, термодинамически более устойчивые, чем менее алкилированные алкены.
Спирты легко дегидратируются и в газовой фазе над нагретым оксидом алюминия или пористой глиной. Например, из этилового спирта по этому методу получают этилен с высоким выходом:
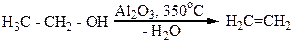
АЛКИЛИРОВАНИЕ СПИРТОВ
Алкилированием называют реакции введения в молекулы органических веществ алкильных радикалов. При введении алкильного радикала в молекулу спирта вместо атома водорода ОН-группы получают простые эфиры. Алкилировать спирты можно спиртами, как это осуществляется при их межмолекулярной дегидратации:
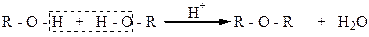
Можно алкилировать спирты галоидными алкилами. Однако спирты являются слабыми нуклеофилами и с галоидными алкилами реагируют чрезвычайно медленно. Если реакцию галоидных алкилов проводить не со спиртами, а с алкоголятами, то простые эфиры образуются быстрее, поскольку алкоголят-ионы – сильные нуклеофилы и алкилирование в этом случае осуществляется очень активно:

метилэтиловый эфир
Алкилировать алкоголяты можно и диалкилсульфатами:

Взаимодействие алкоголятов с алкилгалогенидами является общим методом получения простых эфиров, известным под названием „синтеза Вильямсона”.
Реакция алкоголятов с галогеналкилами осуществляется по SN2 – механизму:
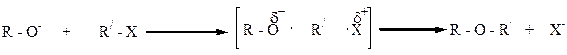
ОКИСЛЕНИЕ СПИРТОВ
Спирты при 300-400оС и в присутствии медных и других катализаторов окисляются кислородом воздуха. Такие окислители, как KMnO4, хромовая смесь, окисляют спирты уже при комнатной температуре. В зависимости от того, какой это спирт – первичный, вторичный или третичный – при окислении образуются разные продукты.
Первичные спирты при окислении дают альдегиды с таким же количеством углеродных атомов, как и в молекуле исходного спирта. Альдегиды в этих условиях могут окисляться в карбоновые кислоты. Чтобы избежать дальнейшего окисления, альдегиды необходимо быстро выводить из реакционной смеси:
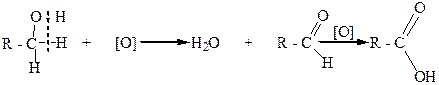
альдегид карбоновая кислота
Окисление спиртов хромовой смесью сопровождается изменением оранжево-красного окрашивания реакционной смеси (ионы Cr2O72-) на зеленое (ионы Cr3+):

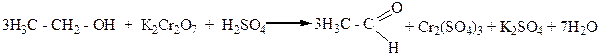
Первичные спирты можно также окислить в альдегиды мелко раздробленной медью. Нагретой до 280-300оС. В этих условиях от молекулы спирта отщепляются два атома водорода и в молекуле органического вещества, которая при этом образуется, появляется двойная связь углерод – кислород (>C=O). Такое превращение спиртов называется дегидрированием:
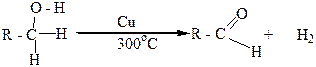
Вторичные спирты при окислении, а также при дегидрировании, превращаются в кетоны:
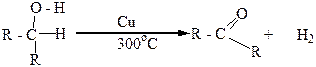
Например, втор-пропиловый спирт в этих условиях превращается в кетон, который называют ацетоном:
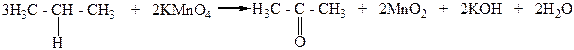
Диметилкетон
(ацетон)
Третичные спирты окисляются достаточно трудно с одновременным разрывом углеродной цепи их молекул и образования смеси карбоновых кислот и кетонов. Такое окисление этих спиртов связано с тем, что в условиях реакции окисления они дегидратируются и превращаются в этиленовые углеводороды, которые в присутствии сильного окислителя окисляются с разрывом молекулы по месту двойной С=C - связи.
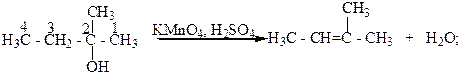
2- Метилбутанол-2 2-Метилбутен-2.
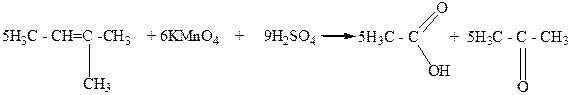
Уксусная Диемтилкетон
кислота (ацетон)
Таким образом, по продуктам окисления спиртов можно сделать вывод о строении спиртов.
ИДЕНТИФИКАЦИЯ СПИРТОВ
Спирты можно отличить от других классов органических веществ по цветной реакции с оксидом хрома (IV) в среде серной кислоты. Хромовый ангидрид CrO3 в водном растворе H2SO4 окисляет первичные и вторичные спирты, на протяжении приблизительно двух секунд прозрачный оранжевый раствор реакционной смеси становится голубовато-зеленым и мутнеет. Третичные спирты этой реакции не дают.
Для того, чтобы установить, каким является данный спирт – первичным, вторичным или третичным пользуются пробой Лукаса. Эта проба основана на разной реакционной способности спиртов относительно галогеноводородов. Спирты, молекулы которых содержат не больше шести углеродных атомов, растворяются в реактиве Лукаса, который представляет собой смесь концентрированной соляной кислоты и хлорида цинка. При растворении спирта в этом реактиве образуются соответствующие алкилхлориды, раствор мутнеет, поскольку алкилхлориды в реактиве Лукаса не ратсворяются. Время, необходимое для появления помутнения реактива Лукаса, является мерой реакционной способности спирта. Третичные спирты реагируют с реактивом Лукаса сразу же, вторичные спирты – на протяжении 5 минут, а первичные спирты прикомнатной температуре с этим реактивом почти не взаимодействуют.
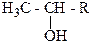 Этиловый спирт и спирты общей формулы взаимодействуют
Этиловый спирт и спирты общей формулы взаимодействуют
в щелочной среде с иодом и образуют иодоформ CHJ3 (иодоформная реакция). По способности давать иодоформную реакцию можно отличить данные спирты от других спиртов:
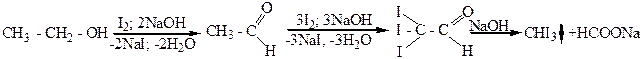
этиловый уксусный трииодуксусный иодоформ имеет
спирт альдегид альдегид неприятный запах
ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ
Метиловый спирт, карбинол или древесный спирт, или метанол Н3С-ОН известен с 1834 г. Он представляет собой прозрачную жидкость со специфическим запахом, который напоминает запах этилового спирта. Смешивается с водой во всех соотношениях. Основным промышленным методом его получения является гидрирование оксида углерода (II), которое осуществляется под давлением в присутствии катализаторов (ZnO,Cr2O3) и температуре 400оС:
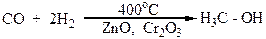
Раньше метиловый спирт получали сухой перегонкой древесины, отсюда его название „древесный спирт”.
Метиловый спирт широко используется в промышленности для получения формальдегида, органических красителей, фармацевтических препаратов и как растворитель лаков и политур. Его используют для введения метильной группы в различные органические соединения.
При работе с метиловым спиртом следует помнить, что он чрезвычайно ядовит !!! Попадание в организм нескольких граммов (~10 мл) метилового спирта вызывает слепоту, а несколько большие количества (~30 мл) – смерть. В связи с этим метиловый спирт используют только для технических нужд. На склянке с веществом следует обязательно делать надпись “Метанол – Яд ”.
Этиловый спирт (этанол) Н3С-СН2-ОН – бесцветная жидкость с характерным запахом. С водой этанол смешивается во всех соотношениях, с ней он образует азеотропную смесь состава: 95,57% спирта и 4,43% воды. Данную смесь нельзя разделить фракционной перегонкой. В процессе очистки (ректификации), которую проводят тщательной фракционной перегонкой, Получают 95% спирт – ректификат. Для получения безводного (абсолютного) спирта водный спирт нагревают в течение продолжительного времени с CaO, с безводным CuSO4 и другими веществами, которые химически связывают присутствующую в спирте воду. Обезводить этанол с помощью безводного CaCl2 не удается, поскольку спирт с хлоридом кальция образует комплекс CaCl2·4C2H5OH.
В технике и лабораторной практике концентрация этилового спирта равна объемной доле, выраженной в процентах или градусах. Концентрация спирта в градусах определяется ареометром (спиртометром), градуированным специальным образом.
Этиловый спирт – многотоннажный продукт химической промышленности. По объему производства он занимает первое место среди других органических продуктов. Его получают разными методами. Один из них – спиртовое брожение сахаристых веществ, например, глюкозы, в присутствии дрожжей:
|
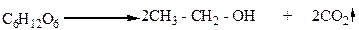
Глюкоза
Необходимая для этого процесса глюкоза или содержится в готовом виде, например в виноградном соке, или ее получают гидролизом крахмала. Спирт, полученный этим методом, называют винным, или пищевым. Крахмал содержится в таких продуктах, как пшеница, жито, ячмень, кукуруза, рис, картофель. В наше время для производства этанола для технических нужд пищевые продукты полностью заменены не пищевыми. Так, крахмал был заменен клетчаткой (целлюлозой), которая в больших количествах содержится в отходах деревообрабатывающей, целлюлозной и лесной промышленности (опилки, стружки, ветки, мусор и т.д.). Клетчатку сначала гидролизуют :
| |||
| |||
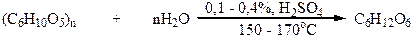
Полученную таким образом глюкозу подвергают брожению. Этиловый спирт, полученный этим методом, называют гидролизным. Гидролизный метод получения этанола более выгодный, поскольку дает возможность экономить большое количество пищевых продуктов. Из 1 т. опилок можно получить до 200 кг этанола. Однако гидролизный спирт содержит примеси, в том числе и ядовитый метанол, поэтому его используют только для технических нужд.
Широкое применение в промышленности получил метод получения этилового спирта путем гидратации этилена в присутствии H2SO4 или H3PO4:
H2C=CH2 + HOH 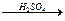 H3C – CH2 - OH
H3C – CH2 - OH
Этиловый спирт нашел широкое применение. Трудно назвать отрасль народного хозяйства, где бы не применялся этанол. Во-первых, он используется для получения синтетического каучука, уксусной кислоты, органических красителей, диэтилового эфира, сложных эфиров, пахучих веществ (фруктовые эссенции), фармацевтических препаратов и т.д. Этиловый спирт проявляет антисептические свойства и используется в медицине, в частности в хирургии для обеззараживания хирургических инструментов, рук хирурга, операционного поля.
Этанол – прекрасный растворитель. Для органической химии он имеет такое же значение, как для неорганической химии – вода. Применяют этиловый спирт также в парфюмерии, пищевой промышленности.
Этиловый спирт в небольших дозах вызывает опьянение, а в больших – вызывает состояние, близкое к наркозу, с общей нечувствительностью, которое может закончиться смертью. Таким образом, по действию на организм этиловый спирт является наркотиком и может вызывать заболевание, известное под названием алкоголизм.
ВЫСШИЕ СПИРТЫ
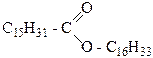 В природе встречаются цетиловый C16H33-OH (гексадеканол-1) и мирициловый C31H63-OH (триаконтанол-1). Первый из них в виде сложного эфира пальмитиновой кислоты составляет часть спермацета, который выделяют
В природе встречаются цетиловый C16H33-OH (гексадеканол-1) и мирициловый C31H63-OH (триаконтанол-1). Первый из них в виде сложного эфира пальмитиновой кислоты составляет часть спермацета, который выделяют
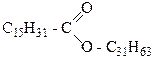 из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Спермацет используется как высококачественная смазка для прецизионных инструментов, а также в парфюмерной и текстильной промышленности. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
из маслообразной массы, содержащейся в голове кашалота и в длинном канале, проходящем вдоль всего туловища. Спермацет используется как высококачественная смазка для прецизионных инструментов, а также в парфюмерной и текстильной промышленности. Мирициловый спирт в виде эфира пальмитиновой кислоты входит в состав пчелиного воска.
Дата: 2019-04-23, просмотров: 382.