Теоретические основы электролиза глинозёма
Основы электрохимии
В электрохимии исследуют процессы превращения химической энергии в электрическую (гальванические элементы) и электрической энергии в химическую (электролиз). Электрохимические исследования получили развитие после изобретения в 1799 г. итальянским учёным Луиджи Вольта электрической батареи, называемой вольтовым столбом.
Вещества, проводящие электрический ток, разделяются на проводники первого и второго рода. В связи с этим различают электронную и ионную проводимость.
Все металлы, сплавы металлов и углеродистые электроды относятся к проводникам первого рода. В них часть электронов, слабо связанных с ядрами атомов, образует так называемый «электронный газ», причём электроны неупорядоченно перемещаются от одних атомов к другим. При наложении электрического поля начинается упорядоченное движение электронов. Прохождение электрического тока по проводникам первого рода не связано с переносом вещества.
К проводникам второго рода относятся электролиты: водные растворы солей, кислот, щелочей и расплавленные соли. В проводниках второго рода электричество переносится ионами. Прохождение электрического тока через проводники второго рода сопровождается переносом вещества.
В 1833 г. Фарадей открыл законы электролиза, являющиеся основой количественного изучения электродных процессов. При электролизе на электроды подаётся разность потенциалов от источника постоянного тока. Отрицательно заряженный электрод называется катодом, а положительно заряженный – анодом.
Процесс разложения молекул вещества на ионы при взаимодействии с растворителем называется электролитической диссоциацией, в результате которой образуются ионы, несущие положительный заряд – катионы, или отрицательный заряд – анионы. При этом сумма положительных зарядов образовавшихся катионов равна сумме отрицательных зарядов анионов.
Процесс выделения веществ на электродах в растворах или расплавах под действием постоянного тока называется электролизом.
Среда, в которой осуществляется процесс электролиза, называется электролитом, это смесь ионов, проводящих электрический ток.
Чтобы осуществить разряд катиона, нужно создать на катоде избыток электронов, причём для разных металлов избыток электронов различен. В зависимости от величины электродного потенциала металла и водорода, все металлы располагаются в так называемый электрохимический ряд напряжений:
Li K Ca Na Mg Al Si Zn Fe H Cu Ag
Алюминий обладает высокой химической активностью, большой энергией образования соединений и занимает место среди электроотрицательных металлов, что делает невозможным выделение его электролизом из водных растворов, так как на катоде в первую очередь будет выделяться водород. Поэтому электролит не должен содержать ионов металлов более электроположительных, чем алюминий, а лишь соли щелочных и щелочноземельных металлов.
В настоящее время единственным способом получения алюминия в крупномасштабном производстве является электролитическое разложение его окиси, растворённой в расплавленном криолите.
Требования к электролитам
Электролит для электролиза глинозема должен удовлетворять следующим требованиям:
1. Не содержать более электроположительных элементов, чем алюминий, которые выделяются на катоде - в жидком алюминии – и загрязняют его.
2. В расплавленном состоянии хорошо растворять глинозем.
3. Обладать меньшей плотностью, чем расплавленный алюминий, что благоприятствует процессу электролиза.
4. Обладать достаточной жидкотекучестью, что способствует удалению анодных газов, а также выравниванию состава электролита.
5. Обладать хорошей электропроводностью, что дает возможность иметь меньшее падение напряжения в электролите и, следовательно, меньший расход электроэнергии.
6. Образовывать с глиноземом сплавы, обладающие температурой плавления, близкой к Тпл алюминия.
7. При температуре электролиза химически не разлагаться, а также слабо улетучиваться.
8. Химически не взаимодействовать с углеродистой футеровкой и угольным анодом.
9. Должен быть не гигроскопичным.
Совокупность свойств у криолитоглиноземных расплавов наиболее благоприятна. Были попытки замены состава электролита на смеси хлористых солей, но они не имели успеха.
Температура плавления
Температура плавления определяет границу существования жидкого состояния системы. Знание температур плавления системы позволяет выбрать нужные соотношения компонентов в электролите. Температура ликвидуса, или точка плавления криолитовых расплавов снижается при введении добавок. Это считается благоприятным, поскольку можно снизить рабочую температуру электролизера, повысив тем самым выход по току.
Криолит плавится при 1010 °C. Добавка 1 % глинозёма снижает Тпл. расплава на 5 °C. Расплав, содержащий 15 % глинозёма плавится около 935 °C, но работать на таком электролите нельзя из-за повышенной вязкости.
Согласно диаграмме NaF–AlF3 (рис.2.1) видно, что избыток AlF3 (уменьшение КО) и избыток NaF (увеличение КО) понижают температуру плавления расплава. Каждые 3 % AlF3 к массе расплава понижают его Тпл. на ≈ 10°C.
Специально для снижения температуры плавления электролита вводят добавки MgF2 и CaF2. Также CaF2 образуется в расплаве из-за присутствия СаО в виде примеси, которая взаимодействует с избытком AlF3
СаО + AlF3 ® Al2O3 + CaF2 (2.9)
Поэтому в электролите всегда содержится 3 – 5 % CaF2, что способствует снижению его температуры плавления. Еще в большей степени температуру плавления снижает MgF2 и добавляется в расплав в количестве 3 – 5 %.
Плотность электролита
Плотности алюминия и электролита зависят от температуры. В твердом состоянии плотность составляет, г/см3:
Al 2,7; криолит 2,95; глинозём 3,9
При расплавлении компонентов электролита их плотность уменьшается не одинаково: плотность алюминия с повышением температуры понижается медленнее, чем плотность криолита. При 960 °С плотность промышленного электролита (с 5 % Al2O3) составляет 2,1 г/см3, а жидкого Al – 2,303 г/см3. Таким образом, при температуре электролиза алюминий тяжелее и находится на подине электролизера под слоем электролита, что предохраняет его от окисления воздухом. Но температурный коэффициент плотности алюминия в 3-4 раза меньше, чем электролита. При понижении температуры электролит охлаждается быстрее, происходит его частичная кристаллизация и суммарная плотность жидкой и твердой частей расплава становится больше, чем у алюминия. Металл при этом всплывает на поверхность электролита, что приводит к негативным последствиям.
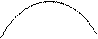
Реально разность плотностей металла и электролита определяется только плотностью криолитового расплава. Эта разность должна превышать 0,2 г/см3, чтобы препятствовать смешению и поддерживать хорошее разделение металла от электролита. В расплаве наибольшая плотность у криолита. Добавки NaF и AlF3 уменьшают плотность расплава

 r г/см3
r г/см3
 |
 NaF Na3AlF6 AlF3
NaF Na3AlF6 AlF3
Рисунок 2.3 – График зависимости плотности расплава от его состава
Добавки CaF2 и MgF2 увеличивают плотность расплава, сближая удельные веса электролита и металла. Поэтому допускается наличие CaF2+MgF2 не более 8 % в электролите.
Плотность электролита желательно снижать по следующим причинам:
- предотвращается смешивание металла и электролита,
- увеличивается скорость осаждения капель алюминия на катоде,
- снижается достижение подошвы анода мелкими каплями алюминия с последующим их окислением;
- снижается амплитуда волн, возникающих при перемешивании металла электромагнитными силами и силами давления, и, как следствие, увеличивается выход по току.
Межфазовое натяжение
Межфазовое натяжение между металлом и электролитом должно быть высоким, чтобы обеспечить надежное разделение двух фаз и снизить перенос металла через границу раздела в электролит. Влияние добавок на межфазовое натяжение алюминия и криолита было определено А.И. Беляевым около 1960-х г., и до настоящего времени его данные являются наиболее точными из опубликованных.
Поверхностное натяжение – это избыток свободной энергии в поверхностном слое жидкости на границе раздела фаз, отнесенной к единице поверхности. Поверхностное натяжение характеризуется на границе с твердой поверхностью краевым углом смачивания. Чем меньше поверхностное натяжение жидкости, тем лучше она смачивает поверхность и тем ниже угол смачивания Θ.
Смачивание угольных материалов электролитом зависит от его состава и температуры. Увеличение содержания AlF3 наиболее значительно увеличивает межфазовое натяжение. Обычно используемые электролиты не смачивают эти материалы, их краевой угол смачивания больше 90. Однако добавка даже незначительных количеств алюминия в расплав приводит к резкому улучшению смачиваемости. Натрий улучшает смачиваемость и поэтому подина быстро пропитывается электролитом.
1) Поверхностное натяжение алюминия при Т = 1000 °С равно 454 днсм – высокое, поэтому он плохо смачивает футеровку и на подине имеет выпуклый мениск. Поверхностное натяжение алюминия снижают все примеси, особенно Al4C3. Электролит же хорошо смачивает футеровку, проникает под расплавленный металл и проникает в поры и трещины катодных блоков.
2) На границе углерод–электролит поверхностное натяжение NaF невелико, поэтому он лучше всех компонентов смачивает футеровку и сильнее впитывается ею. При увеличении содержания AlF3, поверхностное натяжение увеличивается, достигает максимума для криолита, а затем практически не меняется. Следовательно, NaF – поверхностно -активное вещество, понижающее поверхностное натяжение электролита, что способствует проникновению NaF в футеровку и катодные блоки, вызывая их разрушение. Добавки CaF2 и MgF2 повышают поверхностное натяжение электролита на границе с твердой поверхностью.
3) На границе электролит–газовая фаза наибольшее поверхностное натяжение у NaF– 199,8 днсм при 1000°С. С повышением содержания AlF3 оно снижается до 145,5 днсм (у криолита), а при 50% AlF3 до 86,3 днсм.
Вязкость
От вязкости электролита зависят такие процессы, как усреднение концентрации глинозема, скорость отстаивания электролита от капель металла, удаление пузырьков анодного газа из междуполюсного зазора и т.д. Повышенную вязкость следует считать недостатком электролита любого состава. Вязкие электролиты удерживают повышенное количество частиц взвешенного металла («металлический туман») и пузырьков анодного газа, их удельная электропроводность соответственно снижается. Аналогичным образом воздействует углерод, попадающий в электролит в виде пены и плохо отделяющийся из вязких электролитов.
Вязкость электролита оказывает влияние на гидродинамические процессы в электролизере: движение металла и капелек алюминия в электролите, седиментацию частиц глинозема и сход газовых пузырьков с анода. Высокая вязкость благоприятна только для уменьшения переноса растворенного металла к аноду.
Наибольшая вязкость при температуре электролиза имеет место для чистого криолита при КО=3,0. При корректировке состава электролита в сторону избытка или недостатка AlF3 вязкость расплава довольно резко снижается.
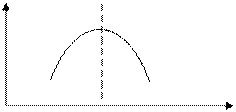 |
NaF Na3AlF6 AlF3
Рисунок 2.5 – График зависимости вязкости расплава от его состава
Глинозём сильно влияет на вязкость: при 10% Al2O3 в электролите вязкость увеличивается на 23%, что объясняется наличием в расплаве громоздких комплексных ионов AlO2–, которые повышают внутреннее трение и, следовательно, вязкость. Добавки
- CaF2, MgF2 увеличивают вязкость;
- NaCl, ВaCl2 снижают вязкость расплава.
Вязкость резко снижается с ростом температуры электролита, однако такое снижение вязкости нельзя считать приемлемым, т.к. оно сопровождается неблагоприятными последствиями. Более приемлем вариант снижения вязкости электролита путём корректировки его состава.
Экспериментальные данные по вязкости криолитных расплавов представлены в ограниченном количестве публикаций, причем в большинстве работ, имеются значительные неопределенности.
Летучесть электролита
Наибольшей упругостью паров из всех компонентов обладает AlF3, что приводит к его потерям при электролизе и изменению состава электролита (повышению КО). Добавки CaF2 и MgF2 снижают летучесть AlF3.
Потери электролита испарением в значительной степени определяется давлением его пара. Основным компонентом пара является NaAlF4 (газ), его содержание составляет около 90 % (масс.) пара над расплавом криолита. Следовательно, пар богаче фторидом алюминия AlF3, чем электролит. Таким образом, испарение будет возрастать с криолитовым отношением и требуется добавка AlF3 для восстановления состава электролита. Кроме того, водяной пар из глинозема будет реагировать с фторидом алюминия, растворенным в электролите, с образованием фтористого водорода.
Фторид лития LiF
Является одной из наиболее эффективных добавок, его называют добавкой, "дружелюбной к технологу":
- уменьшается температура начала кристаллизации и температура электролиза;
- увеличивается электропроводность расплава;
- снижается расход анода и фторидов, а также количество их выбросов в атмосферу;
- увеличивается срок службы электролизеров.
С другой стороны:
- уменьшает растворимость глинозема и скорость растворения;
- увеличивает содержание лития в алюминии и может вызвать осложнения на переделе литья.
При содержании 2,5% LiF в электролите, его температура снижается как минимум на 15 °С, а температура ликвидуса на 20 °С. При этом выход по току возрастает на 1-3%, снижается на 1-5% расход анода, уменьшаются испарения фторидов на 22-38 %. Таким образом, применение литиевых электролитов может увеличить производительность электролизера и снизить расход электроэнергии.
Фторид магния MgF2
Фторид магния более эффективно, чем CaF2 понижает температуру ликвидуса, повышает натяжение на границе "металл –электролит" и лучше отделяет угольную пену. При совместном использовании с LiF может положительно влиять на выход по току, но тогда их суммарное содержание не должно превышать 7%.
Отрицательные влияния у него те же, что и фторида кальция: снижение электропроводности электролита и растворимости глинозема в нем, возрастает плотность электролита и давление пара, что влечет за собой увеличение выбросов фтора. Кроме того, металл характеризуется повышенным содержанием магния.
Фторид магния целесообразно применять в менее кислых электролитах, если их КО более 2,6. Современные промышленные электролиты имеют КО 2,4-2,2, поэтому MgF2 не вводят.
Напряжение разложения
При электролизе происходит процесс разложения глинозема. На катоде выделяется алюминий, на аноде разряжается кислород. Вступая в реакцию с углеродом анода, он образует газовую фазу, в основном из СО и CO2. Чтобы осуществить электролиз, необходимо к аноду и катоду электролизера подвести напряжение, превышающее некоторую величину, называемую напряжением разложения.
Катодный процесс
Единственным расходуемым компонентом электролита должен быть Al2O3, разряд других ионов возможен при отклонениях от нормальных условий электролиза. Ионы алюминия восстанавливаются (принимают электроны) с образованием алюминия атомарного (нейтрального)
Al+3 + 3е ® Al0
Но этот основной катодный процесс сопровождается несколькими побочными процессами.
1) Растворение алюминия в электролите и окисление анодными газами.
Слой расплавленного алюминия, накапливающийся на подине, соприкасается с электролитом, что приводит к химическому взаимодействию алюминия с криолитоглиноземным расплавом. Происходит растворение алюминия в электролите и в итоге - снижение выхода по току.
Под растворимостью металла в его расплавленной соли понимают то количество, которое при данной температуре переходит в расплав и находится в равновесии с жидким металлом
Ме ж Û Ме раств
При наступлении равновесия растворимость прекращается. Нарушение равновесия приводит к растворению новых количеств металла. Растворимость алюминия в электролите 0,35–0,45 %. Растворение алюминия идёт двумя путями:
- взаимодействие со своей солью с образованием субсоединений (пониженной валентности)
Al + AlF3 ® AlF или в ионном виде Al0 + Al+3 ® Al+
- взаимодействие с расплавленной солью другого металла Al + NaF ® Na + AlF3
Растворенный алюминий за счет циркуляции электролита выносится в прианодное пространство, где окисляется анодными газами. С повышением температуры растворимость Al возрастает и увеличиваются потери металла:
Al + CO2 = Al2O3 + СО
С добавлением CaF2, MgF2 потери алюминия падают. Это объясняется увеличением вязкости расплава, что затрудняет перенос растворенного металла к поверхности расплава и его окисление анодными газами. Растворимость алюминия уменьшается при повышении его поверхностного натяжения, т.е. при повышении чистоты алюминия.
2) Восстановление ионов натрия за счет их избытка в электролите и при высокой температуре.
Алюминий является более электроположительным чем натрий, однако при большой концентрации ионов натрия и высокой температуре происходит разряд ионов Na+ с образованием металла
Na+ + е ® Na
На выделение натрия расходуется электроэнергия и снижается выход по току. Поэтому необходимо исключить возможность выделения натрия на катоде:
- работать с кислым электролитом КО < 2,4;
- избегать перегрева электролита;
- не допускать повышения напряжения.
3) Восстановление ионов металлов, более электроположительных, чем Al, таких как Fe, Si, Cu, Zn и др.,
4) Карбидообразование
При нормальных условиях выделение алюминия на катоде происходит на поверхности расплавленного алюминия, который и является катодом. При определенных условиях возможно взаимодействие алюминия катодного с угольными блоками с образованием карбида алюминия
4Al + 3С ® Al4С3
Карбид – это тугоплавкое соединение, накапливается на подине в виде сложного осадка, обладает большим электросопротивлением. При наличии Al4С3 поверхностное натяжение алюминия падает, изменяется смачиваемость угольной подины, что способствует проникновению металла в поры и трещины блоков. Образование карбида сопровождается увеличением объема блока на 20%, в итоге подина вспучивается и разрушается.
Образование карбида возможно и в электролите из-за взаимодействия растворенного алюминия с угольной пеной. Образованию карбида способствуют:
- повышенная температура электролита,
- местные перегревы,
- повышенное содержание NaF,
- загрязнение электролита угольными частицами.
Природа карбидообразования до сих пор неизвестна, так как взаимодействие по реакции Al+С®Al4С3 требует температуру 2000 °С, а электролиз протекает при температуре менее 1000 °С.
Анодный процесс
При диссоциации Al2O3 в основном образуются кислородосодержащие ионы
Al2O3 Û Al+3+ AlО2–
Основной анодный процесс - разряд ионов кислорода и окисление углерода анода с образованием СО и CO2
2O−2 – 4e- + C → CO2↑
Первичным анодным газом при электролизе криолитоглиноземных расплавов с угольным анодом является СО2. Но анализ состава анодных газов показывает, что они содержат до 40 % оксида углерода, что обусловлено протеканием вторичных реакций
С + СO2 → 2СО↑ (3.4)
2А1 + 3СO→Al2O3 + 3СО (3.5)
Современное представление о механизме явлений в анодном процессе при применении угольного анода исходит из того, что процесс горения состоит из стадий химической адсорбции кислорода на угле, образования промежуточных углерод-кислородных соединений типа СxОy, распада их на СО и СO2 и десорбции этих газов с поверхности анода.
При повышении плотности тока или при снижении концентрации кислородсодержащих ионов анод может запаcсивироваться до потенциала, достаточного для разряда фторсодержащих ионов. Тогда наряду с основным процессом на аноде начнется ещё один побочный процесс
4F¯+С=>СF4+ 4е или 4АlF63- + 3С => 4АlF3+ 3СF4+ 12е (3.5)
Разряд ионов фтора также происходит с образованием С2F6
2C + 3F2 = C2F6 (3.6)
Эти процессы (3.5 и 3.6) наблюдаются во время возникновения анодного эффекта, в отходящих газах концентрация СF4 доходит до 30 % и с увеличением напряжения анодного эффекта концентрация фтористого углерода возрастает.
Суммарная реакция, происходящая в электролизере, может быть представлена в виде уравнения:
Al2O3 + х C = 2Al + (2 х -3)CO + (3- х )CO2 + CF4 + C2F6 (3.6)
Анодный эффект
Анодный эффект возникает только при электролизе расплавленных солей. При электролизе водных растворов он не наблюдается. Возникновение анодного эффекта на первых алюминиевых ваннах обнаруживали с помощью низковольтной лампочки, которую включают параллельно ванне. При наступлении анодного эффекта лампочка ярко вспыхивала, поэтому анодный эффект производственники до сих пор называют "вспышкой".
Главный признак анодного эффекта – резкое и почти мгновенное повышение напряжения на ванне. Обычно за 3-4 часа до наступления анодного эффекта напряжение на ванне постепенно повышается на 0,2-0,8 В, а затем почти мгновенно поднимается до 30-45 В и выше (при нормальном напряжении 4,2-4,6 В). Вокруг анода появляется светящееся кольцо из мельчайших дуговых разрядов, которые проскакивают между анодом и электролитом с шумом и потрескиванием. Электролит возле анода разогревается и наблюдается его сильное испарение. Состав анодных газов тоже изменяется. Существует несколько теорий на природу и механизм анодного эффекта. Наиболее разработаны две.
1. Ряд учёных, в частности, А.И. Беляев и его сотрудники считают, что при электролизе криолитоглиноземных расплавов анодный эффект возникает при снижении концентрации глинозёма до 1-2 %. Причиной возникновения анодного эффекта служит резкое ухудшение смачиваемости подошвы анода электролитом из-за увеличения поверхностного натяжения на границе анод-электролит. Когда электролит хорошо смачивает анод, образующиеся на аноде газы не могут удержаться на его подошве и выделяются из электролита в виде мелких пузырьков. С увеличением поверхностного натяжения электролита отрыв пузырьков газа от подошвы анода затрудняется. Они оттесняют электролит от анода и образуют сплошную газовую плёнку. В результате сопротивление на границе анод-электролит резко возрастает, напряжение на ванне повышается и наступает анодный эффект.
2. Существует и другая точка зрения на природу анодного эффекта. Согласно гипотезе В.П. Машовца и Ю.И. Александрова, анодный эффект связан с концентрационной и химической поляризацией анода. При снижении концентрации глинозёма, а значит, и концентрации ионов AlO2–, возникает концентрационная поляризация, вызывающая резкое увеличение потенциала анода. При этом становится возможен разряд ионов фтора: 4F– + C – 4e – = CF4. Образование газообразного четырёхфтористого углерода происходит через образование твёрдых промежуточных соединений типа CxFy на поверхности анода. Когда поверхность анода полностью покроется таким соединением, наступает резкое ухудшение смачиваемости подошвы анода, сопротивление резко возрастает и напряжение увеличивается. Эта гипотеза подтверждается наличием 30% CF4 в отходящих газах, отобранных во время анодного эффекта.
Но ни одна из этих гипотез не объясняет до конца всех явлений, связанных с анодным эффектом, таких как: скачкообразный переход от нормального течения процесса электролиза к анодному эффекту, мгновенное повышение напряжения, резкое изменение состава анодных газов и др.
Анодную плотность тока, при которой наступает анодный эффект, называют критической. Электролиз идёт нормально, пока анодная плотность тока ниже критической. Следовательно, те факторы, которые повышают критическую плотность тока, будут уменьшать вероятность возникновения анодного эффекта. Величина критической плотности тока зависит от: состава электролита, материала анода и температуры электролита. Наиболее сильное влияние на критическую плотность тока оказывает присутствие окислов в электролите, то есть концентрация глинозёма. Чем больше в электролите растворённого глинозёма, тем анод лучше смачивается электролитом, и тем выше критическая плотность тока. Но растворённый глинозём расходуется, концентрация ионов AlO2– снижается, и происходит ухудшение смачиваемости анода электролитом. Газовые пузырьки труднее отделяются от поверхности анода, прилипают к ней, увеличиваются в размерах, и в конце концов сливаются в общую плёнку. При минимальном содержании глинозёма, когда плотность тока станет равной критической, а на подошве анода образовалась газовая плёнка, возникает анодный эффект.
Анодные эффекты отрицательно влияют на технико-экономические показатели процесса электролиза алюминия, приводя к повышению расхода электроэнергии, угольного анода и фтористых солей, снижению производительности электролизера, к необходимости создания систем по стабилизации тока и создания резерва напряжения на преобразовательных подстанциях, поэтому ограничивают число вспышек до необходимого минимума.
Однако анодные эффекты позволяют контролировать работу алюминиевых электролизеров: мгновенное возникновение его с высоким напряжением говорит о нормальной технологии ванны.
Современная технология электролиза направлена на предупреждение АЭ, используя автоматизированную загрузку глинозёма в ванны малыми порциями по разработанному алгоритму. Количество АЭ сейчас допускают 1-2 в сутки, чаще имеют один АЭ в 3-5 суток.
Возникающие анодные эффекты гасят возможно быстро: разрушают корку электролита, погружают её в расплав, а затем под анод вводят деревянный шест. На нормально работающей ванне эта операция занимает не более 2-3 минут. В электролите происходит сухая перегонка древесины (пиролиз) и выделяется большое количество газообразных веществ, которые энергично перемешивают электролит, способствуют разрушению газовой плёнки на подошве анода и тем самым – прекращению анодного эффекта. Когда вспышка “погаснет”, шест извлекают из расплава и рабочее пространство ванны закрывают глинозёмом. Также для устранения анодного эффекта можно использовать сухой воздух или инертный газ.
При гашении анодных эффектов необходимо соблюдать меры безопасности. Для этого анод слегка поднимают над катодом, чтобы при пробивке корки при избыточном давлении анодных газов не было выброса электролита. Лицо должно быть закрыто щитком. Деревянный шест должен быть не короче 2,5 м и высушен естественным путём. Вводить шест под анод следует под углом 45 градусов.
Теоретические основы электролиза глинозёма
Основы электрохимии
В электрохимии исследуют процессы превращения химической энергии в электрическую (гальванические элементы) и электрической энергии в химическую (электролиз). Электрохимические исследования получили развитие после изобретения в 1799 г. итальянским учёным Луиджи Вольта электрической батареи, называемой вольтовым столбом.
Вещества, проводящие электрический ток, разделяются на проводники первого и второго рода. В связи с этим различают электронную и ионную проводимость.
Все металлы, сплавы металлов и углеродистые электроды относятся к проводникам первого рода. В них часть электронов, слабо связанных с ядрами атомов, образует так называемый «электронный газ», причём электроны неупорядоченно перемещаются от одних атомов к другим. При наложении электрического поля начинается упорядоченное движение электронов. Прохождение электрического тока по проводникам первого рода не связано с переносом вещества.
К проводникам второго рода относятся электролиты: водные растворы солей, кислот, щелочей и расплавленные соли. В проводниках второго рода электричество переносится ионами. Прохождение электрического тока через проводники второго рода сопровождается переносом вещества.
В 1833 г. Фарадей открыл законы электролиза, являющиеся основой количественного изучения электродных процессов. При электролизе на электроды подаётся разность потенциалов от источника постоянного тока. Отрицательно заряженный электрод называется катодом, а положительно заряженный – анодом.
Процесс разложения молекул вещества на ионы при взаимодействии с растворителем называется электролитической диссоциацией, в результате которой образуются ионы, несущие положительный заряд – катионы, или отрицательный заряд – анионы. При этом сумма положительных зарядов образовавшихся катионов равна сумме отрицательных зарядов анионов.
Процесс выделения веществ на электродах в растворах или расплавах под действием постоянного тока называется электролизом.
Среда, в которой осуществляется процесс электролиза, называется электролитом, это смесь ионов, проводящих электрический ток.
Чтобы осуществить разряд катиона, нужно создать на катоде избыток электронов, причём для разных металлов избыток электронов различен. В зависимости от величины электродного потенциала металла и водорода, все металлы располагаются в так называемый электрохимический ряд напряжений:
Li K Ca Na Mg Al Si Zn Fe H Cu Ag
Алюминий обладает высокой химической активностью, большой энергией образования соединений и занимает место среди электроотрицательных металлов, что делает невозможным выделение его электролизом из водных растворов, так как на катоде в первую очередь будет выделяться водород. Поэтому электролит не должен содержать ионов металлов более электроположительных, чем алюминий, а лишь соли щелочных и щелочноземельных металлов.
В настоящее время единственным способом получения алюминия в крупномасштабном производстве является электролитическое разложение его окиси, растворённой в расплавленном криолите.
Дата: 2019-04-23, просмотров: 591.