Для опытов по гидрофилизации и гидрофобизации поверхности отбирают 8 алюминиевых пластинок, которые при повторных опытах дают краевые углы, отличающиеся друг от друга не более чем на 5-60.
Для наблюдения гидрофилизации поверхности алюминия пластинки погружают в растворы танина с концентрациями 1, 0.5, 0.1 и 0.01 % и выдерживают их в течение 10-20 мин. Затем пластинки вынимают с помощью пинцета, удерживая за края. Избыток раствора танина удаляют с пластинок фильтровальной бумагой и высушивают над плиткой в потоке теплого воздуха (близко пластинку к плитке не подносить!). На каждую высушенную пластинку наносят каплю воды и определяют краевой угол смачивания, как описано выше в разделе 1. На основании полученных данных строят изотерму смачивания, откладывая на оси абсцисс величину концентрации танина, а по оси ординат значения соs θ (см. рис. 3) и определяют точку инверсии.
Гидрофобизацию поверхности алюминия проводят путем погружения пластинок в растворы стеариновой кислоты с концентрацией: 1, 0.5, 0.1, 0.01 %. Алюминиевые пластинки погружают в эти растворы на 10-20 мин, затем вынимают, удаляют избыток кислоты фильтровальной бумагой, высушивают и определяют краевой угол смачивания, как описано выше. На основании полученных данных строят изотерму смачивания, откладывая на оси абсцисс концентрацию стеариновой кислоты, а на оси ординат значения соs θ (см. рис. 3) и определяют точку инверсии.
Получение «мокрого» парафина
Алюминиевую пластинку опускают на несколько секунд в расплавленный парафин и затем осторожно вынимают из него пинцетом. На пластинку, покрытую тонким слоем застывшего парафина, наносят капли воды и измеряют краевой угол смачивания. Затем на эту же пластинку поочередно наносят капли раствора танина с концентрациями 0.01, 0.1, 0.5 и 1 % и измеряют краевой угол смачивания. На основании полученных данных строят изотерму смачивания, откладывая на оси абсцисс концентрацию стеариновой кислоты, а на оси ординат значения соs θ (см. рис. 3). На графике показывают концентрацию танина, при которой парафин делается «мокрым», т.е. точку инверсии.
Отчет по работе
1. Представить проекции капель воды на пластинках, покрытых
а) танином
б) стеариновой кислотой
в) парафином
2. Представить проекции капель растворов танина четырех концентраций на парафине
3. Построить изотермы смачивания в координатах соs θ = f (СПАВ) для всех исследуемых систем и определить точки инверсии.
4. Рассчитать по уравнениям работу адгезии (7), когезии (2), смачивания (19) и коэффициент растекания f (12), если известно, что σжг (танин) = 58 мН/м, σжг (вода) представлены в таблице 2 (см. приложение).
Вопросы для самопроверки
1. Что называют адгезией и смачиванием? Какие параметры используют для их количественной характеристики?
2. Покажите взаимосвязь между адгезией и способностью жидкости смачивать твердую поверхность. В чем состоит различие между явлениями адгезии и смачивания?
3. Как влияет природа твердого тела и жидкости на смачивание и адгезию?
4. Дайте характеристику и приведите примеры гидрофильных и гидрофобных поверхностей. Как можно повлиять на смачивание повехности?
5. Чем обусловлено улучшение смачивания водой гидрофобных поверхностей при введении в нее ПАВ?
6. Что такое интегральная и дифференциальная теплоты смачивания, и какие существуют методы их определения?
7. Каковы условия растекания жидкостей? Рассмотрите особенности растекания жидкостей на твердых поверхностях.
Лабораторная работа № 6
ИССЛЕДОВАНИЕ КИНЕТИКИ ОГРАНИЧЕННОГО
НАБУХАНИЯ ПОЛИМЕРА
Задачи работы
1. Изучить кинетику набухания полимера в органическом растворителе в приборе Догадкина.
2. Построить кривую кинетики набухания.
3. Определить степень набухания образца полимера.
4. Графическим способом определить константу скорости набухания К.
Приборы и материалы
· Прибор Догадкина или прибор ЛГУ для исследования кинетики набухания полимеров.
· Торсионные весы.
· Пластинки ненаполненной резины (вулканизованного каучука), не содержащие экстрагируемых веществ.
· Жидкость для набухания (органические растворители толуол и хлороформ).
· Секундомер.
· Резиновая груша.
· Миллиметровая бумага.
· Тонкая проволока.
Теоретическое пояснение
Макромолекулы ВМС (высокомолекулярных соединений) при взаимодействии с растворителями способны к набуханию. Набухание - это увеличение массы и объема ВМС за счет поглощения низкомолекулярной жидкости или ее пара. Оно характеризуется степенью набухания a, которая показывает относительное увеличение массы ВМС
a = (m - mо) / mо = mж / mо, (1)
где mо, m - масса ВМС до и после набухания; mж - масса поглощенной жидкости.
Часто степень набухания выражают в процентах.
a = (m - mо) / mо × 100% = mж / mо × 100% (1¢)
Степень набухания может изменяться в широком диапазоне – от десятков до тысячи процентов; для природных ВМС степень набухания обычно не превышает 1600 %.
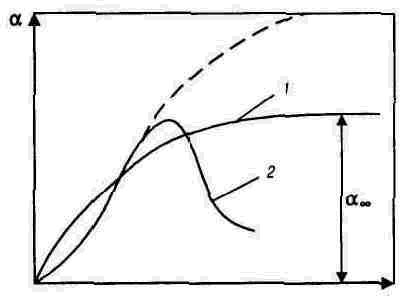
Степень набухания зависит от времени (рис. 1). Набухание может быть ограниченным (кривая 1) и неограниченным (кривая 2). При ограниченном набухании макромолекулы поглощают жидкость, но в ней не растворяются. В результате ограниченного набухания степень набухания достигает максимального значения a ¥ и в дальнейшем не увеличивается. Ограниченное набухание приводит к образованию студня. Неограниченное набухание заканчивается растворением. Подобный процесс наблюдается при набухании натурального и синтетического каучука в углеводородах, глобулярных белков в воде, желатина в горячей воде.
В результате ограниченного набухания белков муки образуется эластичное и плотное по консистенции тесто. Когда часть белка переходит в растворенное состояние, свойства теста ухудшаются: оно становится жидким и липким. Набухание в этом случае переходит в неограниченное, что соответствует кривой 2 на рис. 1. Сплошная линия кривой 2 и максимум на ней характеризует состояние ВМС в виде студня, а пунктирная - в виде раствора.
 t
t
Рис. 1. Зависимость степени набухания от времени: 1 и 2 - ограниченное и неограниченное набухание, соответственно.
Процесс набухания избирателен в зависимости от природы ВМС и растворителя. Ограниченное набухание имеет место при взаимодействии полярного ВМС с полярным холодным растворителем (например, белка с водой) или неполярного ВМС с неполярной холодной жидкостью (например, каучука с бензолом). Вид набухания, а также его скорость определяются температурой растворителя. Для одного и того же ВМС и растворителя можно наблюдать одновременно ограниченное и неограниченное (растворение) набухание. Часть крахмала (10-20 %) после обработки теплой водой растворяется (неограниченное набухание), а большая часть его нерастворима и способна к ограниченному набуханию.
Изменение степени набухания с течением времени определяет скорость набухания Vн, которая выражается следующим образом:
Vн = (a2 - a1) / (t2 - t1) = Da /Dt , Vн = da / dt (2)
Кинетика набухания, т.е. изменение скорости набухания во времени, идет по механизму реакции первого порядка. В связи с этим скорость набухания можно представить в следующем виде:
Vн = da / dt = Кн (a¥ - at), (3)
где Кн - константа скорости набухания; t - время набухания; at - степень набухания за время t; a¥ - предельная степень набухания.
Из формулы (3) путем ее интегрирования можно определить константу скорости набухания, которая по аналогии с константой скорости реакции первого порядка будет иметь вид
Кн = 1/t × ln (a¥ /( a¥ - at) = 2,3 /t × lg (a¥ /( a¥ - at) (4)
Константа скорости набухания Кн и степень набухания a t характеризуют кинетику скорости процесса, а степень предельного набухания a ¥ - его конечный результат. Набухание протекает в несколько стадий, которые в случае полярного растворителя представлены на рис. 2.
а 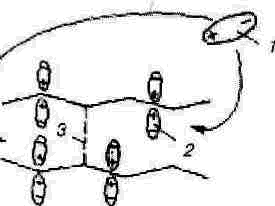 б
б 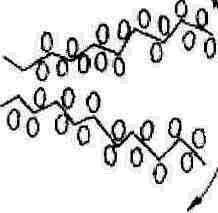
Рис. 2. Первая (а) и вторая (б) стадии процесса набухания: 1 и 2 - полярные молекулы растворителя в объеме (1) и в сольватном (гидратном) слое (2); 3 - слабые межмолекулярные связи.
Первая стадия (рис. 2, а) связана с диффузией молекул растворителя в макромолекулы ВМС, сольватацией этих молекул, а также с разрывом слабых связей между макромолекулами. В результате этой стадии полярные молекулы растворителя 1 образуют сольватный 2, а в случае воды - гидратный слой. Вследствие сольватации и отталкивания одноименных зарядов сольватных слоев рвется слабая связь 3 между звеньями макромолекул.
На второй стадии происходит диффузия самих макромолекул или их звеньев в раствор. В результате разрыва слабых связей макромолекулы приобретают способность диффундировать в раствор. Направление диффузии на рис. 2, в показано стрелками.
Набухание - типичное коллоидно-химическое явление. Оно происходит с выделением теплоты. Это непосредственно следует из основных термодинамических представлений об открытых системах, для которых характерно соотношение
DG = DH - TDS, или dG = dH - TdS, (5)
где DG(dG), DH(dH), DS(dS) - изменение энергии Гиббса, энтальпии и энтропии соответственно.
На первой стадии процесса энтропия системы практически не изменяется. По этой причине снижение энергии Гиббса в самопроизвольном процессе, к которому относится набухание, произойдет за счет уменьшения энтальпии. Уменьшение энтальпии для изобарно- изотермического процесса означает выделение теплоты, т. е. Набухание является экзотермическим процессом. В результате ослабления связи между макромолекулами на второй стадии набухания беспорядок увеличивается, а это приводит к росту энтропии; в соответствии с условиями (4), когда dG< 0.
Тепловой эффект, который сопутствует набуханию, называют теплотой набухания. Выделение теплоты происходит на первой стадии процесса набухания при сольватации молекул растворителя. Диффузия звеньев макромолекул, т. е. вторая стадия набухания, обусловлена энтропийным фактором.
Различают интегральную и дифференциальную теплоту набухания. Интегральная теплота набухания - это количество теплоты, которое выделяется в течение всего процесса набухания при поглощении единицей массы сухого вещества определенной массы жидкости. Ее можно определить при помощи следующей эмпирической формулы
Q = Аmж / (В + mж), (6)
где А, В - опытные коэффициенты; mж - масса жидкости в набухшем ВМС.
Интегральная теплота набухания может быть значительной. Так, при набухании 1 кг сухого желатина может выделяться 27,9 кДж, а при набухании 1 кг крахмала - 32,3 кДж.
В результате дифференцирования интегральной теплоты набухания Q по mж получают дифференциальную теплоту набухания. Она показывает количество теплоты, которое выделяется на любой стадии процесса набухания при поглощении единицы (1 кг) жидкости:
q = dq / dmж = АВ / (В + mж)2 (7)
Обычно экспериментально определяют интегральную теплоту набухания. Затем по уравнению (6) рассчитывают дифференциальную теплоту набухания.
Набухание сопровождается увеличением объема ВМС. Если исходная масса заключена в определенную емкость, то в процессе набухания за счет увеличения объема вещества возникает давление набухания (до 107 Па).
Давление набухания можно вычислить по следующей формуле:
P = kmoa, (8)
где k - коэффициент, зависящий от природы ВМС, растворителя и температуры; mo - содержание сухого вещества в набухшем студне; а - коэффициент, значение которого близко 3.
При набухании масса ВМС увеличивается, однако общий объем системы Vс уменьшается по сравнению с суммарным объемом исходного (до набухания) ВМС Vи и растворителя Vр. Подобное уменьшение объема называют контракцией, которая составляет
DV = (Vи + Vр) - Vс (9)
Контракция вызвана уплотнением системы в связи с сольватацией (гидратацией) молекул растворителя и образованием связанной жидкости. Подобно теплоте набухания, контракция наиболее интенсивна на первой стадии процесса. Связь между контракцией и теплотой набухания выражается в том, что ее отношение к интегральной теплоте остается примерно постоянным, т. е.
DV/Q = const. (10)
Дата: 2019-03-05, просмотров: 437.