ИЗУЧЕНИЕ ЕГО КОАГУЛЯЦИИ И СТАБИЛИЗАЦИИ
Цель работы
Синтез гидрозоля гидроокиси железа конденсационным методом; определение порога электролитной коагуляции золя и изучение зависимости его от заряда коагулирующего иона; определение защитного числа стабилизатора высокомолекулярного вещества (ВМВ).
Задачи работы
1. Приготовить заданный золь;
2. Провести коагуляцию тремя электролитами, содержащими ионы-коагуляторы разной величины заряда;
3. Вычислить пороги коагуляции для каждого электролита и их соотношения; сравнить коагулирующую способность электролитов;
4. Проверить выполнение правила Шульце-Гарди;
5. Изучить защитное действие желатина.
Оборудование и реактивы
1. Прибор для измерения мутности (фотоэлектроколориметр или нефелометр);
2. Электрическая плитка;
3. Коническая колба емкостью 250 мл;
4. Пробирки емкостью 20 мл;
5. 9 колб вместимостью 50 мл;
6. 4 бюретки вместимостью 25 мл;
7. 2% раствор FeCl3;
8. Растворы электролитов - коагуляторов: NaCl – 5 моль/л,
K2SO4 – 0,05 моль/л, K3[Fe(CN)6] - 0,008 моль/л.
Теоретическое пояснение
Синтез лиофобных дисперсных систем осуществляют методами диспергирования и конденсации. Диспергирование твердых и жидких веществ в выбранных средах проводят в шаровых и коллоидных мельницах, ультразвуковых установках и др. Эффект диспергирования усиливается при введении в среду ПАВ (эффект Ребиндера). Конденсационные методы основаны на физической и химической конденсации атомов или молекул с последующим образованием новой фазы в виде дисперсных частиц, распределенных в объеме среды (газообразной, жидкой или твердой).
При конденсации необходимо пересыщение, так как возникающие зародыши имеют большее равновесное давление пара (для жидкости) или большую растворимость (для твердых частиц) благодаря большой кривизне поверхности (малому радиусу частиц). Зависимость радиуса зародышей от пересыщения выражается уравнением Кельвина (Томсона):
ln(p/ps) = (sVm/RT)(ds/dV),
где p и ps – давление насыщенного пара над поверхностью, имеющей кривизну, и над ровной поверхностью соответственно; Vm – мольный объем вещества в конденсированном состоянии; R – универсальная газовая постоянная.
При образовании зародыша в случае лиофобных систем требуется затрата работы на создание новой поверхности. Учет этой работы и работы пересыщения дает следующее выражение для работы образования зародыша в таких системах:
A = - DG = -(1/3)ss ,
где s – поверхность зародыша.
Из этого уравнения следует, что затрата работы тем меньше, чем меньше поверхностное натяжение и размеры зародыша. Окончательные размеры частиц дисперсной фазы зависят от соотношения между скоростью образования зародышей и скоростью их роста, который самопроизвольно происходит в пересыщенных системах.
Методом физической конденсации получают золи, дымы, дисперсные металлы. При химической конденсации частицы новой фазы образуются в результате протекания в системе химической реакции с образованием малорастворимых соединения.
Лиофобные дисперсные системы термодинамически неустойчивы, так как частицы дисперсной фазы склонны к агрегации. Их термодинамическая агрегативная неустойчивость обусловлена избытком поверхностной энергии. Межфазное поверхностное натяжение в лиофобных системах больше рассчитанного по соотношению Ребиндера-Щукина:
sмакс.<gkT/a2 ,
где g - безразмерный коэффициент, k - константа Больцмана, a - средний размер частиц.
Поэтому они не могут быть получены самопроизвольным диспергированием как лиофильные системы; для их образования должна быть затрачена внешняя энергия.
Укрупнение частиц дисперсной фазы при потере агрегативной устойчивости достигается в результате изотермической перегонки или за счет слипания частиц коагуляции. Наиболее распространен процесс коагуляции. Процесс укрупнения коллоидных частиц в результате их слипания под действием межмолекулярных сил притяжения называют коагуляцией. В зависимости от природы системы и концентрации дисперсной фазы этот процесс может заканчиваться или осаждением частиц, или структурообразованием.
Процессу коагуляции способствуют: повышение температуры, замораживание, механическое воздействие, пропускание электрического тока, старение золя, добавление электролита. Под действием электролита наиболее легко коагулируют золи, у которых основным фактором устойчивости является двойной электрический слой (ДЭС).
Лиофобные дисперсные системы характеризуются кинетической агрегативной устойчивостью, определяемой скоростью процесса коагуляции. Кинетика коагуляции описывается уравнением Смолуховского:
nå=n0/(1+Kn0t) или nå=n0/(1+t/q)
где nå - суммарное число частиц дисперсной фазы ко времени t; n0 - первоначальное число частиц; q = 1/(Kn0) - время половинной коагуляции; K - константа скорости коагуляции.
Константа К определяется соотношением
K = KsR exp (DE/kT) или K = (4kT/3h)×R exp (-(DE/kT)),
где Ks - константа скорости быстрой коагуляции; R - стерический множитель, учитывающий благоприятные пространственные расположения частиц при столкновении; DE - энергия взаимодействия частиц, или потенциальный барьер; k – константа Больцмана; h - вязкость дисперсионной среды.
Константа скорости коагуляции К (константа скорости медленной коагуляции) является мерой кинетической агрегативной устойчивости. Если DE=0 и R=1, то эта константа равна константе скорости быстрой коагуляции, зависящей от вязкости среды и температуры системы. Если DE¹0 и R¹1, то не все соударения частиц эффективны, и происходит медленная коагуляция. Замедление коагуляции, обусловленное потенциальным барьером, характеризуется фактором устойчивости, или коэффициентом стабильности:
W = Ks/K = (1/R)×exp (DE/kT).
При значительном потенциальном барьере может наступить такое состояние системы, когда скорость агрегации частиц будет равна скорости дезагрегации и система окажется термодинамически устойчивой к коагуляции.
Таким образом, агрегативная устойчивость коллоидных систем обуславливается термодинамическими и кинетическими факторами. Термодинамические факторы, действие которых направленно на снижение поверхностного натяжения и увеличению энтропии, уменьшают вероятность эффективных соударений между частицами, создают потенциальные барьеры. Кинетические факторы снижают скорость столкновения частиц и связаны в основном с гидродинамическими свойствами системы.
Различают следующие факторы устойчивости дисперсных систем.
1. Электростатический фактор (термодинамический); заключается в уменьшении поверхностного натяжения, вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2. Адсорбционно-сольватный фактор (термодинамический); состоит в уменьшении поверхностного натяжения в результате взаимодействия частиц с дисперсионной средой (уравнение Дюпре) или благодаря адсорбции стабилизаторов (уравнение Гиббса).
3. Энтропийный фактор – проявляется в стремлении дисперсной фазы к равномерному распределению по объему системы под действием теплового движения.
4. Структурно-механический фактор (кинетический) – связан с тем, что на разрушение пленок, образующихся на поверхности частиц, и обладающих упругостью и механической прочностью, требуется энергия и время.
5. Гидродинамический фактор (кинетический) - заключается в снижении скорости движения частиц при изменении вязкости и плотности дисперсионной среды.
6. Смешанные факторы наиболее характерны для реальных систем; агрегативная устойчивость обеспечивается действием нескольких факторов одновременно.
Каждому фактору устойчивости соответствует специфический метод его нейтрализации. Например, электростатический фактор очень чувствителен к введению электролитов. Действие структурно-механического фактора можно предотвратить с помощью веществ, разжижающих упругие структурированные слои на поверхности частиц, а также механическим, термическим способами и другими.
Устойчивость дисперсных систем определяется балансом энергии притяжения и энергии отталкивания частиц. Энергия притяжения обусловлена межмолекулярными силами, главным образом силами Ван-дер-Ваальса. В первом приближении эта энергия обратно пропорциональна квадрату расстояний между частицами. По теории ДЛФО (Дерягина, Ландау, Фервея, Овербека), учитывающей только электростатическую составляющую расклинивающего давления, энергия отталкивания убывает с расстоянием по экспоненциальному закону.
Для области малых электрических потенциалов суммарная энергия взаимодействия частиц равна
U(h) = 2e0ecj2de-ch ×(-A*/12ph2 )
где e - диэлектрическая проницаемость дисперсионной среды; e0 – диэлектрическая постоянная; c - величина, обратная толщине диффузного слоя; jd - электрический потенциал диффузного слоя; A* - постоянная Гамакера; h – расстояние между частицами (пластинами).
При больших потенциалах и расстояниях между частицами (пластинами) эта энергия определяется уравнением
U(h) = ((64c0RT)/c)×g2e-ch ×(-A*/12ph2),
где c0 - концентрация противоионов в дисперсной среде; g - постоянная, определяемая величиной jd.
Суммарная потенциальная энергия взаимодействия частиц отрицательна на близких и далеких расстояниях. Она может быть положительна на средних расстояниях (преобладает энергия отталкивания). Максимум потенциальной кривой (рис. 1.) отвечает потенциальному барьеру DE. Первый минимум (1) соответствует непосредственному соприкосновению частиц, между которыми имеются прослойки среды.
| U (h) |
| DE |
| h |
| I |
| II |
Рис. 1. Зависимость энергии взаимодействия U двух частиц от расстояния между ними h.
Коагуляция лиофобных дисперсных систем может происходить в результате различных внешних воздействий, например при механическом воздействии (ультразвука), действии электрического поля, при нагревании и замораживании системы. Коагуляция лиофобных золей может быть вызвана также их сильным разбавлением или концентрированием. Наиболее часто коагуляция дисперсных систем происходит при добавлении электролитов. Различают два типа электролитной коагуляции коллоидных систем: 1) нейтрализационную, происходящую в результате снижения поверхностного потенциала частиц; 2) концентрационную, протекающую вследствие сжатия диффузной части двойного электрического слоя.
Нейтрализационная электролитная коагуляция характерна для коллоидных систем, содержащих слабо заряженные частицы. Концентрационная коагуляция обычно наблюдается в сильно заряженных дисперсных системах.
Введение электролитов снижает высоту потенциального барьера (рис. 1), но при небольших концентрациях электролита энергетический барьер остается достаточно велик и коагуляция частиц не происходит. Агрегация наступает при введении определенного для данной системы количества электролита, соответствующего порогу коагуляции. Порог быстрой коагуляции Ск определяет количество электролита, необходимое для коагуляции единицы объема коллоидной системы при полном исчезновении потенциального барьера DE. При сохранении небольшого потенциального барьера в системе протекает медленная коагуляция.
Порог коагуляции зависит от валентности коагулирующего иона. Эта зависимость выражается правилом значности (правилом Шульце – Гарди). Более строгую, теоретически обоснованную количественную связь между порогом быстрой коагуляции Ск и валентностью иона выражает правило Дерягина – Ландау:
Ск = К e3 (kT)5 / А2е6z6,
где К – константа, слабо зависящая от соотношения валентности катиона и аниона электролита; e - диэлектрическая проницаемость раствора; kТ – энергия теплового движения одной частицы; А – постоянная ван-дер-ваальсовых сил притяжения; е – заряд электрона; z – валентность противоиона.
Правило Дерягина – Ландау, выведенное авторами на основе представлений физической теории коагуляции, позволяет определить значение порога быстрой коагуляции, которое соответствует исчезновению энергетического барьера на кривой общего взаимодействия коллоидных частиц в зависимости от расстояния между ними. Рассчитанные по данному правилу значения порога коагуляции не всегда совпадают с экспериментальными значениями вследствие того, что коагулирующее действие ионов зависит не только от валентности, но и от специфической адсорбции, не учитываемой приведенным выше уравнением.
При электролитной коагуляции по концентрационному механизму (для сильно заряженных частиц) порог коагуляции Ск в соответствии с правилом Дерягина-Ландау (обоснование эмпирического правила Шульце-Гарди) обратно пропорционально заряду z противоионов в шестой степени, т. е.
Ск = const/z6, (1)
При нейтрализации коагуляции (при малых потенциалах поверхности j0 частиц) показатель степени при z в уравнение (1) уменьшается до двух (правило.Эйлерса-Корфа).
Установлено, что коагулирующим действием в электролите обладают не все ионы, а только те, которые несут заряд, противоположный по знаку заряду поверхности коллоидных частиц. Таким образом, для золей с отрицательно заряженными частицами коагулирующими ионами являются катионы, а для золей с положительными частицами – анионы.
Шульце установил, что коагулирующая сила ионов тем больше, чем больше заряд коагулирующего иона. Это правило было затем подтверждено Гарди и получило название правило Шульце-Гарди.
Иными словами, ионы-коагуляторы с большим зарядом вызывают явную коагуляцию при значительно меньших концентрациях (снижают порог коагуляции), чем ионы с меньшим зарядом. Правило Шульце-Гарди носит приближенный характер, так как коагулирующее действие электролита зависит не только от зарядности ионов, но и от размеров ионов и степени их гидратации. По величине коагулирующей способности ионы щелочных металлов можно расположить в следующий ряд:
Cs+ > Rb+ > NH4+ > K+ > Na+ > Li+
Анионы можно расположить в соответствующий ряд:
J - > NO3 - > Br - > Cl -.
Эти ряды ионов получили название лиотропных рядов.
Коагуляцию гидрофобного золя можно вызвать и при помощи смеси электролитов. При этом возможны три случая:1) коагулирующее действие смеси электролитов суммируется (аддитивность); 2) коагулирующее действие смеси электролитов меньше, чем у чистых электролитов. Это явление называется антагонизмом ионов. Оно характерно для смеси ионов, имеющих различную валентность; 3) в ряде случаев имеет место усиление коагулирующего действия смешиваемых ионов. Это явление называется синергизмом ионов.
Коагуляция гидрофобных электролитов может произойти при смешивании в определенных количествах золей, имеющих различный заряд коллоидных частиц. Это явление называется взаимной коагуляцией и может рассматриваться как частный случай электролитной коагуляции. При сливании двух противоположно заряженных золей коагуляция наступает при условии и концентрациях, когда общее число зарядов одного коллоида нейтрализует общее количество противоположных зарядов другого коллоида.
Гидрозоль гидроксида железа синтезируют методом конденсации путем проведения гидролиза FeCl3 при 1000С:
FeCl3 + 3H2O®Fe(OH)3 + 3HCl
Реакция гидролиза FeCl3 идет интенсивно с образованием высокодисперсных нерастворимых в воде частиц Fe(OH)3.
Агрегативная устойчивость золя Fe(OH)3 обеспечивается прежде всего наличием на поверхности дисперсных частиц двойных электрических слоев. Элементарная частица такого золя называется мицеллой. В основе мицеллы лежит нерастворимый в данной дисперсной среде агрегат, состоящий из множества молекул (атомов): m[Fe(OH)3], где m – число молекул (атомов), входящих в агрегат.
Поверхность агрегата может заряжаться благодаря избирательной адсорбции ионов из дисперсионной среды или диссоциации молекул в поверхностном слое агрегата. В соответствие с правилом Пескова-Фаянса адсорбируются преимущественно ионы, входящие в состав агрегата, либо специфически взаимодействующие с ним. Ионы, сообщающие агрегату поверхностный заряд, называются потенциалопределяющими. Заряженный агрегат составляет ядро мицеллы. При данном методе получения золя гидрооксида железа Fe(OH)3 ядро m[Fe(OH)3]nFe3+ - имеет положительный поверхностный заряд за счет адсорбции ионов Fe3+ из среды (n – число адсорбированных ионов). Заряд ядра компенсируется эквивалентным зарядом противоположно заряженных ионов – противоионов, расположенных в объеме среды. Противоионы, находящиеся непосредственно у поверхности ядра (на расстояниях, близких к диаметрам ионов), помимо электростатических сил испытывают силы адсорбционного притяжения поверхности. Поэтому они особо прочно связаны с ядром мицеллы и носят название противоионов адсорбционного слоя (их число n-x). Остальные противоионы составляют диффузно построенную ионную оболочку и называются противоионами диффузного слоя (их число х ).
Мицелла гидрофобного золя является электронейтральной. Формулы мицеллы ионостабилизированного золя Fe(OH)3 можно записать следующим образом:
Мицелла
6444444474444448
{ m [ Fe(OH)3 ] nFe3+3(n – x)Cl- } 3 х + 3xCl-
агрегат
1444442444443
ядро мицеллы
144444244443
коллоидная частица
nFe3+ - потенциалопределяющие ионы (ПОИ);
3(n – x)Cl- - противоионы адсорбционного слоя;
3xCl- - ионы диффузного слоя.
В формуле мицеллы границы коллоидной частицы обозначены фигурными скобками. Толщина адсорбционного слоя d мала (<1нм) и постоянна. Толщина диффузного слоя l существенно больше (может быть >10нм) и сильно зависит от концентрации электролитов в системе. При высоких концентрациях электролитов или при введении многозарядных ионов, ионный фактор c становится большим, а толщина l=1/c мала и стремится к нулю. В пределе l=0 и частица незаряжена. В этом случае противоионы адсорбционного слоя полностью компенсируют поверхностный заряд ядра. В результате достигается так называемое изоэлектрическое состояние, часто сопровождающееся потерей агрегативной устойчивости системы.
Написанная выше формула мицеллы является только качественной, она позволяет судить о структуре поверхностных ионных слоев, но непригодна для количественной характеристики состава коллоидных частиц.
Минимальную концентрацию электролита, при которой начинается быстрая коагуляция, называют порогом коагуляции Ск. Порог коагуляции определяют титрованием золя растворами электролитов до начала быстрой коагуляции или по зависимости оптической плотности золя от концентрации электролита.
Пороги коагуляции вычисляют на основе экспериментальных данных по формуле
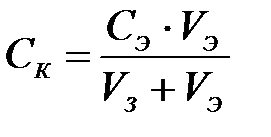 , (2)
, (2)
где СК – порог коагуляции, моль/л; СЭ – концентрация исходного раствора электролита, моль/л; V Э – объем электролита, вызвавшего коагуляцию, мл; VЗ - объем золя, мл.
Величину, обратную порогу коагуляции, называют коагулирующей способностью
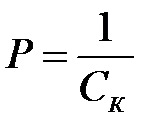 (3)
(3)
Для предотвращения агрегации частиц и защиты гидрозолей и гидросуспензий от коагулирующего действия электролитов применяют высокомолекулярные соединения (ВМС) и коллоидные поверхностно-активные вещества (ПАВ), растворимые в воде, например: белки, мыла, крахмал, декстрин. Явление повышения порогов коагуляции (увеличение устойчивости золя) при добавлении ВМС называют коллоидной защитой. Явление понижения порогов коагуляции называют сенсибилизацией.
Стабилизирующее действие лиофильных коллоидов основано на образовании на поверхности частиц дисперсной фазы адсорбционных гелеобразных пленок и связано как с уменьшением межфазного натяжения, так и со структурно-механическими свойствами поверхностных слоев.
Для защиты необходимо очень незначительное и строго определенное количество лиофильного коллоида, достаточное для покрытия поверхности лиофобных частиц. Дальнейшее добавление лиофильного коллоида не оказывает влияния на устойчивость системы.
Коллоид, адсорбировавший на себе частицы лиофильного коллоида (защищенный ими), принимает все его свойства. Защитное действие лиофильных коллоидов зависит от индивидуальных свойств и неодинаково у разных представителей этого класса.
Защитная способность полимеров и ПАВ относительно выбранного золя характеризуется защитным числом S – количеством вещества, требуемого для стабилизации единицы объема золя. Защитное число S, как и порог коагуляции СК, определяют методом турбидиметрии. Защитное число S (г/л золя) вычисляют по уравнению
S = (ССТVЗАЩ)/VЗ (4)
ССТ – концентрация раствора стабилизатора г/л; VЗАЩ – объем раствора стабилизатора, необходимый для предотвращения коагуляции золя, мл.
Выполнение работы
В конической колбе нагревают до кипения 170 мл дистиллированной воды. Не снимая колбы с плитки, приливают по каплям 30 мл 2 % раствора хлорного железа. Получается коллоидный раствор гидроксида железа интенсивного красно-коричневого цвета. Охлаждают до комнатной температуры. Порог коагуляции определяется при добавлении к золю следующих солей: NaCl, K2SO4, K3 [ Fe(CN)6 ] .
Дата: 2019-03-05, просмотров: 897.