Штамм считается типируемым, если хотя бы один фаг вызвал сильную реакцию при типировании I ТР или 100 ТР. Стафилококковые штаммы чаще лизируются не одним, а несколькими фагами, что дает для каждого штамма характерную для него фагомозаику. В зависимости от фагов, входящих в эту мозаику, штамм стафилококка относят к тем или иным фагогруппам.
Б. Методы определения чувствительности бактерий к антибиотикам
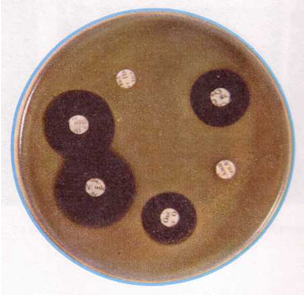
а) Метод дисков. Бумажные диски, пропитанные определенными антибиотиками, помещают на газон исследуемой бактериальной культуры в чашке Петри, Посевы инкубируют в течение 16-24 часов, после чего учитывают результаты опыта по образованию зон задержки роста бактерий.
По диаметру зон задержки роста ориентировочно судят о степени чувствительности бактерий к антибиотикам (рис. 2). Зона задержки роста до 15 мм указывает на слабую, до 25 мм - на среднюю и свыше 25 мм - на высокую чувствительность. Более точные результаты получают при использовании метода серийных разведений.
б) Метод серийных разведений. Этот метод позволяет определить минимальную задерживающую концентрацию антибиотика для данного микроорганизма (МЗК) как на жидких, так и на плотных питательных средах.
МПБ разливают по 2 мл в серию пробирок. Готовят основной раствор антибиотика, для чего берут навеску антибиотика и растворяют в дистиллированной воде из расчета 1 мг антибиотика на мл растворителя.
Левомицетин предварительно растворяют в 96° этиловом спирте из расчета 0,25 мл спирта на 1 мг антибиотика; после полного растворения добавляют такое количество дистиллированной воды, чтобы раствор содержал в 1 мл 1 мг антибиотика.
Тетрациклин и окситетрациклин растворяют в сантинормальном растворе соляной кислоты из расчета 1 мл на 1 мг антибиотика.
Эритромицин сначала растворяют в чистом метиловом спирте из расчета 1 мл на 10 мг эритромицина. После растворения добавляют такое количество дистиллированной воды, чтобы получить раствор, содержащий в 1 мл 1 мг антибиотика.
Исходный раствор антибиотика в количестве 2 мл вносят в первую пробирку с МПБ, перемешивают и получают определенную его концентрацию.
Из первой пробирки 2 мл разведенного антибиотика переносят во вторую пробирку и после перемешивания переносят 2 мл в третью пробирку и т.д. до предпоследней, откуда 2 мл выливают. Последняя пробирка является контролем, в ней нет антибиотика и она свидетельствует о пригодности среды для роста культуры.
После разведения антибиотика во все пробирки вносят по 0,1 мл испытуемой бульонной культуры. Для этого используют 3-4-часовые или 18-часовые культуры, разведенные МПБ в 50 раз.
Пробирки помещают в термостат на 12-18 часов, но предварительные результаты можно учитывать через 6-8 часов.
По истечении необходимого срока инкубации определяют максимальное разведение антибиотика, которое еще подавляет рост культуры. Концентрация антибиотика в последней пробирке с видимой задержкой роста и представляет собой минимальную задерживающую концентрацию антибиотика (МЗК) или минимальной подавляющей концентрацией (МПК).
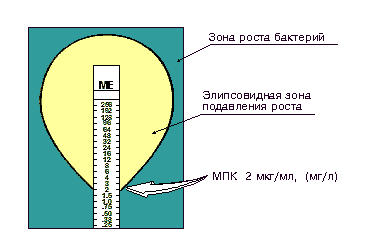
Штамм считается чувствительным к антибиотикам, если МЗК препарата для данного штамма соответствует концентрации этого препарата, создаваемой в организме. Измеряется МПК в мг/л или мкг/мл (рис.7).
Минимальная подавляющая концентрация (МПК) - наименьшая концентрация антибиотика (мг/л или мкг/мл), которая in vitro полностью подавляет видимый рост бактерий.

Рис. 7. Определение значения МПК методом разведения в жидкой питательной среде.
в) Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис.3). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
| 
|
| Рис. 8. Зоны задержки роста при дисковом методе определения чувствительности к антибиотикам | Рис. 9. Определение чувствительности микроорганизмов с помощью Е-тестов |
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
З А Н Я Т И Е 5
Дата ______________
Тема: Микробиологическая диагностика дифтерии и коклюша
План занятия:
1. Изучение морфологии и культуральных свойств дифтерийной палочки. Макро- и микроскопия культур бактерий.
2. Типы дифтерийных бактерий. Разбор особенностей роста культур соответствующих типов на теллуритовых средах.
3. Биохимические свойства коринебактерий. Дифференциация истинных дифтерийных бактерий от псевдодифтерийных и дифтероидов по биохимическим свойствам. Демонстрация и разбор.
4. Правила взятия и пересылки материала от больного дифтерией для бактериологического исследования. Разбор.
5. Бактериологическая диагностика дифтерии. Разбор схемы исследования дифтеритической пленки (или материала от бактерионосителя).
6. Определение токсигенности дифтерийных бактерий реакцией преципитации в агаре и биопробой на морской свинке. Разбор и демонстрация.
7. Изучение морфологии и культуральных свойств коклюшной палочки.
8. Микробиологическая диагностика коклюша. Разбор схемы.
9. Знакомство с иммунопрепаратами, применяемыми для профилактики и лечения дифтерии и коклюша.
Методические указания
1. Изучение морфологии и культуральных свойств дифтерийной палочки. Макро- и микроскопия культур бактерий
Готовые фиксированные мазки из чистой культуры дифтерийной палочки окрасить синькой Леффлера и по Нейссеру. Дифтерийные бактерии окрашиваются неравномерно, более интенсивно окрашиваются зерна волютина. При окраске метиленовым синим наблюдается явление метахромазии. По способу Нейссера зерна окрашиваются в темно-коричневый цвет. Дифтерийные палочки располагаются под углом друг к другу в виде римской цифры V. Препараты промикроскопировать и зарисовать.
Знакомство с характером роста возбудителя дифтерии на свернутой сыворотке, на теллуритовых средах.
2. Типы дифтерийных бактерий. Разбор особенностей роста культур соответствующих типов на теллуритовых средах
Разбор особенностей колоний различных типов дифтерийной палочки на теллуритовой среде – форма, размеры, цвет, блеск. Характер их роста на жидких средах - помутнение, осадок, пленка.
3. Биохимические свойства коринебактерий. Дифференциация истинных дифтерийных бактерий от псевдодифтерийных и дифтероидов по биохимическим свойствам. Демонстрация и разбор
Знакомство с биохимическими свойствами дифтерийной палочки по биохимическим наборам. Демонстрация и разбор. Заполнить таблицу.
Табл.1. Свойства дифтерийной палочки и близких к ней коринебактерий
| Вид | Сахароза | Глюкоза | Крахмал | Проба Пизу | Проба на уреазу | Токси-генность |
| Дифтерийная палочка | ||||||
| Дифтероид | ||||||
| Ложнодифтерийная палочка |
Обозначить знаками + или -.
Знак + означает наличие признака. Знак – означает отсутствие признака.
4. Правила взятия и пересылки материала от больного дифтерией для бактериологического исследования. Разбор
Исследованию подвергаются слизь или пленка из зева, носа, носоглотки, миндалин. Реже исследуется материал с конъюнктивы глаза, со слизистой оболочки половых органов или с поверхности ран. Материал берут стерильным тампоном. Тампон погружают в стерильную пробирку с этикеткой, на которой указаны фамилия, имя, отчество, возраст больного и из какого места (полости) взят материал. Пробирки с материалом помещают в металлические пеналы и с нарочным отправляют в лабораторию для доследования. Разбор методики взятия материала из зева, носа и других мест и посева его при дифтерии.
5. Бактериологическая диагностика дифтерии. Разбор схемы исследования дифтеритической пленки (или материала от бактерионосителя)
С помощью стерильного ватного тампона произвести друг у друга забор материала со слизистой зева или носа и сделать посев на сывороточную среду с теллуритом.
Произвести макро- и микроскопическое изучение выросших подозрительных колоний. Препараты окрасить синькой Леффлера, по Граму и по Нейссеру. Результаты зарегистрировать в тетради. При обнаружении коринебактерий сделать посев на среды с глюкозой, сахарозой, цистином и мочевиной. Одновременно сделать посев для определения токсигенности бактерий.
6. Определение токсигенности дифтерийных бактерий реакцией преципитации в агаре и биопробой на морской свинке. Разбор и демонстрация.
Методика определения токсигенных свойств возбудителя дифтерии преципитацией в агаре заключается в следующем. Полоски фильтровальной бумаги размером 1,5x8 см, простерилизованные в автоклаве, смачивают антитоксической противодифтерийной сывороткой, разведенной стерильным физиологическим раствором до содержания 500 АЕ в 1 мл. Смоченную сывороткой бумажку стерильным пинцетом переносят на поверхность питательной среды в чашку Петри. Чашку подсушивают в термостате 15-20 минут. Испытуемые культуры засевают бляшками по обе стороны от фильтровальной бумажки. На одну чашку засевают несколько штаммов, один из которых заведомо токсигенный и служит контролем. Чашки с посевом помещают в термостат при температуре 37°С. Результат учитывают в течение 48 часов. В месте взаимодействия антитоксина с токсином образуется линия преципитации. Если исследуемая культура образует токсин, то ее линия преципитации сливается с линией преципитации контрольного штамма, образуя сплошную белую полоску. При неспецифической преципитации линия, образуемая исследуемым штаммом, пересекает или имеет тенденцию к пересечению с линией контрольного штамма.
Демонстрация чашек с культурами токсигенной и нетоксигенной дифтерийной палочки. Зарисовать схему определения токсигенных свойств возбудителя дифтерии.
Определить токсигенные свойства дифтерийной палочки можно также методом биопробы. Для опыта берут двух морских свинок, накануне одной из них вводят 500-1000 АЕ антитоксической противодифтерийной сыворотки. Затем свинкам вводят подкожно (0,2 мл) или внутрикожно (0,1 мл) исследуемую культуру. Если испытуемая культура токсигенна, то при подкожном введении опытная свинка через 2-5 дней погибает. При вскрытии обнаруживается отек в месте введения культуры, экссудат в брюшной и грудной полостях и в перикарде. Особенно характерным симптомом является увеличение и гиперемия надпочечников. Контрольная свинка остается живой. При внутрикожном введении токсигенной культуры у опытной свинки в месте инъекции наблюдается покраснение, отечность, а в дальнейшем - некроз. У контрольной морской свинки никаких изменений не отмечается.
7. Изучение морфологии и культуральных свойств коклюшной палочки
Промикроскопировать готовые препараты-мазки из культуры коклюшной палочки с окраской по Граму и зарисовать.
Ознакомиться с ростом коклюшной и паракоклюшной палочек на средах Борде-Жангу, казеиново-угольной и средах "пестрого ряда". Демонстрация.
8. Микробиологическая диагностика коклюша. Разбор схемы
Разбор методов микробиологической диагностики коклюша: бактериологического и серологического. Дифференциация коклюшной и паракоклюшной палочек.
9. Знакомство с иммунопрепаратами, применяемыми для профилактики и лечения дифтерии и коклюша
Знакомство с иммунопрепаратами: адсорбированный дифтерийный анатоксин, противодифтерийная сыворотка, адсорбированный дифтерийно-столбнячный анатоксин, адсорбированная коклюшно-дифтерийно-столбнячная вакцина и др.
| Рис. 1. Окраска по Нейссеру | Рис.2. Окраска метиленовым синим |
Corynebacterium diphtheriae
Контрольные вопросы
1. Какие микробиологические методы применяются для диагностики дифтерии?
2. Какой материал берется для исследования при подозрении на дифтерию и при обследовании на бактерионосительство?
3. Какие морфологические признаки присущи дифтерийной палочке?
4. Каковы тинкториальные особенности возбудителя дифтерии?
5. По каким признакам дифференцируют типы гравис, митис и интермедиус?
6. По каким биохимическим признакам отличают дифтерийную палочку от дифтероидов?
7. В чем заключается сущность пробы Пизу?
8. Какими методами и как определяют токсигенность возбудителя дифтерии?
9. Каковы пути и способы заражения дифтерией?
10. Какова роль дифтерийного батерионосительства в эпидемиологии дифтерии?
11. Как используют РПГА для обнаружения в сыворотке детей антитоксина?
12. Почему для микробиологической диагностики дифтерии необходимо выделение чистой культуры возбудителя и изучение его свойств?
13. Какие бактерии откосятся к группе гемоглобинофильных и почему они так именуются?
14. Каковы морфологические, тинкториальные, кулътуральные и биохимические признаки коклюшной палочки?
15. По каким отличительным признакам дифференцируют коклюшную палочку от паракоклюшной?
16. Какие методы микробиологической диагностики применяют при коклюше?
17. Как проводится бактериологическая и серологическая диагностика коклюша?
18. Какие иммунопрепараты применяют для специфической профилактики дифтерии и коклюша?
19. Какими факторами патогенности обладает возбудитель дифтерии?
20. Каковы способы и пути передачи возбудителя дифтерии?
21. Что поражает (какие органы и системы органов) дифтерийный токсин?
22. Каковы особенности генетического контроля синтеза токсина у возбудителя дифтерии?
23. Каковы природа и структура дифтерийного токсина?
24. Каков молекулярный механизм действия дифтерийного токсина и какой процесс в клетке он блокирует?
25. Каким образом осуществляется активация дифтерийного токсина?
26. Каким образом возможно превращение нетоксигенной дифтерийной бактерии и токсигенную?
27. Каковы особенности современной классификации дифтерийных бактерий, и какие критерии с этой целью используются?
ПРИЛОЖЕНИЕ К ЗАНЯТИЮ № 5
МЕТОДЫ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ДИФТЕРИИ
А. Бактериологический
Дата: 2019-03-05, просмотров: 428.