5 мл 1,5% -ного раствора KMnO4 разбавляют водой до 50 мл. В разбавленный раствор вводят по каплям 1,5-2 мл 1% -ного раствора Na2S2O3. Образуется желто-коричневый золь диоксида марганца.
Написать уравнение реакции.
_________________________________________________________
_________________________________________________________
Опыт № 2. Получение золя берлинской лазури
0,5 мл 20%-ного раствора K4[Fe(CN)6] разбавляют водой до 100 мл. К разбавленному раствору добавляют при перемешивании каплю насыщенного раствора FeCl3. Образуется прозрачный, синего цвета золь берлинской лазури. От двух капель FeCl3 золь еще больше синеет.
Написать уравнение реакции.
_________________________________________________________
_________________________________________________________
Опыт №3 Получение золя гексацианоферрата( II ) кобальта.
2 мл 20%-ного раствора K4[Fe(CN)6] разбавляют водой до 100 мл. В этот раствор медленно, при взбалтывании, вводят 6-7 мл 0,1%-ного раствора CoSO4. Образуется зеленого цвета золь гексациано(II) феррата кобальта. Написать уравнение реакции.
_________________________________________________________
_________________________________________________________
Опыт №4 Получение золя гексацианоферрата( II ) меди ( II ).
0,5 мл 20%-ного раствора K4[Fe(CN)6] разбавляют водой до 100 мл. В разбавленный раствор прибавляют 3-4 капли 10 %-ного раствора CuSO4 при взбалтывании. Образуется красно-бурый золь гексациано(II) феррата меди (II). Написать уравнение реакции.
_________________________________________________________
_________________________________________________________
Опыт №5. Получение золя гидроксида железа ( III )
К 100 мл кипящей воды прибавляют 3-4 капли насыщенного раствора FeCl3. Образуется золь Fe(OH)3 вишнево-красного цвета. Написать уравнение реакции.
_________________________________________________________
_________________________________________________________
Опыт №6. Получение золя серы.
К 50 мл воды добавляют при взбалтывании по каплям 4-5 мл насыщенного (без нагревания) раствора серы в этиловом спирте. Образуется голубоватый опалесцирующей золь серы в воде.
Вопросы для контроля
1.Какие системы называются дисперсными? Привести примеры.
2.Чем отличаются истинные растворы, коллоидные и грубодисперсные системы?
3.Назовите методы получения дисперсных систем.
4.Чем объясняется устойчивость золей?
5.Что такое пептизация? Каковы виды пептизации?
6.Что такое химическая и физическая конденсация?
7.Условия необходимые при получении золя методом химической конденсации
8.Напишите формулу мицеллы для реакций:
а) AgNO3 + NaCl = AgCl ↓+ NaNO3 – стабилизатор NaCl.
б) (NH4)2S + МnCl2 → 2NH4Cl + МnS↓– стабилизатор МnCl2
9.Какой процесс называют коагуляцией и какой седиментацией?
10.Что такое порог коагуляции?
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата_________________
Лабораторная работа № 9.
Поверхностное натяжение растворов поверхностно-активных веществ
Цель работы
1. Определение поверхностного натяжения для растворов спирта на границе раствор - воздух методом наибольшего давления пузырьков воздуха.
2. Построение изотерм поверхностного натяжения и адсорбции для растворов спирта
Теоретическая часть
Молекулы, находящиеся на поверхности жидкости, и молекулы, находящиеся внутри неё, взаимодействуют с окружающими их молекулами неодинаково. Внутри жидкости молекулы притягиваются одинаково по всем направлениям, вследствие этого равнодействующая всех сил равна нулю. Молекулы, находящиеся на границе раздела жидкость-газ, притягиваются неодинаково по различным направлениям. Если часть сил этих молекул, направленных в газовую фазу некомпенсирована, то взаимодействием молекул газа и жидкости, вследствие их малого значения, можно пренебречь. Поэтому равнодействующая сил молекул, находящихся в поверхностном слое, направлена перпендикулярно поверхности внутрь жидкости. Некомпенсированные силы молекул на поверхности раздела фаз жидкость – газ характеризуют свободную энергию поверхности. Свободная энергия единицы поверхности (1 см2) называется поверхностным натяжением. Величина свободной энергии поверхности определяется уравнением
G= σ·S, (1)
где G – свободная энергия поверхности (эрг),
σ – поверхностное натяжение жидкости (эрг/см2),
S – величина поверхности жидкости (см2).
Согласно второму началу термодинамики свободная энергия системы стремится к минимуму. В рассматриваемом случае это осуществляется либо уменьшением S (мелкие капли жидкости сливаются в более крупные), либо уменьшением σ. Так, например, водный раствор бутилового спирта, приготовленный в эквимолярном (1:1)соотношении воды и спирта, имеющих соответственно поверхностное натяжение при 20ºС – 72,8 эрг/см2 и 22,8 эрг/см2, будет иметь поверхностное натяжение меньше полусуммы поверхностных натяжений исходных жидкостей, так как на границе раздела жидкость – газ самопроизвольно концентрируются молекулы спирта. Вещества, понижающие поверхностное натяжение растворителя, называются поверхностно-активными. Чем сильнее снижается поверхностное натяжение растворителя, тем выше поверхностная активность вещества. К поверхностно-активным веществам относится большинство органических соединений, имеющих дифильное строение молекул: лиофильную функциональную группу и лиофобный углеводородный радикал.
Увеличение концентрации ПАВ в поверхностном слое раствора является частным случаем положительной адсорбции.
Поскольку увеличение концентрации вещества в высокомолекулярном поверхностном слое определить непосредственно невозможно, то адсорбцию на поверхности жидкости можно вычислить только по изменению поверхностного натяжения. Поверхностное натяжение раствора и величина адсорбции зависят от концентрации растворённого в ней вещества.
Связь между поверхностным натяжением σ× и концентрацией раствора С выражается уравнением
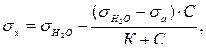 (2)
(2)
где σ Н2О – поверхностное натяжение воды,
σ а – поверхностное натяжение растворённого вещества,
С – молярная концентрация,
К – константа поверхностной активности.
Зная поверхностное натяжение и концентрацию раствора, можно вычислить адсорбцию по уравнению Гиббса:
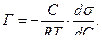 (3)
(3)
Существует несколько методов для определения поверхностного натяжения жидкостей: метод отрыва кольца, сталагмометрический метод, и метод наибольшего давления пузырьков воздуха, чаще всего применяемый в лабораторной практике.
1.Сталагмометрический метод (метод взвешивания капель), в основу которого положен принцип пропорциональности поверхностного натяжения σ массе капли Р в момент отрыва её от шлифованной поверхности кончика сталагмометра, т.е.
σ = Z·P, (4)
где Z – коэффициент пропорциональности.
Сталагмометрический метод является далеко не точным и применим для относительных измерений.
2. Метод наибольшего давления пузырьков основан на измерении давления, необходимого для образования и проскока пузырьков воздуха и пропорциональности этого давления Р поверхностному натяжению σ:
σ = Z·P.
Метод также применим только для относительных измерений.
3.Метод отрыва кольца основывается на измерении усилия, необходимого для отрыва кольца из тонкой платиновой проволоки от поверхности жидкости. При вытягивании кольца жидкость поднимается на ним, образуя двухстороннюю плёнку. В момент отрыва кольца уравновешиваются: сила отрыва и сила поверхностного натяжения, действующая по периметру кольца:
F=4 πrσ. (5)
Экспериментальная часть
Оборудование и реактивы
Для выполнения работы требуется следующее оборудование и реактивы:
1) Прибор Ребиндера для определения поверхностного натяжения жидкостей.
2) 0,8 М; 0,4М; 0,2М; 0,1М; 0,05М раствор С2Н5ОН
3) дистиллированная вода.
Схема прибора для определения поверхностного натяжения методом наибольшего давления пузырьков воздуха представлена на рисунке 3. Он состоит из измерительной пробирки, в которую наливается исследуемая жидкость. Пробирка закрывается пробкой со вставленным в неё капилляром 4. Измерительная пробирка сообщается с атмосферой через прорезь в пробке. Капиллярный кончик соединён со стеклянным шариком 7, в котором воздух сжимается водой, поступающей из воронки 6. Создаваемое в системе давление измеряется разностью уровней жидкости в коленах жидкостного U-образного манометра 1.
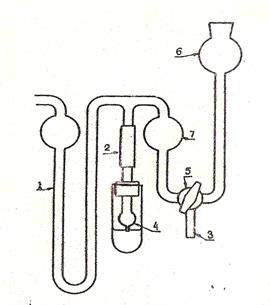
Рисунок 3. Прибор Ребиндера для определения поверхностного натяжения жидкостей.
1 – манометр, 2 – шкала манометра, 3 – соединительная резиновая трубка, 4 – капиллярная трубка в измерительной пробирке с раствором спирта, 5 – трёхходовой кран, 6 – воронка для водопроводной воды, 7 – буферный шарик.
Методика выполнения работы
Определение поверхностного натяжения жидкостей этим методом заключается в следующем: в исследуемую жидкость, налитую в измерительную пробирку, опускают капилляр так, чтобы он едва касался её поверхности. В тот момент, когда пузырек воздуха проскакивает через капилляр, он преодолевает сопротивление только поверхностного слоя жидкости.
Если теперь в капилляр сверху под давлением Р подать воздух, то он будет вытеснять исследуемую жидкость из капилляра.
Как только давление окажется больше силы, удерживающей жидкость в капилляре, из капилляра выскочит пузырёк воздуха. Таким образом, получается, что поверхностное натяжение пропорционально давлению, измеренному манометром в момент проскока пузырька воздуха, т.е.
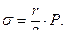 (6)
(6)
В манометрической трубке давление Р равно произведению удельного веса манометрической жидкости D на разность уровней её в коленах манометра Н, т.е.
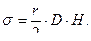 (7)
(7)
Чем больше поверхностное натяжение раствора σ, тем больше Н.
Так как метод применим только для относительных измерений, то определяя разность уровней в манометре для двух жидкостей в пробирке с одним и тем же капилляром, будем иметь
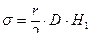 и
и 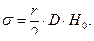 (8)
(8)
Относительное поверхностное натяжение будет равно:
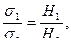 откуда
откуда 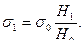 (9)
(9)
Если одной из жидкостей будет дистиллированная вода, поверхностное натяжение которой известно, тогда поверхностное натяжение исследуемой жидкости
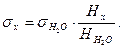 (10)
(10)
Так как поверхностное натяжение дистиллированной воды при 20ºС постоянно и равно 72,8 эрг/см2, а разность уровней манометрической жидкости для данного капилляра при работе с водой тоже постоянна, то можно определить постоянную капилляра Z:
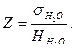 (11)
(11)
Поверхностное натяжение исследуемой жидкости можно вычислить тогда по формуле
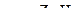 (12)
(12)
Задание 1. Определение постоянной капилляра
Работу начинают с определения постоянной капилляра. Трехходовой кран 5 ставят меткой вверх. В воронку 6 заливают водопроводную воду на три четверти объёма воронки. Отсоединяют пробирку с капилляром от прибора. Капилляр нельзя трогать руками. В измерительную пробирку (до расширяющейся части) наливают дистиллированную воду. Три раза промывают капилляр, засасывая в него дистиллированную воду. Наливают новую порцию дистиллированной воды до расширяющейся части конической пробирки, закрывают пробирку пробкой с капилляром так, чтобы капилляр едва касался поверхности воды, и соединяют капиллярную трубочку с прибором резиновой трубкой 3. осторожно поворачивают трёхходовой кран вправо, чтобы вода из воронки поступала в стеклянный шарик, не допуская наполнения шарика водой больше, чем наполовину. По мере поступления воды воздух в шарике 7 сжимается. Это сжатие измеряется манометром по разности уровней в манометрической жидкости. Разность уровней достигает наибольшей величины, которую и необходимо отсчитать в момент проскока пузырька воздуха из капилляра. Пузырёк воздуха должен проскакивать один раз в 10-15 сек. Измерение проводят сначала в одном колене манометра, а потом в другом.
Например, в левом колене в момент проскока пузырька уровень жидкости поднялся до 35, в правом– до 34 мм, тогда разность уровней (Н) равна 35+34=69.
Измерив несколько раз величину наибольшей разности уровней (не менее трёх совпадающих измерений, отличающихся между собой не более, чем на 1 мм) и записав их в таблицу 3, отсоединяют капилляр от прибора и только после этого выливают из шарика 7 воду, повернув трёхходовой кран влево. Затем вынимают капилляр из измерительной пробирки и выливают дистиллированную воду. Вычисляют постоянную капилляра (Z).
Задание 2. Определение поверхностного натяжения поверхностно-активных веществ (предельных спиртов)
Когда определяют поверхностное натяжение е жидкостей одного гомологического ряда их исследование начинают с жидкости, имеющей наименьшую длину углеводородного радикала.
Измерительную пробирку и капилляр ополаскивают 2-3 раза исследуемым спиртом. Промывной раствор выливают. В измерительную пробирку наливают новую порцию исследуемого раствора и производят измерение разностей уровней для спирта. Вычисляют поверхностное натяжение исследуемого спирта. Результаты также записывают в таблицу 3.
Задание 3. Определение поверхностного натяжения водных растворов этилового (изобутилового) спирта различной концентрации
При определении поверхностного натяжения растворов различной концентрации одного и того же вещества исследования начинают с растворов наименьшей концентрации. Измерения проводят по методике, описанной выше для дистиллированной воды. Результаты вносят в таблицу 3 значения концентраций раствора, а по оси ординат – поверхностное натяжение.
Результаты эксперимента
Таблица 3
| Исследуемая жидкость | С, моль/л | Н, мм | Z прибора | σ эрг/см2 | |||
| 1 изм. | 2 изм. | 3 изм. | Среднее | ||||
| Вода | |||||||
Вычисления
1. Рассчитать константу прибора 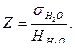
_____________________________________________________________
2. Для каждой концентрации определить поверхностное натяжение 
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
_____________________________________________________________
. На основании полученных данных начертить график зависимости поверхностного натяжения от концентрации, отложив по оси абсцисс значения концентраций раствора, а по оси ординат – поверхностное натяжение
| σ | ||||||||||||||||||||||||||||||||||
| С | ||||||||||||||||||||||||||||||||||
Вопросы для контроля
1.Что такое поверхностное натяжение?
2.В каких единицах в системе СИ измеряется поверхностное натяжение?
3.Какими методами измеряют поверхностное натяжение?
4.Каким методом измеряют поверхностное натяжение в работе?
5.Является ли спирт, используемый в данной лабораторной работе, поверхностно-активным веществом?
6.Какое вещество называется поверхностно-активным?
7.Сформулируйте правило Дюкло-Траубе.
8.На графике проведите изотерму поверхностного натяжения для пропилового спирта.
9.В чём заключается суть метода наибольшего давления пузырьков воздуха?
10.Приведите примеры катионактивного, анионактивного и неионогенного ПАВ.
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата_____________________
Лабораторная работа № 10
Дата: 2019-03-05, просмотров: 500.