Цель работы:
Составить формулу мицелл гидрозолей в зависимости от условий их образования, определить знак заряда коллоидных частиц
Теоретическая часть.
Коллоидные системы состоят из дисперсной фазы (ДФ) и дисперсионной среды (ДС). Мицелла – это частица дисперсной фазы вместе с двойным электрическим слоем.
Мицелла имеет сложное строение, она состоит из агрегата, потенциалопределяющих ионов и противоионов.
Внутреннюю часть мицеллы составляет агрегат основного вещества. Агрегат состоит из большого числа (m) молекул или атомов труднорастворимого вещества. Агрегат в целом электронейтрален. На его поверхности адсорбируются ионы из раствора – потенциалопределяющие ионы (ПОИ).
Чтобы определить потенциалопределяющие ионы используют правило Фаянса – Панета – Пескова: «На твердой поверхности агрегата в первую очередь адсорбируются ионы, которые:
- входят в состав агрегата;
- способны достраивать кристаллическую решетку агрегата;
- образуют малорастворимое соединение с ионами агрегата;
- изоморфны с ионами агрегата».
Агрегат вместе с потенциалопределяющими ионами составляет ядро мицеллы. Ядро мицеллы, имеющее заряд (за счет ПОИ), притягивает ионы противоположного заряда – противоионы (ПИ) из раствора.
Часть (n-x) противоионов находится в непосредственной близости от ядра, прочно связана с ним за счет адсорбционных и электростатических сил, и образует адсорбционный слой.
Ядро вместе с противоионами плотной части двойного электрического слоя (адсорбционный) образуют гранулу или коллоидную частицу. Знак заряда коллоидной частицы определяется знаком заряда потенциалопределяющих ионов.
Коллоидную частицу окружают противоионы диффузного слоя – остальная часть противоионов, подвергающихся броуновскому движению и менее прочно связанная с ядром. В целом образуется мицелла. Мицелла в отличие от коллоидной частицы электронейтральна.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) ПОИ должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) ПОИ должны быть подобны ионам, которые находящимся в агрегате
3.Противоионами, образующими адсорбционный и диффузионный слой, являются оставшиеся ионы вещества стабилизатора или вещества, которое находится в реакции в избытке.
4. В формуле мицеллы коэффициенты m, n, (n-x), x являются постоянными и численно не определены.
Коагуляция – это явление слипания частиц дисперсной фазы, вследствие которого дисперсная система теряет седиментационную устойчивость. При коагуляции может произойти разделение фаз, что приводит к разрушению коллоидных систем.
Коагуляцию может вызвать изменение температуры, излучение, механические воздействия и добавление электролитов.
Минимальная концентрация электролита, которая вызывает явную коагуляцию называют порогом коагуляции (Cпк)
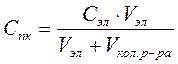
Где Сэл – концентрация электролита, моль/л; V эл – объем электролита, л; 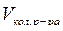 – объем коллоидного раствора, л.
– объем коллоидного раствора, л.
Величина, обратная порогу коагуляции называется коагулирующим действием 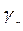
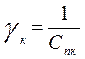
Коагулирующим действием обладает только тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы (совпадает по знаку с зарядом противоионов). Коагулирующее действие иона зависит от величины его заряда, причем тем сильнее, чем выше его заряд. Количественно эта закономерность описывается эмпирическим правилом Шульце-Гарди:
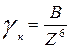
где В – константа, не зависящая от природы иона коагулянта; Z – валентность (заряд) иона коагулянта.
Пример решения задач.
Пример 1. Составьте формулу мицеллы золя иодида серебра, полученного при взаимодействии йодида калия с нитратом серебра
AgNO3 + KI → AgI↓+КNO3
Решение:
При избытке AgNO3, состав мицеллы, может быть представлен следующей формулой: [m AgI nAg+(n-x) NO3-]x+ х NO3-
Строение мицеллы:
Агрегат: m AgI
Ядро: m AgI nAg+;
Адсорбционный слой противоионов (n-x) NO3-;
Диффузный слой противоионов - х NO3-.
При избытке KI состав мицеллы, может быть представлен следующей формулой:
[m AgI nI-(n-x) К+]x- хК+
Строение мицеллы:
Агрегат: m AgI
Ядро - m AgI nI-;
Адсорбционный слой противоионов -(n-x) К+;
Диффузный слой противоионов - х К+.
Пример 2. Составить формулу мицелл золей гидроксида хрома (Ш), полученного путем смешивания равных объемов растворов сульфата хрома и гидроксида калия. Одинаковы ли концентрации реагентов, если при электрофорезе коллоидная частица перемещается к катоду?
Решение:
Электрофорез – это явление перемещения частиц дисперсной фазы относительно неподвижной дисперсионной среды в электрическом поле.
Так как коллоидная частица перемещается к катоду (к отрицательно заряженному электроду) значит, она имеет положительный заряд. Тогда потенциалопределяющими ионами будут Cr+3. , входящие в состав сульфата хрома. Поэтому концентрация Cr2(SO4)3будет больше концентрации КOH при равных объемах.
Строение мицеллы можно выразить следующей формулой
[m Cr(OH)32nCr+33(n-x) SO4-2]6x+ 3х SO4-2
Пример 3. С помощью правила Щульце-Гарди рассчитать для гидрозоля золота пороги коагуляции электролитами AlCl3 и ZnSO4.Если коллоидные частицы заряжены отрицательно и порог коагуляции под действием KCl равен 2,30·10-2 кмоль/м3.
Решение:
Коагулирующим действием для отрицательно заряженных коллоидных частиц будут служить положительно заряженные ионы электролита.
Для соли KCl – коагулирующим действием обладает однозарядный катион К+, для соли ZnSO4 - катион Zn2+ (с зарядом +2), для соли AlCl3 – катион Al3+ (с зарядом +3).
С учетом правила Шульце-Гарди, порог коагуляции ZnSO4 в 64 (26) раза меньше порога коагуляции KCl
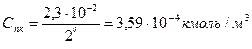
А порог коагуляции AlCl3 в 729 (36) раз меньше, чем KCl
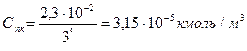
Практическая часть
Задание 1. Записать составные части мицеллы
 |  |  |
m [FeOH]3 nFe3+ 3(n – х)Сl- 3х+ 3х Сl-

Задание 2. Гидрофобный золь вещества А был получен при взаимодействии избытка вещества В с веществом С, составить формулу мицеллы, указать знак заряда коллоидной частицы.
| № | А | В | С |
| 1 | AgCl | KCl | AgNO3 |
| 2 | AgCl | AgNO3 | KCl |
| 3 | AgJ | KJ | AgNO3 |
| 4 | AgJ | AgNO3 | KJ |
| 5 | AgBr | KBr | AgNO3 |
| 6 | AgBr | AgNO3 | KBr |
| 7 | BaSO4 | Ba(NO3)2 | K2SO4 |
| 8 | BaSO4 | K2SO4 | Ba(NO3)2 |
| 9 | Fe(OH)3 | FeCl3 | H2O(NH4)2CO3 |
| 10 | Al(OH)3 | AlCl3 | H2O(NH4)2CO3 |
| 11 | Fe4[Fe(CN)6]3 | FeCl3 | K4[Fe(CN)6] |
| 12 | Fe4[Fe(CN)6]3 | K4[Fe(CN)6] | FeCl3 |
| 13 | Cu2[Fe(CN)6] | CuCl2 | K4[Fe(CN)6] |
| 14 | Cu2[Fe(CN)6] | K4[Fe(CN)6] | CuCl2 |
| 15 | FePO4 | FeCl3 | Na2HPO4 |
| 16 | AlPO4 | AlCl3 | Na2HPO4 |
| 17 | Ag3PO4 | AgNO3 | Na2HPO4 |
| 18 | MnO2 | KMnO4 | Na2S2O3 |
| 19 | Co2[Fe(CN)6] | Co(NО3)2 | K4[Fe(CN)6] |
| 20 | Cu2[Fe(CN)6] | K4[Fe(CN)6] | Co(No3)2 |
Решение:
1. Записать уравнение реакции, в результате которой образуется осадок;
_________________________________________________________
2. Записать уравнение реакции диссоциации электролита-стабилизатора
_________________________________________________________
3. Выбрать потенциалопределяющий ион, а также противоион .
_________________________________________________________
4. Записать формулу мицеллы.
Задание 3. Используя правило Шульце-Гарди для гидрозоля вещества А, рассчитать пороги коагуляции электролитами С, Д, Е. Если известно, что порог коагуляции этого золя под действием электролита В равен γк .
| № | А | Заряд кол. частицы | В | γк·10², моль/л | С | Д | Е |
| 1 | AgCl | – | KNO3 | 4,3 | CаCl2 | NaCl | Na3PO4 |
| 2 | AgJ | + | KCl | 2,8 | ZnSO₄ | K₃PO₄ | AlCl₃ |
| 3 | Fe₂(OH)₃ | + | KCl | 9,25 | CuSO₄ | Na₃PO₄ | NaNO₃ |
| 4 | AgJ | — | NaCl | 14,2 | CuSO₄ | Al(NO₃)₃ | Th(NO₃)₄ |
| 5 | Fe₂O₃ | + | NaCl | 1,18 | KNO₃ | Na₂SO₄ | K₃PO₄ |
| 6 | BaSО₄ | + | NaCl | 10,6 | K2SO4 | Al(NO₃)₃ | Na3PO₄ |
| 7 | BaSО₄ | — | KCl | 12,5 | NaCl | CuSO₄ | Al(NO₃)₃ |
| 8 | Fe4[Fe(CN)₆]₃ | + | NaCl | 15,1 | KNO₃ | CuSO₄ | Na₂PO₄ |
| 9 | Fe4[Fe(CN)₆]₃ | — | KCl | 11,1 | KNO₃ | CaCl₂ | Al(NO₃)₃ |
| 10 | Ag | + | KCl | 9,2 | CuSO₄ | NaNO₃ | K₃PO₄ |
| 11 | MnO₂ | — | NaCl | 103 | NaBr | Ca(NO₃)₂ | AlCl₃ |
| 12 | AgCl | + | NaCl | 14,0 | CuSO₄ | Na₃PO₄ | NaNO₃ |
| 13 | Cu₂ [Fe(CN)₆] | – | NaCl | 17,5 | Na₂SO₄ | K₃PO₄ | Cu(NO₃)₂ |
| 14 | Cu₂ [Fe(CN)₆] | — | KCl | 17,1 | Na₂SO₄ | CaCl2 | Al(NO₃)₃ |
| 15 | FePO₄ | + | NaCl | 14,3 | Na₂SO₄ | K₂SO4 | CaCl₂ |
| 16 | FePO₄ | — | KCl | 12,3 | K₃PO₄ | Ca(NO₃)₂ | AlCl₃ |
| 17 | Cо₂ [Fe(CN)₆] | + | NaCl | 15,1 | KBr | K₂SO₄ | Na3PO₄ |
| 18 | Cо₂ [Fe(CN)₆] | — | KCl | 16,3 | NaCl | CuSO₄ | Al(NO₃)₃ |
| 19 | AlPO₄ | — | KCl | 12,4 | K₂SO₄ | AlCl₃ | Cu(NO₃) ₂ |
| 20 | AlPO₄ | + | NaCl | 8,4 | K₄Fe(CN)₆ | CuSO₄ | NaNO₃ |
Решение:
1. Установить ионы, которые обладают коагулирующим действием:
______________________________________________________
2. Рассчитать порог коагуляции для электролита С
_________________________________________________________
3. Рассчитать порог коагуляции для электролита Д
________________________________________________________
4. Рассчитать порог коагуляции для электролита Е
_________________________________________________________
Задание 4. Гидрозоль BaSO4 был получен методом химической конденсации в избытке хлорида бария. К какому электроду движутся частицы при электрофорезе. Написать формулу мицеллы.
| Дано: | Решение: |
| Найти | Ответ: |
Задание 5. Определить к какому электроду при электрофорезе должны перемещаться частицы золя, получаемого методом химической конденсации в избытке Н2S.
2Н3АsО3 + 3Н2S →Аs2S3+ 6Н2О
| Дано: | Решение: |
| Найти: | Ответ: |
Задание 6. Определить к какому электроду при электрофорезе должны перемещаться частицы золя йодида серебра, получаемый по реакции:
КI + АgNО3→К NО3 + АgI
При некотором избытке КI.
| Дано: | Решение: |
| Найти: | Ответ: |
Вопросы для контроля
1. Строение двойного электрического слоя (ДЭС)
2. Теории строения ДЭС
3. Дать понятие мицеллы
4. Назвать структурные единицы мицеллы
5. Правило Фаянса – Панета – Пескова
6. Дать понятие коагуляции
7. Дать понятие электрофорез, электроосмос
8. Какие ионы, добавленные в раствор, могут вызвать коагуляцию?
9. Правило Шульце-Гарди
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата___________________
Лабораторная работа № 8
Получение дисперсных систем
Цель работы
Методом химической конденсации получить дисперсные системы и исследовать их свойства
Теоретическая часть
Дисперсные системы – это гетерогенные системы, состоящие из нескольких фаз, одна из которых является раздробленной (дисперсная фаза), прерывной, а другая представляет собой нераздробленную, непрерывную часть (дисперсионная среда).
Коллоидные растворы – это высокодисперсные гетерогенные системы, в которых хотя бы одно вещество находится в коллоидном состоянии. Вещество раздроблено до частиц размером10–7–10–9м (дисперсная фаза), невидимых в оптический микроскоп, распределенных в дисперсионной среде.
Коллоидные растворы занимают промежуточное положение между истинными растворами (10–10 м) и грубодисперсными системами (более 10–7 м). Методы получения дисперсных систем делятся на две основные группы:
1)диспергирование – дробление крупных частиц до коллоидной дисперсности;
2)конденсация – соединение частиц растворенного вещества в более крупные агрегаты коллоидного размера.
Диспергационные методы включают прежде всего механические способы измельчения. Это истирание, дробление, удар, расщепление. В лабораториях для измельчения используются дробилки, жернова и мельницы различного типа (шаровые, коллоидные).
Чтобы облегчить диспергирование и уменьшить затраты энергии применяют поверхностно-активные вещества при этом наблюдается эффект адсорбционного понижения прочности, или эффект П. А. Ребиндера.
В настоящее время часто используется ультразвуковой метод, в котором разрывающие усилия возникают вследствие меняющихся локальных сжатий и расширений жидкости при прохождении волны.
Методом вольтовой дуги, возникающей между электродами в жидкости (электрическое диспергирование) получают гидрозоли щелочных металлов.
В основе методов конденсации при получения дисперсных систем лежат процессы образования новой фазы из молекул, атомов, ионов в гомогенной среде. При этом система должна находиться в пересыщенном состоянии. Если в новой фазе химический потенциал вещества меньше, чем в исходной, то процесс возможен.
В зависимости от природы сил, вызывающих конденсацию, различают физическую и химическую конденсацию.
При физической конденсации требуются условия, при которых молекулы или ионы будут конденсироваться, образуя дисперсную фазу. Также конденсация должна прекратиться, когда частицы достигнут коллоидных размеров. Физическая конденсация может осуществляться путем конденсации паров или путем замены растворителя.
Конденсация из паров достигается изменением параметров системы. Например, к возникновению новой фазы приводит понижение температуры пара, когда пар становится пересыщенным и частично конденсируется
В методе замены растворителя изменяют состав и свойства среды. Например, вливая большой объем воды в насыщенный раствор молекулярной серы в этиловом спирте. Новый раствор оказывается пересыщенным, молекулы серы образуют частицы новой фазы. Этим методом получают золи органических веществ, серы, канифоли, фосфора, мышьяка, ацетилцеллюлозы. При этом в исходные растворы веществ в этиловом спирте или ацетоне вливают в воду.
Методы химической конденсации основаны на выделении новой фазы из пересыщенного раствора, но она образуется в результате химической реакции, например, реакций окисления, гидролиза, диссоциации, обмена. Реакцию надо вести в разбавленном растворе, чтобы скорость роста кристаллических частиц была снижена. Данное условие позволяет получить частицы размером10–7–10–9 м, вследствие этого обеспечивается седиментационная устойчивость системы.
Второе условие для обеспечения агрегативной устойчивости: одно из реагирующих веществ нужно в избытке, чтобы сформировать на поверхности двойной электрический слой (ДЭС).
Экспериментальная часть
Дата: 2019-03-05, просмотров: 943.