Давление насыщенного пара над каждой жидкостью при определенной температуре есть величина постоянная.
Давление пара, при котором при данной температуре наступает равновесие, которое характеризуется равенством скоростей испарения и конденсации жидкости, называется давлением насыщенного пара.
Опытным путем доказано, что давление насыщенного пара растворителя над раствором будет всегда ниже, чем над чистым растворителем при той же температуре. Это можно объяснить исходя из принципа Ле-Шателье. Между жидкостью и паром устанавливается равновесие: (H2O)ж ↔ (H2O)пар
При растворении в воде вещества количество жидкой воды (вследствие гидратации) становится меньше и начинается процесс конденсации пара (процесс увеличения количества жидкости). Новое равновесие устанавливается при более низком давлении насыщенного пара.
Снижение давления насыщенного пара будет тем больше, чем больше концентрация растворенного вещества. Французский химик Рауль установил, что относительное снижение давления пара растворителя над раствором равно мольной доле растворенного вещества (закон Рауля):
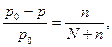 (2)
(2)
где p0 – давление пара над чистым растворителем; p – давление пара растворителя над раствором; n – количество растворенного вещества, моль; N – количество растворителя, моль.
Из закона Рауля следует, что растворы начинают кипеть при более высокой температуре, а замерзать при более низкой. При температуре, когда давление насыщенного пара равно внешнему давлению жидкость начинает кипеть
Если давление пара над раствором ниже, чем над чистым растворителем, то оно станет равно атмосферному давлению при более высокой температуре.
Повышение температуры кипения и понижение температуры замерзания соответствуют принципу Ле-Шателье: (H2O) ж. ↔ (H2O) тв.
Если растворить в воде любое вещество, то концентрация молекул воды снизится и начнется процесс плавления льда. Новое равновесие установится при более низкой температуре.
Рауль установил: для разбавленных растворов неэлектролитов повышение температуры кипения Δtкип и понижение температуры замерзания Δtзам пропорционально моляльной концентрации растворенного вещества b(x).
Δ t зам = Kкb(x) (3)
Δ t кип = Kэb(x) (4)
Kэ и Кк соответственно эбулиоскопическая и криоскопическая константы.
Они зависят от природы растворителя и не зависят от природы растворенного вещества. Эбулиоскопическая и криоскопическая константы показывают, на сколько повышается температура кипения Δtкип или снижается температура замерзания Δtзам раствора, если он содержит 1 моль вещества в 1 кг растворителя.
Пример решения задач
Пример 1 Вычислите осмотическое давление раствора, содержащего в
1,4 л 63 г глюкозы С6Н12О6 при 0°С.
Решение:
Осмотическое давление раствора определяют согласно закону Вант-Гоффа:
Poc м = nRT / V ,
В 1,4 л раствора содержится 63 г глюкозы, молярная масса которой равна 180,16 г/моль. Следовательно, в 1,4л раствора содержится
n= 63/180,16=0,35моль глюкозы.
Осмотическое давление этого раствора глюкозы:
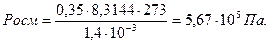
Пример 2. Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при данной температуре равняется 2,5·104 Па.
Решение:
Давление пара над раствором нелетучего вещества в растворителе всегда ниже, чем над чистым растворителем.
Согласно закону Рауля :
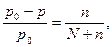
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
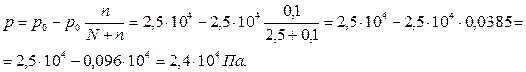
Пример 3. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола 80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:
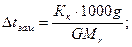
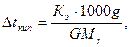
где g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
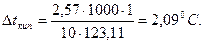
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
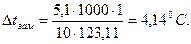
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Практическая часть
Задание 1. Найти молекулярную массу неэлектролита, если при растворении m, г его в х, г воды при 10°С давление насыщенного пара раствора понизилось на Δp, Па.
| Вариант | х, г | m, г | Δp , Па |
| 1 | 120 | 16 | 28,4 |
| 2 | 300 | 45 | 30,0 |
| 3 | 200 | 20 | 24,3 |
| 4 | 250 | 30 | 21,1 |
| 5 | 350 | 15 | 22,0 |
| 6 | 240 | 31 | 25,0 |
| 7 | 450 | 50 | 19,3 |
| 8 | 260 | 23 | 30,0 |
| 9 | 280 | 35 | 32,0 |
| 10 | 300 | 45 | 35,5 |
| 11 | 310 | 24 | 25,9 |
| 12 | 150 | 17 | 24,3 |
| 13 | 420 | 40 | 37,8 |
| 14 | 180 | 20 | 34,4 |
| 15 | 300 | 32 | 36,6 |
Решение:
1. Используя справочную литературу, выписать значение давление насыщенного пара над водой
p 0 =________________________________________________________
2. Определить количество растворителя:
N=_________________________________________________________
3. Определить количество растворенного вещества:
n =________________________________________________________
5. По закону Рауля рассчитать молекулярную массу неэлектролита:
Mr=_________________________________________________________
Задание 2. Чтобы приготовить антифриз на V, л, воды было взято вещества А m, г. Чему равна температура замерзания приготовленного раствора антифриза?
| Вариант | V, л | А | m, г |
| 1 | 2 | C 2H 4(OH)2 | 990 |
| 2 | 1 | С3Н5(ОН)3 | 495 |
| 3 | 2 | С3Н7ОН | 890 |
| 4 | 1,5 | C 2H 4(OH)2 | 200 |
| 5 | 2,5 | С2Н5ОН | 250 |
| 6 | 5 | С3Н7ОН | 371 |
| 7 | 3 | С3Н5(ОН)3 | 285 |
| 8 | 2 | C 2H 4(OH)2 | 240 |
| 9 | 3,5 | С2Н5ОН | 312 |
| 10 | 4 | С3Н7ОН | 295 |
| 11 | 3 | C 2H 4(OH)2 | 326 |
| 12 | 2 | С3Н5(ОН)3 | 300 |
| 13 | 1,5 | С2Н5ОН | 156 |
| 14 | 1,5 | C 2H 4(OH)2 | 189 |
| 15 | 4 | С3Н5(ОН)3 | 310 |
Решение:
1. Используя справочную литературу, выписать значение криоскопической константы для воды
Кк=___________________________________________________
2. Определить массу растворителя
g =________________________________________________________
3. Определить молекулярную массу растворенного вещества
Mr=_________________________________________________________
4. По закону Рауля рассчитать понижение температуры замерзания
Δ t зам=_____________________________________________________
5.Найти температуру замерзания раствора
t зам=_____________________________________________________
Задание 3. Вычислить осмотическое давление раствора, содержащего m, г, вещества А в х, г, воды при температуре 20°C . Плотность раствора считать равной единице.
| Вариант | А | m, г | х, г |
| 1 | С12Н22О11 | 16 | 350 |
| 2 | С6Н12О6 | 45 | 300 |
| 3 | С12Н22О11 | 20 | 200 |
| 4 | СО(NH2)2 | 30 | 250 |
| 5 | С12Н22О11 | 15 | 350 |
| 6 | С2Н4(OH)2 | 31 | 240 |
| 7 | С6Н12О6 | 50 | 450 |
| 8 | С12Н22О11 | 23 | 260 |
| 9 | С2Н4(OH)2 | 35 | 380 |
| 10 | С3Н5 (OH)3 | 45 | 400 |
| 11 | С12Н22О11 | 24 | 310 |
| 12 | СО(NH2)2 | 17 | 150 |
| 13 | С6Н12О6 | 40 | 420 |
| 14 | С12Н22О11 | 20 | 180 |
| 15 | С2Н4(OH)2 | 32 | 400 |
Решение:
1. Определить молекулярную массу растворенного вещества:
Mr=_________________________________________________________
2. Определить количество растворенного вещества:
n =________________________________________________________
3. Определить объем раствора:
V=_________________________________________________________
4. Температуру выразить в Кельвинах:
Т=_________________________________________________________
5. По закону Вант-Гоффа рассчитать осмотическое давление:
Pocм =_____________________________________________________
Задание 4. Вычислите t кип температуру кипения X %-го водного раствора вещества А:
| Вариант | А | X,% |
| 1 | С4Н9ОН | 12,5 |
| 2 | С6Н12О6 | 9,0 |
| 3 | С12Н22О11 | 10,5 |
| 4 | СО(NH2)2 | 13,0 |
| 5 | С12Н22О11 | 10,0 |
| 6 | С2Н4(OH)2 | 14,0 |
| 7 | С3Н7ОН | 11,0 |
| 8 | С12Н22О11 | 12,0 |
| 9 | С2Н4(OH)2 | 16,0 |
| 10 | С3Н5 (OH)3 | 10,0 |
| 11 | С4Н9ОН | 12,5 |
| 12 | СО(NH2)2 | 10,0 |
| 13 | С6Н12О6 | 13,0 |
| 14 | С3Н7ОН | 15,0 |
| 15 | С2Н4(OH)2 | 14,0 |
Решение:
1. Используя справочную литературу, выписать значение эбулиоскопической константы для воды
Кэ=___________________________________________________
2. Определить молекулярную массу растворенного вещества
Mr=_________________________________________________________
2. Приняв массу раствора за 100 грамм, определить массу растворителя и массу растворенного вещества
g =________________________________________________________
G =________________________________________________________
4. По закону Рауля рассчитать повышение температуры кипения
Δ t кип=_____________________________________________________
5.Найти температуру кипения раствора
t кип=_____________________________________________________
Задание 5. При температуре 320 К давление насыщенного пара над водой равно 8,2 кПа. На сколько понизится давление пара Δp при указанной температуре Т , если в воде m, г, растворить х, г, вещества А?
| Вариант | А | m, г | х, г |
| 1 | С12Н22О11 | 120 | 16 |
| 2 | С6Н12О6 | 300 | 45 |
| 3 | С12Н22О11 | 200 | 20 |
| 4 | СО(NH2)2 | 250 | 30 |
| 5 | С12Н22О11 | 350 | 15 |
| 6 | С2Н4(OH)2 | 240 | 31 |
| 7 | С6Н12О6 | 450 | 50 |
| 8 | С12Н22О11 | 260 | 23 |
| 9 | С2Н4(OH)2 | 280 | 35 |
| 10 | С3Н5 (OH)3 | 300 | 45 |
| 11 | С12Н22О11 | 310 | 24 |
| 12 | СО(NH2)2 | 150 | 17 |
| 13 | С6Н12О6 | 420 | 40 |
| 14 | С12Н22О11 | 180 | 20 |
| 15 | С2Н4(OH)2 | 300 | 32 |
Решение:
1. Определить молекулярную массу растворенного вещества:
Mr=_________________________________________________________
2. Определить количество растворенного вещества:
n =________________________________________________________
3. Определить количество растворителя:
N=_________________________________________________________
4. Давление насыщенного пара над водой в Па :
P0=_________________________________________________________
5. По закону Рауля рассчитать, на сколько понизится давление насыщенного пара:
Δp =_____________________________________________________
Задание 6. Раствор, содержащий 5,34 г антрацена C14H10 в 100 г уксусной кислоты, кристаллизуется при 15,25°С. Вычислите криоскопическую константу Кк уксусной кислоты, зная, что температура ее кристаллизации 16,65°С
| Дано: | Решение: |
| Найти | Ответ: |
Задание 7. Определите осмотическое давление 15%-ного раствора этиленгликоля С2Н4(OH)2 в воде при 15°С. Плотность раствора равна 1,025 г·см-3.
| Дано: | Решение: |
| Найти | Ответ: |
Вопросы для контроля
1. Отличие электролитов от неэлектролитов. Приведите примеры.
2. Что такое осмос?
3. Что такое осмотическое давление?
4. Сформулируйте закон Вант-Гоффа.
5. Сформулируйте первый закон Рауля.
6. Сформулируйте второй закон Рауля.
7. В чём заключается физический смысл криоскопической и эбулиоскопической постоянной.
Вывод:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата____________________
Лабораторная работа № 5.
Дата: 2019-03-05, просмотров: 593.