Цель работы:
1. Определить константы скорости реакции взаимодействия уксусноэтилового (уксуснобутилового) эфира со щёлочью методом объёмного титрования при заданной температуре;
2. Рассчитать энергию активации реакции.
Теоретическая часть
Реакция уксусноэтилового эфира со щёлочью протекает в водном растворе по уравнению:
CH3COOC2H5 + NaOH = CH3COONa + C2H5OH
и является реакцией второго порядка.
Порядок реакции определяется экспериментальным кинетическим уравнением реакции и равен сумме показателей степеней при концентрациях в этом уравнении.
Кинетическим называют уравнение, описывающее зависимость скорости реакции V от концентрации С реагирующих веществ.
Например, для реакции nA + mB = pC
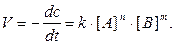 (1)
(1)
Коэффициент пропорциональности k называют константой скорости реакции, которая численно равна скорости реакции реагирующих веществ, равных единице.
Константа скорости реакции зависит от природы реагирующих веществ, природы растворителя, температуры, присутствия катализаторов, являясь, таким образом, характерной величиной для данной реакции.
Константу скорости реакции вычисляют из опытных данных с помощью кинетического уравнения.
Для реакции изучаемой в работе, кинетическое уравнение вид:
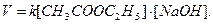 (2)
(2)
Обозначив начальные числа молей через a и b, а убыль числа молей к моменту времени t через x, после разделения переменных и интегрирования получим:
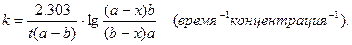 (3)
(3)
Из уравнения (3) видно, что значение константы скорости реакции второго порядка зависит от способа выражения концентрации.
Если начальные концентрации веществ равны (a=b), то кинетическое уравнение имеет вид: 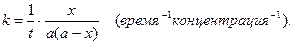 (4)
(4)
Для вычисления константы скорости реакции взаимодействия уксусноэтилового эфира со щёлочью по уравнению (3) количества реагентов определяют методом титрования одинаковых объёмов проб (по 10 мл) раствором кислоты с точно установленной концентрацией Ск, моль/л. Пробы отбирают в различные моменты времени. Для вычисления значений а, b, x используют величины V0, Vt, V∞, объёмы кислоты, идущей на нейтрализацию щёлочи в пробе до начала реакции, в момент времени t и по окончании реакции соответственно. После соответствующих преобразований получают уравнение для расчёта К:
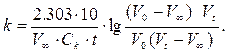 (5)
(5)
Скорость и константа скорости реакции зависят от температуры. Эта зависимость выражается уравнением Аррениуса:
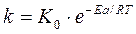 (6)
(6)
где k- константа скорости реакции;
К0 -предэкспотенциальный множитель, зависящий от природы реакции;
Еа – энергия активации реакции;
R - универсальная газовая постоянная;
Т – абсолютная температура.
Энергия активации – это минимальная энергия, которой должны обладать молекулы реагирующих частиц, чтобы соударения между ними привели к реакции. Размерность энергии активации в системе СИ – Дж/моль.
Уравнение Аррениуса содержит две постоянные для данной реакции величины К0 и Еа. Их можно определить, если экспериментально найти константы k 1 и k 2 при Т1 и Т2. Расчёт Еа можно произвести двумя методами: аналитическим и графическим.
1. Аналитический метод.
После логарифмирования уравнения Аррениуса (6) получим:
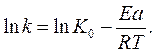 (7)
(7)
Решая систему двух уравнений:
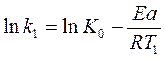
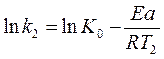 имеем
имеем
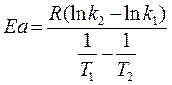 (8)
(8)
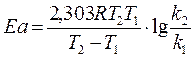 (9).
(9).
Подставляя R=8,31 дж/(моль·град), получим:
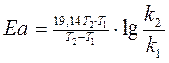 (10)
(10)
2. Графический метод.
Строят график зависимости lgk от 1/Т
 1/ T
1/ T
Рисунок. 1. График зависимости lgkот 1/Т.
Отрезок, отсекаемый на оси ординат, равен lgК0, тангенсу угла наклона прямой 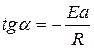
Экспериментальная часть
Оборудование и реактивы
Для выполнения работы требуется следующее оборудование и реактивы:
1) термостат или водяная баня, в которой поддерживается постоянная температура;
2) мерные колбы на 50 и 100 мл;
3) конические колбы на 100 мл;
4) пипетки на 5, 10 мл;
5)мерный цилиндр на 25 мл;
6) бюретки на 25 мл;
7) обратный холодильник;
8) 0,19 н. спиртовой раствор уксусноэтилового (уксуснобутилового) эфира;
9) 0,2 н. раствор NaOH;
10) 0,025 н. раствор HCl;
11) раствор фенолфталеина;
12) дистиллированная вода.
Методика выполнения работы
В мерную колбу на 100 мл наливают 50 мл 0,025 н. раствора щелочи NaOH. В мерную колбу на 50 мл наливают 5 мл 0,19 н. спиртового раствора уксусноэтилового (или уксуснобутилового) эфира и доводят дистиллированной водой до метки. Во избежание взаимодействия щёлочи с двуокисью углерода и испарения эфира колбы тщательно закрывают пробками. Обе колбы устанавливают в термостат и выдерживают там при температуре опыта (по заданию преподавателя) 15-20 мин. После этого содержимое второй колбочки переливают в первую и взбалтывают. Момент сливания растворов является моментом начала реакции. Сразу после смешивания реактивов отбирают пробу (10 мл раствора) в коническую колбу для титрования, в которую предварительно было налито 25 мл прокипячённой и охлаждённой до 0º – +2ºС дистиллированной воды, необходимой для торможения реакции в пробе. Мерную колбу с реакционной смесью устанавливают обратно в термостат. Отобранную пробу титруют 0,01 н. раствором HCl в присутствии индикатора фенолфталеина. Все эти действия производят аккуратно и по возможности быстро. Полученный результат соответствует V0.
Затем через 5, 10, 15, 20, 30, 45, 60 минут от начала опыта отбирают пробы и оттитровывают их кислотой, как указано выше. Количество кислоты, пошедшее на титрование (Vt), записывают в таблицу против соответствующего времени, считая от начала опыта.
Реакция омыления уксусноэтилового (уксуснобутилового) эфира заканчивается при комнатной температуре примерно за сутки. Чтобы довести её до конца за более короткий срок, оставшуюся после взятия последней пробы реакционную смесь нагревают на водяной бане (60-80ºС) с обратным холодильником в течение 30-40 минут. После этого смесь охлаждают до температуры опыта, отбирая пробу (10 мл) и титруют раствором кислоты. Количество, пошедшее на титрование, в этом случае соответствует V∞.
Результаты эксперимента
Таблица 1
| Время от начала опыта, мин | Температура Т = ºС | ||
| Vt, мл | k1, л/(моль·мин) | Среднее значение k 1, л/(моль·мин) | |
| 0 | |||
| 5 | |||
| 10 | |||
| 15 | |||
| 20 | |||
| 30 | |||
| |||
По полученным экспериментальным данным необходимо:
1) построить кинетическую кривую Vt = f ( t ) (зависимость концентрации щелочи от времени протекания реакции)
2) вычислить значение константы скорости реакции для каждого момента времени по уравнению (5) и занести в таблицу 1.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
3) рассчитать среднее значение константы скорости при данной температуре и занести в таблицу 1.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
4) Используя средние значения констант скорости реакции взаимодействия уксусноэтилового (уксуснобутилового) эфира со щёлочью при двух температурах вычислить величину энергии активации реакции аналитическим методом.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Вопросы для контроля
1.Что называется химической кинетикой?
2. Сформулируйте основной закон химической кинетики.
3. Каков физический смысл константы скорости реакции?
4. От каких факторов зависит и не зависит константа скорости реакции?
5. Изменится ли константа скорости реакции в лабораторной работе, если вместо NaOH взять КОН?
6. Изменится ли константа скорости реакции если изменить эфир?
7. Какую роль выполняет индикатор в работе?
8. Что такое энергия активации реакции? Какая нужна информация для расчёта энергии активации в работе?
9.Что такое энергия активации?
10. Расчёт энергии активации реакции аналитическим и графическим методом.
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата___________________
Лабораторная работа № 3
Дата: 2019-03-05, просмотров: 1435.