Цель работы
Изучение теоретических основ и расчет потенциалов электродов и электродвижущих сил гальванических элементов.
Теоретическая часть
Если металл погружен в раствор собственной соли, то такая система может считаться электродом или полуэлементом. При этом наблюдается 2 процесса:
1) ионизация металла пластинки под действием полярных молекул воды.
Образующиеся при этом электроны концентрируются на пластинке и заряжаяют ее отрицательно. Образующиеся катионы металла Меn+ переходят с пластинки в раствор и концентрируются около пластинки.
2) сольватация образующихся ионов (т.е. взаимодействие молекул растворителя (воды) с ионами металла)
При погружении металла в раствор собственной соли вначале преобладает процесс ионизации металла, но со временем скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается до тех пор пока между этими процессами не установится динамическое равновесие.
В этом случае на границе металл-раствор (твердая фаза – жидкость) устанавливается двойной электрический слой (ДЭС), состоящий из положительных ионов Меn+ и электронов.
Для обозначения системы металл/раствор используют условную запись Ме|Меn+, где вертикальной чертой обозначена граница раздела твердая фаза-раствор.
Между положительными ионами металла и электронами возникает скачок потенциала, который называется электродным потенциалом. Потенциал, возникающий при равновесии электродных реакции, называется равновесным электродным потенциалом ( 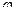 ).
).
Электродный потенциал, который возникает на границе металл-раствор, зависит от
1)температуры
2) природы металла,
3) активности ионов данного металла
Абсолютное значение электродного потенциала измерить или рассчитать невозможно. Но определяют значение электродного потенциала относительно электрода, который выбран в качестве стандарта. Согласно международному соглашению таким стандартом служит стандартный (нормальный) водородный электрод, потенциал которого условно принят за нуль:  = 0,0 В.
= 0,0 В.
Стандартные потенциалы являются количественной мерой окислительно-восстановительной способности системы. Чем выше значение φ0, тем большей окислительной способностью обладает окисленная форма данной пары. Восстановительные свойства сильнее выражены у формы в паре с меньшим значением φ0.
Значения электродных потенциалов рассчитывают по уравнению Нернста:
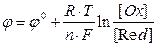 (1),
(1),
где Т – абсолютная температура в Кельвинах; 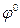 – стандартный электродный потенциал, измеренный при стандартных условиях; R = 8,31 Дж/моль·К, универсальная газовая постоянная; F – число Фарадея, равное 96500 Кл/моль; [Ox] и [Red] –концентрации веществ, участвующих в химическом процессе в окисленной (Ox) и восстановленной (Red) формах.
– стандартный электродный потенциал, измеренный при стандартных условиях; R = 8,31 Дж/моль·К, универсальная газовая постоянная; F – число Фарадея, равное 96500 Кл/моль; [Ox] и [Red] –концентрации веществ, участвующих в химическом процессе в окисленной (Ox) и восстановленной (Red) формах.
Или для металлического электрода
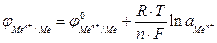 (2),
(2),
где n – число электронов, отдаваемых атомом металла при образовании катиона; 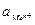 – активность ионов металла в растворе электролита.
– активность ионов металла в растворе электролита.
Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К), при подстановке значений постоянных величин уравнение принимает вид:
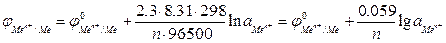 (3)
(3)
Гальванический элемент – это устройство, в котором химическая энергия окислительно-восстановительной реакции (ОВР) превращается в электрическую. Гальванический элемент состоит из двух электродов.
Для осуществления контакта между растворами электродов используется электролитический мостик, заполненный насыщенным раствором хлорида калия KCl (солевой мостик) или специальные мембраны. Электролитический мостик обеспечивает электрическую проводимость между растворами, но препятствуют их взаимной диффузии. Внешняя цепь гальванического элемента – это выводы электродов. По внешней цепи электроны переходят от одного металла к другому.
Электродвижущая сила (ЭДС), возникающая между двумя электродами в гальваническом элементе, равна разности двух электродных потенциалов. Электродвижущая сила (ЭДС) гальванического элемента – положительная величина и рассчитывается по формуле:
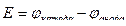 (4)
(4)
Электродвижущая сила гальванического элемента измеренные опытным путем, могут быть использованы для определения термодинамических функций окислительно-восстановительных реакций.
Изменение энергии Гиббса реакции при стандартных условиях простым образом связано с ЭДС (Е): 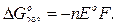
Принимая, что энергия Гиббса связано с константой равновесия реакции соотношением 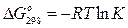 можно записать
можно записать 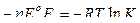 или, подставляя значения R и F и переходя к десятичным логарифмам, получим при 298 К
или, подставляя значения R и F и переходя к десятичным логарифмам, получим при 298 К 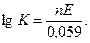
Концентрационный элемент – это гальванический элемент, состоящий из одинаковых металлических или газовых электродов, опущенных в электролиты различной активности (концентрации).
Например, гальванический элемент, составленного из цинковых электродов, опущенных в растворы ZnSO4 с концентрациями а1 и а2.
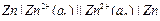 ,
,
где а1<а2.
При работе концентрационного гальванического элемента равные количества цинка переходят в раствор на аноде и выделяются из раствора на катоде. Концентрация ионов в анодном пространстве возрастает, а в катодном будет уменьшается. Данный процесс будет осуществляться до выравнивания активностей ионов в катодном и анодном пространстве. ЭДС концентрационного элемента может быть найдена по формуле:
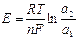 (5)
(5)
Пример решения задач
Пример 1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор сульфата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислить электродвижущую силу элемента, написать уравнения электродных процессов, составить схему гальванического элемента. 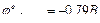 ;
; 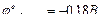 .
.
Решение:
Используя уравнение Нернста определяем электродные потенциалы металлов:
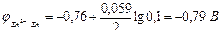 ;
;
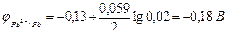 .
.
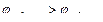 Цинк имеет меньший электродный потенциал, поэтому является анодом, а свинец – катодом.
Цинк имеет меньший электродный потенциал, поэтому является анодом, а свинец – катодом.
Рассчитываем ЭДС гальванического элемента:
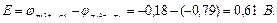
На катоде будет происходить восстановление свинца:
Pb2+ + 2e- = Pb
Процесс окисления будет протекать на цинковом электроде:
Zn - 2 e-= Zn2+
Схема данного гальванического элемента имеет следующий вид:
(-) Znú Zn+2úú Pb+2ú Pb (+).
Пример 2. Определить константу равновесия окислительно –восстановительной реакции: Fe + CuSO4↔ FeSO4+ Cu. Температуру принять стандартной.
Решение:
1.Стандартные электродные потенциалы для металлов равны:
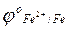 = -0,44 В
= -0,44 В
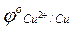 = 0,377 В
= 0,377 В
2. Железо имеет меньший электродный потенциал, поэтому окисляться на аноде, а медь – восстанавливаться на катоде.
Поэтому процесс на аноде будет выглядеть следующим образом:
Fe 2+ + 2 e – ↔ Fe
Процесс на катоде:
Cu 2+ + 2 e – ↔ Cu;
3. Составим схему гальванического элемента:
(-) Feú FeSOúú CuSO4ú Cu (+)
Определим стандартную ЭДС:
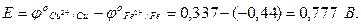
Константа равновесия при температуре 298 рассчитывается по формуле: 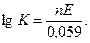
Подставив количество электронов, участвующих в электрохимическом процессе и рассчитанную ЭДС получим:
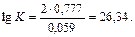
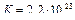
Значение константы равновесия 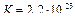 показывает, что процесс вытеснения железом меди из ее раствора протекает при стандартной температуре практически полностью.
показывает, что процесс вытеснения железом меди из ее раствора протекает при стандартной температуре практически полностью.
Практическая часть
Задача 1: Вычислить электродный потенциал металлического электрода при заданной активности катионов металла, моль/л
| Вариант | Металл | Активность ионов металла, моль/л |
| 1 | Железо | 0,001 |
| 2 | Марганец | 0,001 |
| 3 | Цинк | 0,01 |
| 4 | Никель | 0,0001 |
| 5 | Хром | 0,001 |
| 6 | Медь | 0,001 |
| 7 | Серебро | 0,1 |
| 8 | Свинец | 0,01 |
| 9 | Олово | 0,0001 |
| 10 | Цинк | 0,0001 |
| 11 | Железо | 0,001 |
| 12 | Цинк | 0,01 |
| 13 | Хром | 0,001 |
| 14 | Олово | 0,01 |
| 15 | Медь | 0,001 |
Решение:
1. Используя справочную литературу, выписать значение стандартного электродного потенциала металла
_________________________________________________________
2. Рассчитать электродный потенциал по уравнению Нернста при стандартных условиях
_________________________________________________________
Задача 2: Гальванический элемент состоит из двух стандартных металлических электродов. Укажите металл анода и катода; запишите уравнения электродных процессов и составьте схему гальванического элемента. Составьте уравнение токообразующей реакции в ионной и молекулярной форме.
| Вариант | Электроды гальванического элемента | |
| 1 | Cr/CrCl3 | Zn/ZnCl2 |
| 2 | Ni/NiSO4 | Cu/CuSO4 |
| 3 | Cu/CuSO4 | Ag/AgNO3 |
| 4 | Cr/CrCl3 | Cu/Cu(NO3)2 |
| 5 | Al/Al2(SO4)3 | Mg/MgCl2 |
| 6 | Cu/CuSO4 | Sn/SnCl2 |
| 7 | Mg/MgSO4 | Sn/SnSO4 |
| 8 | Pb/Pb(NO3)2 | Fe/FeSO4 |
| 9 | Sn/SnCl2 | Ni/NiSO4 |
| 10 | Ni/NiSO4 | Sn/SnCl2 |
| 11 | Au/Au(NO3)3 | Cu/CuCl2 |
| 12 | Zn/ZnSO4 | Ag/AgNO3 |
| 13 | (Pt)H2/H2SO4 | Zn/ZnSO4 |
| 14 | Mg/MgSO4 | Zn/Zn(NO3)2 |
| 15 | Ni/NiSO4 | Sn/SnCl2 |
Решение:
1. Используя справочную литературу, выписать значения стандартных электродных потенциалов металлов
_________________________________________________________
2. Определить электрод анода и катода
_________________________________________________________
3. Записать уравнения реакций, протекающих на катоде и аноде и суммарной реакций, идущих в элементе
_________________________________________________________
_________________________________________________________
4. Записать схему гальванического элемента
_________________________________________________________
5. Записать уравнение токообразующей реакции в молекулярной форме.
_________________________________________________________
Задача 3. Для двух указанных гальванических элементов определите величину ЭДС, сравните ее значения. Запишите уравнения электродных процессов и составьте схему гальванического элемента. Составьте уравнение реакции генерирующей ток. Концентрация электролитов 0,01 моль/л.
| Вариант | Гальванические элементы | |
| 1 | Ni/NiSO4 и Al/AlCl3 | Co/CoCl2 и Al/AlCl3 |
| 2 | Cr/CrCl3 и Ni/NiSO4 | Cr/CrCl3 и Co/CoCl2 |
| 3 | Zn/ZnSO4 и Ag/AgNO3 | Fe/FeSO4 и Ag/AgNO3 |
| 4 | Fe/FeSO4 и Zn/ZnSO4 | Fe/FeSO4 и Ni/NiSO4 |
| 5 | Cu/Cu(NO3)2 и Pb/Pb(NO3)2 | Cr/CrCl3 и Cu/Cu(NO3)2 |
| 6 | Ni/NiSO4 и Sn/SnCl2 | Ni/NiSO4 и Cu/Cu(NO3)2 |
| 7 | Mg/MgSO4 и Sn/SnSO4 | Al/Al2(SO4)3 и Mg/MgCl2 |
| 8 | Cr/CrCl3 и Fe/FeSO4 | Al/AlCl3 и Mg/MgSO4 |
| 9 | Hg/HgCl2 и Cu/CuSO4 | Mn/MnSO4 и Hg/Hg(NO3)2 |
| 10 | Cu/CuSO4 и Sn/SnCl2 | Mg/MgSO4 и Sn/SnSO4 |
| 11 | Ag/AgNO3 и Cu/CuSO4 | Sn/SnCl2 и Ni/NiSO4 |
| 12 | Ni/NiSO4 и Sn/SnCl2 | Au/Au(NO3)3 и Cu/Cu(NO3)2 |
| 13 | Zn/ZnSO4 и Ag/AgNO3 | Ni/NiSO4 и Zn/ZnSO4 |
| 14 | Ni/NiSO4 и Sn/SnSO4 | (Pt)H2/H2SO4 и Zn/ZnSO4 |
| 15 | Pb/Pb(NO3)2 и Fe/FeСl2 | Cr/CrCl3 и Cu/Cu(NO3)2 |
Решение:
1. Используя справочную литературу, выписать значения стандартных электродных потенциалов металлов
_________________________________________________________
2. Определить электрод анода и катода
_________________________________________________________
_________________________________________________________
3. Записать схемы гальванических элементов
_________________________________________________________
_________________________________________________________
4. Записать уравнения токообразующих реакций
_________________________________________________________
_________________________________________________________
5. По формуле Нернста рассчитать значения электродных потенциалов:
_________________________________________________________
_________________________________________________________
6. Рассчитать электродвижущую силу (ЭДС) гальванических элементов, сравнить их значения между собой
_________________________________________________________
_________________________________________________________
Задача 4: Вычислите значение э.д.с. гальванического элемента:
Pb | 0,01 М PbSO4 || 0,001 М CuSO4 | Cu.
Напишите процессы, протекающие на аноде и катоде, реакцию, генерирующую ток, и вычислите энергию химической реакции, превращающуюся в электрическую.
| Дано: | Решение: |
| Найти | Ответ: |
Задача 5: Рассчитать константу равновесия при стандартных условиях следующей окислительно-восстановительной реакции:
Zn + 2 HCl ↔ ZnCl2 + H2 .
| Дано: | Решение: |
| Найти | Ответ: |
Задача 6: Рассчитать ЭДС концентрационного гальванического элемента, составленного из стандартного никелевого электрода и никелевого электрода при концентрации ионов Ni2+, равной 1∙10-4 моль/л.
| Дано: | Решение: |
| Найти | Ответ: |
Вопросы для контроля
1.Возникновение разности потенциалов на границе «металл-раствор».
2.Строение двойного электрического слоя (ДЭС).
3.Уравнение Нернста.
4.Физический смысл стандартного электродного потенциала.
5.Ряд стандартных электродных потенциалов.
4.Устройство гальванического элемента на примере элемента Якоби-Даниэля.
5. Что является окислителем и восстановителем в гальваническом элементе, составленном цинком и серебром, которые погружены в нормальные растворы их солей?
6.Расчёт ЭДС гальванических веществ.
7.Концентрационный гальванический элемент.
8.Окислительно-восстановительные электроды и цепи.
Вывод:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата____________________
Лабораторная работа №7
Дата: 2019-03-05, просмотров: 573.