Цель работы:
Приобрести навыки решения расчетных задач по химической кинетике
Теоретическая часть.
Химическая кинетика – раздел физической химии, который изучает скорость и механизмы протекания химической реакции, а также зависимость скорости протекания реакции от различных факторов.
Химические реакции протекают с различными скоростями. На скорость химических процессов влияет изменение концентрации реагирующих веществ в единицу времени. Для определения средней скорости химической реакции 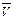 в данном промежутки времени используют формулу:
в данном промежутки времени используют формулу:
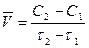 , (1)
, (1)
где C1 – концентрация одного из реагирующих веществ в момент времени τ1; C2 –концентрация этого же вещества к моменту времени τ2.
Скорость реакции в данный момент времени - истинная скорость Vист, выражается первой производной по времени
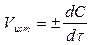 (2)
(2)
Скорость реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, взятых в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
Для реакции вида n1A + n2B + n3C → n4D + n5F + ... закон действующих масс можно математически записать так:
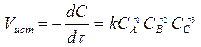 (3)
(3)
где CA,CB,CC – молярные концентрации веществ А, В, С (моль/дм3) в данный момент времени; k – коэффициент пропорциональности, называемый константой скорости реакции. Константа скорости представляет собой скорость реакции, когда концентрации всех исходных веществ равны 1 моль/ дм3. По характеру протекания различают реакции: одномолекулярные (мономолекулярные), двухмолекулярные (бимолекулярные) и трехмолекулярные (тримолекулярные). В одномолекулярных реакциях в отдельном акте участвует одна молекула вещества. Схематично эти реакции можно записать так:
A → B + C+…
Скорость одномолекулярной реакции пропорциональна концентрации реагирующего вещества
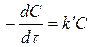 (4)
(4)
где 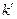 константа скорости одномолекулярной реакции.
константа скорости одномолекулярной реакции.
В бимолекулярных реакциях в отдельном акте участвуют уже две одинаковые молекулы или две различные молекулы веществ:
2A → B + C+…
A+ B → C+D+…
Скорость бимолекулярной реакции прямо пропорциональна произведению концентраций двух реагирующих веществ (С1 и С2)
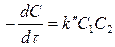 (5)
(5)
где 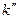 константа скорости двухмолекулярной реакции.
константа скорости двухмолекулярной реакции.
Для частного случая, когда C1 = C2 = C
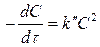 (6)
(6)
В тримолекулярных реакциях в отдельном акте которых участвуют три одинаковые или три различные молекулы, наблюдаются сравнительно редко
A+ B+ C → D+E+…
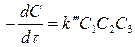 (7)
(7)
Если C1 = C2 = C3 = C , то
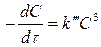 (8)
(8)
Существуют реакции в отдельном акте которых участвуют более трех молекул. Такие реакции протекают по стадиям, а общая скорость определяется скоростью наиболее медленной из стадий. Реакции бывают первого, второго и третьего порядка. Порядок реакции определяется суммой величин показателей степени n1 + n2 + n3+ ... при значениях концентраций веществ A,B,C в уравнении химической реакции:
n1A + n2B + n3C →n4D + n5F + ...
Порядок не всегда совпадает с молекулярностью. Его определяют опытным путем. Для сложных ступенчатых реакций невозможно судить о механизме протекания процесса по стехиометрическому уравнению, так как оно описывает процесс в целом.
Для вычисления констант скоростей реакций первого, второго и третьего порядка дифференциальные уравнения интегрируют.
Для реакции первого порядка
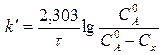 (9)
(9)
для реакции второго порядка
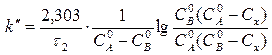 (10)
(10)
где 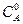 – начальная концентрация первого вещества, моль/ дм3;
– начальная концентрация первого вещества, моль/ дм3; 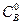 – начальная концентрация второго вещества, моль/ дм3; Сх – количество молей вещества, вступивших в реакцию к моменту времени τ от начала опыта, моль/ дм3.
– начальная концентрация второго вещества, моль/ дм3; Сх – количество молей вещества, вступивших в реакцию к моменту времени τ от начала опыта, моль/ дм3.
Если начальные концентрации веществ равны, т.е. 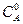 =
= 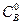 то выражение для константы скорости двухмолекулярной реакции примет вид:
то выражение для константы скорости двухмолекулярной реакции примет вид:
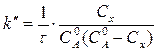 (11)
(11)
На скорость химических реакций оказывает влияние изменение температуры. При повышении температуры на 10 0С у большинства гомогенных реакций скорость увеличивается в 2 – 4 раза (приближенное правило Вант-Гоффа).
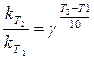
Где 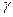 - температурный коэффициент скорости реакции. Величина
- температурный коэффициент скорости реакции. Величина 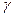 у разных реакций колеблется в пределах от 2 до 4.
у разных реакций колеблется в пределах от 2 до 4.
Более точная зависимость константы скорости от температуры выражается формулой:
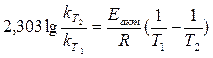 (12)
(12)
kТ1 и kТ2 - константы скорости при температурах Т1 и Т2, R - газовая постоянная (Дж/(моль∙К)); Еакт - энергия активации данной реакции (Дж/моль).
Данное уравнение используют для вычисления константы скорости реакции при заданной температуре, если известна величина константы скорости для другой температуры и величина энергии активации. Интервал температур T1 и T2 должен быть близким, так как в широком интервале Еакт заметно изменяется. По двум значениям констант скоростей, измеренных при двух близких по значениям температурах, можно вычислить энергию активации данной реакции.
Энергия активации – это минимальный избыток энергии (по сравнению со средней величиной), которым должны обладать частицы для того, чтобы произошло химическое взаимодействие. Чем больше величина Еакт, тем меньшее количество частиц ее достигают, и тем меньше скорость реакции. Применение катализаторов способствует увеличению скорости реакции, так как они снижают величину энергии активации.
Пример решения задач
Пример 1. Константа скорости реакции 2А + В → С равна 0,75. Начальная концентрация вещества А равна 3,2 моль/ л, а вещества В 1,6
моль/ л. Определить начальную скорость реакции и скорость реакции, когда концентрация вещества А уменьшилась на 16 %.
Решение:
Определим начальную скорость реакции по закону действующих масс: 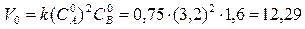
Рассчитаем концентрацию вещества А с течением времени:
СА=3,2·0,84=2,688 моль/л, т.е. уменьшилась на 0,512 моль/л
Тогда концентрация вещества В (в соответствии с уравнением химической реакции) должна уменьшится на 0,256 моль/л.
СВ=1,6-0,256=1,344 моль/л,
Следовательно, скорость реакции станет равной
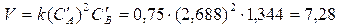
Пример 2. Период полураспада перекиси водорода в водном растворе равен 15,86 мин. Определить какое время потребуется для разложения 99 % перекиси водорода. Реакцию разложения считать реакцией первого порядка
Решение:
Используя величину периода полураспада определим константу скорости:
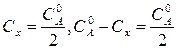
где 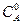 – начальная концентрация вещества.
– начальная концентрация вещества.
Используем уравнение константы скорости реакции первого порядка для частного случая, когда время τ = τ1 /2
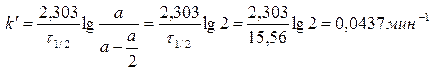
Зная константу, определяем время, за которое разложится 99 % перекиси водорода,
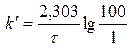
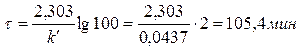
Пример 3. Реакция омыления уксусноэтилового эфира раствором щелочи относится к реакции второго порядка. Определить время (мин), необходимое для омыления 90 % эфира, если смешать при 10 0С 1 дм3 0,05 н. раствора эфира с 1 дм3 0,1 н. раствора NaOH. Константа скорости при данной температуре равна 2,38.
Решение:
Реакция омыления уксусноэтилового эфира щелочью является реакцией второго порядка.
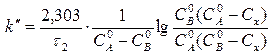
Общий объем смеси 2 дм3, поэтому концентрация вещества 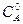 и
и 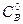 вследствие разбавления уменьшится в 2 раза
вследствие разбавления уменьшится в 2 раза
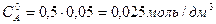
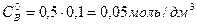
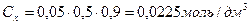
При определении Сх учитывается разбавление в 2 раза и омыление на 90 %.
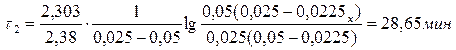
Пример 4. Вычислить, на сколько нужно повысить температуру, чтобы скорость реакции возросла в 80 раз, приняв температурный коэффициент скорости равным 3.
Решение:
Используем закон Вант Гоффа:
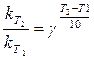
Логарифмируем данное уравнение
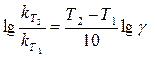
Подставляем исходные данные ( температурный коэффициент и соотношение констант скоростей)
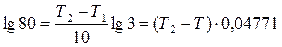
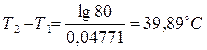
Таким образом, для того чтобы скорость реакции возросла в 80 раз, нужно повысить температуру примерно на 40 0С.
Практическая часть
Задача 1. Определить скорость химической реакции взаимодействия веществ А и В в начальный момент и после некоторого промежутка времени. Для каждого варианта приведены: уравнение реакции, начальные концентрации веществ А и В, константа скорости реакции, процент уменьшения концентрации вещества А после некоторого промежутка времени.
| Вариант | Уравнение химической реакции | Начальная концентрация А, моль/дм3 | Начальная концентрация В, моль/дм3 | Константа скорости реакции | Уменьшение концентрации вещества А на процент, % |
| 1 | 2А + В = С | 5,1 | 1,8 | 0,85 | 16 |
| 2 | 3,7 | 2,7 | 0,78 | 20 | |
| 3 | 4,3 | 2,3 | 0,67 | 10 | |
| 4 | 3,8 | 3,1 | 0,82 | 11 | |
| 5 | 4,9 | 4,0 | 0,71 | 18 | |
| 6 | А + В = С | 3,9 | 4,5 | 0,59 | 25 |
| 7 | 4,2 | 2,8 | 0,81 | 22 | |
| 8 | 4,7 | 1,9 | 0,77 | 18 | |
| 9 | 5,6 | 4,8 | 0,66 | 19 | |
| 10 | 6,6 | 6,0 | 0,79 | 17 | |
| 11 | А + 2В = С | 2,9 | 1,7 | 0,83 | 16 |
| 12 | 3,3 | 2,8 | 0,76 | 19 | |
| 13 | 3,8 | 6,1 | 0,61 | 24 | |
| 14 | 5,7 | 7,0 | 0,58 | 23 | |
| 15 | 6,2 | 2,7 | 0,8 | 26 |
Решение:
1. Записываем уравнение химической реакции своего варианта.
_____________________________________________________
2. Вычисляем скорость реакции в начальный момент времени
V0 = _______________________________________________
3. Вычисляем концентрацию вещества А по истечению некоторого
времени.
C A = ___________________________________________________ моль/дм3.
4. Определяем концентрацию вещества В по истечению некоторого
времени (в соответствии с уравнением химической реакции).
C B = _______________________________________________ моль/дм3.
5. Вычисляем скорость реакции по истечении некоторого времени.
V = ___________________________________________________
Задача 2. Определить время, которое потребуется для разложения определенного количества вещества, выраженного в процентах. Реакция разложения протекает как реакция первого порядка. Для каждого варианта приведены период полураспада и процент разложения вещества.
| Вариант | Период полураспада, τ1 /2 , мин -1 | Процент разложения вещества, % |
| 1 | 15,86 | 99 |
| 2 | 10,44 | 80 |
| 3 | 20,03 | 87 |
| 4 | 13,20 | 92 |
| 5 | 18,29 | 96 |
| 6 | 19,50 | 88 |
| 7 | 16,77 | 88 |
| 8 | 17,24 | 91 |
| 9 | 18,11 | 85 |
| 10 | 20,99 | 78 |
| 11 | 15,48 | 82 |
| 12 | 17,87 | 97 |
| 13 | 18,29 | 96 |
| 14 | 19,47 | 98 |
| 15 | 18,01 | 78 |
Решение:
1. Вычисляем константу скорости разложения вещества (используем уравнение константы скорости реакции первого порядка)
k´= ___________________________________________________
2. Определяем время, за которое разложится указанный процент
вещества.
τ = ____________________________________________________________
Задача 3. Вычислить время (мин.), необходимое для омыления определенного процента эфира. Для каждого варианта приведены объемы и молярные концентрации растворов эфира и гидроксида калия, а также константа скорости и процент омыления эфира
| Вариант | Константа скорости реакции, k´´ | Процент омыления эфира, % | Объем эфира, дм3 | Молярная концентрация эфира, Сэф, моль/дм3 | Объем щелочи, дм3 | Нормальная концентрация щелочи, Сщ, моль/дм3 |
| 1 | 1,80 | 85 | 1 | 0,025 | 1 | 0,05 |
| 2 | 1,98 | 87 | 2 | 0,03 | 1 | 0,06 |
| 3 | 2,10 | 95 | 1 | 0,06 | 2 | 0,06 |
| 4 | 2,40 | 90 | 2 | 0,08 | 2 | 0,10 |
| 5 | 2,40 | 92 | 1 | 0,07 | 1 | 0,14 |
| 6 | 2,26 | 88 | 1 | 0,04 | 2 | 0,04 |
| 7 | 2,57 | 93 | 2 | 0,07 | 1 | 0,08 |
| 8 | 2,88 | 97 | 2 | 0,05 | 2 | 0,05 |
| 9 | 1,84 | 94 | 1 | 0,03 | 2 | 0,08 |
| 10 | 1,99 | 84 | 2 | 0,09 | 1 | 0,15 |
| 11 | 2,50 | 78 | 1 | 0,13 | 1 | 0,26 |
| 12 | 2,49 | 95 | 1 | 0,08 | 2 | 0,10 |
| 13 | 1,73 | 81 | 1 | 0,17 | 2 | 0,19 |
| 14 | 1,88 | 79 | 2 | 0,09 | 1 | 0,19 |
| 15 | 1,92 | 89 | 1 | 0,11 | 1 | 0,17 |
Решение:
1. Вычисляем концентрацию эфира, после разбавления щелочью.
С°А = ____________________________________________ моль/дм3.
2. Вычисляем концентрацию щелочи, после разбавления эфиром.
Ѱ = _____________________________________________________ моль/дм3.
3. Вычисляем концентрацию эфира, подвергнутого омылению.
Сх = ______________________________________________моль/дм3.
4. Рассчитываем время, необходимое для омыления эфира.
τ = ____________________________________________мин.
Задача 4. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в определенное число раз. Для каждого варианта приведены температурный коэффициент реакции и отношение констант скоростей реакции при двух температурах
| Вариант | Температурный
коэффициент
реакции 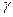
| 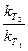
|
| 1 | 3,1 | 90 |
| 2 | 2,8 | 88 |
| 3 | 2,4 | 57 |
| 4 | 2,7 | 40 |
| 5 | 2,0 | 75 |
| 6 | 3,0 | 80 |
| 7 | 2,1 | 79 |
| 8 | 1,9 | 65 |
| 9 | 3,8 | 55 |
| 10 | 3,2 | 86 |
| 11 | 3,6 | 73 |
| 12 | 3,5 | 70 |
| 13 | 4,0 | 68 |
| 14 | 2,5 | 92 |
| 15 | 2,1 | 85 |
Решение:
1. Вычисляем отношение lg 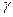 /10 .
/10 .
lg 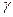 /10 = _____________________________________________
/10 = _____________________________________________
2. Вычисляем разность температур.
Т2 -Т1 =__________________________________________________
Задача 5. Определить значение величины энергии активации химической реакции. Для соответствующих вариантов приведены константы скорости реакции при двух температурах k T1 и k T2
| Вариант | Т1, 0С | k1, с-1 | Т2, 0С | k2 с-1 |
| 1 | 378 | 0,0071 | 520 | 0,1059 |
| 2 | 243 | 0,0052 | 405 | 0,0998 |
| 3 | 410 | 0,0027 | 627 | 0,0199 |
| 4 | 540 | 0,0014 | 728 | 0,1008 |
| 5 | 324 | 0,0098 | 485 | 0,1027 |
| 6 | 290 | 0,0076 | 444 | 0,0111 |
| 7 | 199 | 0,0066 | 389 | 0,2001 |
| 8 | 445 | 0,0018 | 708 | 0,0802 |
| 9 | 351 | 0,0047 | 603 | 0,2118 |
| 10 | 298 | 0,0038 | 527 | 0,1800 |
| 11 | 481 | 0,0068 | 802 | 0,2100 |
| 12 | 398 | 0,0015 | 679 | 0,1003 |
| 13 | 642 | 0,0085 | 1030 | 0,2300 |
| 14 | 428 | 0,0070 | 895 | 0,3005 |
| 15 | 220 | 0,0052 | 645 | 0,1378 |
Решение:
1. Температуры реакции выражаем в Кельвинах.
Т1 = _______К;
Т2 = _______ К.
2. Вычисляем энергию активации реакции.
Еакт =________________________________________________ Дж/моль
Вопросы для контроля
1. Скорость химической реакции. Мгновенная скорость, средняя скорость.
2. Факторы, влияющие на скорость реакции.
3. Закон действующих масс. Константа скорости реакции.
4. Вывод уравнения константы скорости реакции первого порядка. Период полураспада.
5. Вывод уравнения константы скорости реакции второго порядка. Период полураспада
6.Влияние температуры на скорость реакции. Правило Вант-Гоффа, уравнение Аррениуса.
7. Что такое порядок и молекулярность реакции? Что означает совпадение порядка и молекулярности реакции?
8.Катализ, катализаторы, ингибиторы
Вывод:_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата__________________
Лабораторная работа № 4
Дата: 2019-03-05, просмотров: 1446.