Цель работы
Измерение электропроводности электролитов с использованием реохордного моста Р-38.
Теоретическая часть
Проводники электрического тока классифицируются на проводники первого и второго рода. К проводникам первого рода относятся металлы и их сплавы, графит, некоторые тугоплавкие оксиды и другие материалы. К проводникам второго рода принадлежат растворы и расплавы электролитов, проводимость которых обусловлено движением ионов.
Прохождение электрического тока по проводникам первого рода обусловлено передвижением электронов, в проводниках второго рода– электрический ток является следствием движения ионов в электрическом поле, что приводит к переносу вещества к электродам.
В связи с этим различают электронную (металлическую) и ионную (электролитическую) проводимость.
Ионы в растворе в отсутствие внешнего электрического поля движутся беспорядочно, так как все направления перемещения равноценны. При наложении внешнего электрического поля хаотичность этого движения в основном сохраняется, но одно из направлений становится преобладающим. А его преимущество тем больше, чем больше градиент потенциала, т.е. чем больше падение напряжения на 1 см.
Скоростью движения иона называется величина преимущественного перемещения иона в направлении одного из электродов, выраженная в см/сек.
Абсолютной скоростью движения ионов называют скорость ионов, выраженную в см·сек-1, при напряжённости поля в 1 В/см-1.
Так как скорости принимаются пропорциональными градиенту потенциала, то размерность абсолютной скорости равна см2·В-1·сек-1. Скорости эти в обычных условиях очень невелики и составляют величины порядка 10-3-10-4 см2·В-1·сек-1.
Количество электричества, протекающее в единицу времени через раствор электролита при электродвижущей силе, равной единице, является мерой электропроводности раствора. Различают удельную и эквивалентную электропроводности.
Удельной электропроводностью называется электропроводность одного кубического см данного электролита. Она обычно обозначается греческой буквой æ (каппа) и выражается в Ом-1·см-1.
Практически удельная электропроводность определяется из уравнения 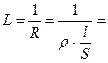 æ
æ 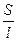 (1)
(1)
где æ – проводимость;
R – сопротивление раствора электролита;
Ρ – удельное сопротивление электролита;
l – длина проводника второго рода;
S – поперечное сечение проводника второго рода.
Удельная электропроводность раствора электролита определяется количеством ионов между электродами в объёме, равном 1 см3 и скоростью этих ионов
æ = СК·F·VK+ СA·F·VA=Ci(lK + lA), (2)
гдеCi – ионная концентрация раствора.
Концентрацию раствора (С) обычно выражают не на 1 см3, а на 1 литр, тогда
1000æ = Ci(lK + lA) (3)
Это уравнение является основным уравнением электропроводности.
Ионная концентрация (Ci) в слабых электролитах связана с аналитической концентрацией уравнением
Ci = С·α, (4)
где α – степень электролитической диссоциации слабого электролита.
Для слабых электролитов основное уравнение электропроводности будет иметь вид
1000æ = C·α(lK + lA) (5)
В сильных электролитах, где молекулы полностью диссоциированы на ионы, ионная концентрация связана с аналитической концентрацией уравнением
Ci = С·fЭ (6)
fЭ – коэффициент электропроводности, отражающий меру электростатического взаимодействия ионов в растворе. По своему физическому смыслу fЭ соответствует fа – коэффициенту активности.
Для сильных электролитов основное уравнение электропроводности имеет вид
1000 æ= С·fЭ (lK + lA) (7)
Эквивалентной электропроводностью λ называется электропроводность столба раствора, содержащего 1 г-экв электролита, заключённого между электродами, находящимися друг от друга на расстоянии в 1 см.
Соотношение между эквивалентной и удельной электропроводностью даётся уравнением
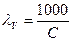 ·æ (8)
·æ (8)
Размерность λ см2·Ом-1·г-экв-1.
Эквивалентная электропроводность растворов с разбавлением увеличивается. При достаточно большом разбавлении наступает полная диссоциация электролита (α=1), при этом электролитическим взаимодействием ионов можно пренебречь (fЭ=1). В этот момент эквивалентная электропроводность достигает максимума. Дальнейшее разбавление раствора не изменяет указанную электропроводность, т.к. теперь число ионов в жидкости остаётся неизменным.
Разведение, при котором достигается максимальное значение эквивалентной электропроводности электролита, называется бесконечным. Соответствующая ему электропроводность называется эквивалентной электропроводностью при бесконечном разведении и обозначается λ∞.
На основании изложенного выше λ∞= lK + lA .
В этом состоит открытый Кольраушем закон независимого перемещения ионов. Закон Кольрауша формулируется следующим образом: эквивалентная электропроводность раствора электролита при бесконечном разбавлении равна сумме электролитических подвижностей катиона и аниона данного электролита.
Используя основное уравнение электропроводности и закон Кольрауша, можно показать, что электролитическая диссоциация слабых электролитов равна 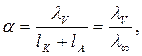 (9)
(9)
а коэффициент электропроводности сильных электролитов
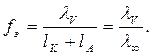 (10)
(10)
Таким образом, α и fЭ можно рассчитать экспериментально, измерив удельную электропроводность растворов слабых и сильных электролитов.
Степень диссоциации меняется с концентрацией и поэтому неудобна для количественной оценки силы электролита, т.е. для оценки способности данного электролита к диссоциации. Мерой силы электролита является константа диссоциации, величина которой для данного электролита постоянна при любых его концентрациях. Константа диссоциации определяется природой электролита и меняется лишь с изменением температуры. Эта величина представляет собой отношение произведения концентраций ионов к равновесной концентрации недиссоциированных молекул. Например, для гидроокиси аммония
NH4OH↔NH4+ + OH-;
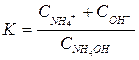 (11)
(11)
Взаимосвязь константы электролитической диссоциации со степенью электролитической диссоциации даётся законом разбавления Оствальда
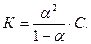 (12)
(12)
Экспериментальная часть
Оборудование и реактивы
Для выполнения работы требуется следующее оборудование и реактивы:
1)Реохордный мост Р-38
2) Кондуктометрическая ячейка
3) Мерный цилиндр на 50мл
4) 0,1 н. раствор КCl
5) 0,1 н. раствор CH3COOН
6) 0,1 н. раствор CH3COONa
Методика выполнения работы
Измерение электропроводности раствора электролита основано на определении величины его сопротивления электрическому току методом компенсации. Измерение сопротивления проводят в стеклянном сосуде со стальными или платинированными электродами. (Платинирование, т.е. электролитическое покрытие электродов мелко-зернистой платиной необходимо для предотвращения поляризации электродов, что существенно для исследования электропроводности слабых электролитов). Чтобы избежать процесса электролиза, который ведет за собой изменение концентрации электролита, применяют переменный ток высокой частоты. Так как электрический ток идет через весь раствор, объем раствора во всех измерениях должен быть одним и тем же. Установка для измерения сопротивления раствора состоит из стеклянного сосуда и реохордного моста Р-38, панель которого изображена на рисунке 2.
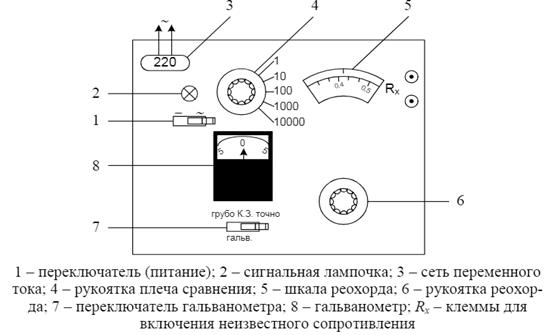
Задание 1. Определение постоянной прибора Z
Практически трудно приготовить электрод с площадью пластин S, точно равной 1 см2 и с расстоянием между пластинами l, точно равным 1 см. Для данного электрода отношение величин l / S = const и называется постоянной электрода Z.
Измерение электропроводности проводят в термостатированной электролитической ячейке. Водный термостат автоматически поддерживает температуру в кожухе ячейки 18±0,5ºС. Перед измерением ячейку два раза ополаскивают 0,1 н. раствором КСl. Для этого наливают 15-20 мл раствора КСl в небольшую колбочку, которую подставляют под нижнюю трубочку ячейки, и засасывают с помощью резиновой трубки раствор КСl в электролитическую ячейку на 1-2 см выше электродных пластин. Раствор выливают в банку для слива и операцию повторяют. После этого раствор КСl засасывают в ячейку на 1-2 см выше электродов, резиновую трубку зажимают зажимом (чтобы раствор КСl не выливался из ячейки) и приступают к определению постоянной сосуда. Подключают контакты электродов к клеммам реохордного моста Р-38 и через 5 минут, когда раствор примет температуру термостата, приступают к измерению сопротивления этого раствора. При включении реохордного моста Р-38 зажигается сигнальная лампочка. Переключатель «Питание» поставить в положение «~». Переключатель плеча сравнения устанавливается в положение «Установка нуля», а переключатель, расположенный на корпусе гальванометра, – в положение «Точно». Вращением рукоятки корректора, расположенного на корпусе гальванометра, устанавливают стрелку гальванометра на ноль, после этого переключатель гальванометра переводят в положение «Грубо». Переключатель плеча сравнения устанавливают в положение «10» и, вращая рукоятку реохорда, добиваются уравновешивания моста. В момент равновесия стрелка гальванометра находиться в нулевом положении. Далее следует устанавливить переключатель реохорда в положение «Точно» и вращая рукоятку «доуравновешивают» мост. Снимают показания с лимба реохорда (m).
Искомое сопротивление будет RКСl =m·Rсравн., где Rсравн – сопротивление плеча сравнения. Затем определяют постоянную Z= 0,0112·Rсравн, где 0,0112 – удельная электропроводность 0,1 н. раствора КСl при 18ºС.
Задание 2. Определение степени и константы электролитической диссоциации раствора CH3COOН
После определения постоянной прибора раствор КСl выливают ёмкость для слива отработанных реактивов, электроды и сосуд 3-4 раза ополаскивают дистиллированной водой.
По заданию преподавателя получают точно измеренный объём исследуемого раствора кислоты, засасывают некоторое количество его с помощью резиновой трубочки в ячейку так же, как и в случае с КСl. Приступают к измерениям. Переключатель плеча сравнения устанавливают в положение «100» или «1000», в зависимости от сопротивления исследуемого раствора, и вращением рукоятки реохордного моста его уравновешивают. Определяют сопротивление раствора уксусной кислоты RK=m·Rcравн., а затем рассчитывают значение удельной электропроводности æ=Z/Rx. Все результаты записывают в таблицу 2.
Сливают раствор из ячейки в колбочку, в которой находится оставшийся исследуемый раствор кислоты. Разбавляют его в два раза, добавляя равное количество дистиллированной воды, хорошо перемешивают и измеряют удельную электропроводность раствора, как описано выше.
Сливают раствор из ячейки в колбочку, где находится исследуемый раствор кислоты, и разбавляют его ещё в два раза. Раствор хорошо перемешивают в колбе и измеряют его удельную электропроводность. Результаты записывают в таблицу 2.
Для каждого разбавления рассчитать: удельную и эквивалентную электропроводность, степень и константу электролитической диссоциации.
Задание 3. Определение коэффициента электропроводности 0,1 н. раствора CH 3 COONa .
После выполнения заданий 1 и 2 ячейки для определения электропроводности ополоснуть два раза 0,1 н. раствором CH3COONa. Определить сопротивление 0,1 н. раствора CH3COONa описанным выше способом и вычислить: удельную и эквивалентную электропроводность, коэффициент электропроводности. Все результаты вписать в таблицу.
Таблица 2
| Раствор | Конц. С | m | Rcравн | Rx | æ | λ | α | K | fЭ | Z |
| КСl | 0,1 н. | |||||||||
| CH3COOН | 0,1 н. | |||||||||
| С/2 | ||||||||||
| С/4 | ||||||||||
| С/8 | ||||||||||
| CH3COONa | 0,1 н. | |||||||||
| С/2 | ||||||||||
| С/4 | ||||||||||
| С/8 |
Вычисления
Для каждого разбавления рассчитать:
1. Сопротивление раствора Rx =m·Rcравн.
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
2. Удельную электропроводность æ=Z/Rx
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
3. Эквивалентную электропроводность раствора 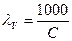 ·æ
·æ
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
4. Степень электролитической диссоциации 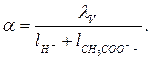
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––5.Константу электролитической диссоциации 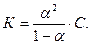
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––6. Коэффициент электропроводности 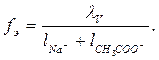
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Сделать вывод об изменении степени и константы степени электролитической диссоциации слабого электролита с изменением концентрации.
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Вопросы для контроля
1.Что такое удельная электропроводность? Её размерность в системе СИ.
2.Что такое молярная электропроводность? Её размерность в системе СИ.
3.Почему в исследованиях пользуются обоими видами электропроводности?
4.Как зависит удельная электропроводность при изменении концентрации для сильных и слабых электролитов?
5.Зависимость молярной электропроводности от разбавления для сильных и слабых электролитов.
6.Основные положения теории Аррениуса.
7.Основные положения теории Дебая и Хюккеля.
8.В чём сущность метода кондуктометрии?
9.Где в сельскохозяйственном производстве используется метод кондуктометрии?
Вывод:__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Оценка________________
Подпись преподавателя___________________
Дата____________________
Лабораторная работа № 6
Дата: 2019-03-05, просмотров: 426.