Однодетерминантная волновая функция, отвечающая определенным проекциям N-электронного орбитального Lz и спинового Sz моментов, не обязательно является собственной функцией операторов квадрата полного орбитального L2 и спинового S2 моментов атома. Тогда собственными функциями этих операторов являются линейные комбинации детерминантов Слейтера, отвечающие одним и тем же значениям квантовых чисел полных орбитального 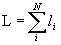 и спинового
и спинового 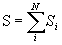 моментов в пределах некоторой электронной конфигурации. Под электронной конфигурацией атома понимают определенное распределение электронов по оболочкам:
моментов в пределах некоторой электронной конфигурации. Под электронной конфигурацией атома понимают определенное распределение электронов по оболочкам: 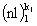 ,
, 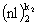 ,
, 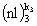 ....
.... 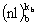 . Каждая (nl)i оболочка представляет собой набор 2(2li+1) спин-орбиталей, из которых ki
. Каждая (nl)i оболочка представляет собой набор 2(2li+1) спин-орбиталей, из которых ki 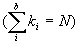 заняты электронами и включены в детерминант Слейтера. Эти ki спин-орбиталей можно выбрать для каждой (nl)i оболочки многими способами, число которых определяется комбинаторными правилами. Соответственно, каждой конфигурации соответствует определенное число однодетерминантных функций. Совокупность этих функций, характеризующаяся одними и теми же значениями квантовых чисел L и S, называется термом. Отдельные волновые функции терма отличаются квантовыми числами проекций этих моментов Lz и Sz. Если пренебречь спин-орбитальным взаимодействием, то все волновые функции терма отвечают одному и тому же (2L+1)(2S+1) - кратно вырожденному энергетическому уровню атома. Спин-орбитальное взаимодействие расщепляет этот вырожденный уровень на так называемые уровни тонкой структуры. Энергия терма равна средневзвешенному значению энергий уровней тонкой структуры. Именно минимум этой энергии определяет порядок, в котором электроны заполняют заполняют атомные оболочки.
заняты электронами и включены в детерминант Слейтера. Эти ki спин-орбиталей можно выбрать для каждой (nl)i оболочки многими способами, число которых определяется комбинаторными правилами. Соответственно, каждой конфигурации соответствует определенное число однодетерминантных функций. Совокупность этих функций, характеризующаяся одними и теми же значениями квантовых чисел L и S, называется термом. Отдельные волновые функции терма отличаются квантовыми числами проекций этих моментов Lz и Sz. Если пренебречь спин-орбитальным взаимодействием, то все волновые функции терма отвечают одному и тому же (2L+1)(2S+1) - кратно вырожденному энергетическому уровню атома. Спин-орбитальное взаимодействие расщепляет этот вырожденный уровень на так называемые уровни тонкой структуры. Энергия терма равна средневзвешенному значению энергий уровней тонкой структуры. Именно минимум этой энергии определяет порядок, в котором электроны заполняют заполняют атомные оболочки.
Отсюда следует, что понятие электронной конфигурации атома не является четким физическим понятием, а зависит от приближения, в котором рассматривается атомная электронная структура.
Квантовая химия молекул
Введение
Квантовая химия рассматривает молекулу как образование из точечных ядер и электронов с целочисленными массами и зарядами. Энергия молекулы имеет составляющие, связанные с кинетическими энергиями каждого электрона и ядра и попарными энергиями их кулоновских взаимодействий (Табл.2.1). Это должно быть надлежащим образом отражено в математическом формализме, описывающем строение и свойства молекул.
Табл. 2.1. Вклады в молекулярную энергию фтористого водорода HF
в равновесной геометрии
| Составляющие энергии | Значение энергии (а.е.) | Вклад в полную энергию |
| Кинетическая Tэ | 99.85594 | 100% |
| N-e ПритяжениеVэя | -250.58398 | -251% |
| e-e Отталкивание + Обмен | 45.49697 | 46% |
| N-N Отталкивание Vяя | 5.22817 | 5% |
| Полная энергия | -100.00290 | -100% |
Основное уравнение молекулярной квантовой химии - независящее от времени нерелятивистское уравнение Шредингера:
· · НY ({r, R})=ЕY ({r, R}), (2.1)
Здесь H-молекулярный гамильтониан, E-полная энергия молекулы, Y ({r,R}) - молекулярная волновая функция, с помощью которой в принципе могут быть рассчитаны химические свойства молекулы. Символом {r, R} обозначена совокупность координат всех электронов и ядер.
Нерелятивистский гамильтониан молекулы включает члены, описывающие все перечисленные выше вклады в энергию, и имеет вид
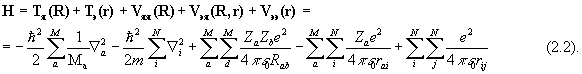
Здесь i, j относятся к электронам и a, b - к ядрам, Mа и m - массы ядер и электронов, R и r - наборы ядерных и электронных координат, спин-орбитальным взаимодействием пренебрегаем. В дальнейшем изложении для простотымы будем использовать атомную систему единиц, полагая е=1, m=1, 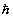 =1. Множитель
=1. Множитель 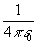 в этой системе не возникает.
в этой системе не возникает.
Дата: 2019-02-19, просмотров: 376.