Точное значение нормированной радиальной функции Rn,l для водородоподобного атома дается выражением:
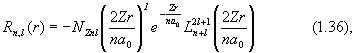
где 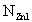 - нормировочный множитель, зависящий от Z, n и l,
- нормировочный множитель, зависящий от Z, n и l,
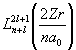 - присоединенные полиномы Лягерра,
- присоединенные полиномы Лягерра,
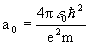 - радиус Бора; a0=0.529177·10-10м, l= 0,1,2,3,...,
- радиус Бора; a0=0.529177·10-10м, l= 0,1,2,3,..., 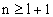 .
.
Выражение (1.36) есть решение радиального уравнения Шредингера 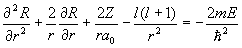 , конкретный вид которого возник после разделения переменных в сферических координатах. Несколько первых полиномов Лягерра, описывающих основное (n = 1) и первые возбужденные (n = 2, n = 3) состояния, приведено в таблице 1.2, их зависимость от r изображена на рис. 1.2, 1.3.
, конкретный вид которого возник после разделения переменных в сферических координатах. Несколько первых полиномов Лягерра, описывающих основное (n = 1) и первые возбужденные (n = 2, n = 3) состояния, приведено в таблице 1.2, их зависимость от r изображена на рис. 1.2, 1.3. 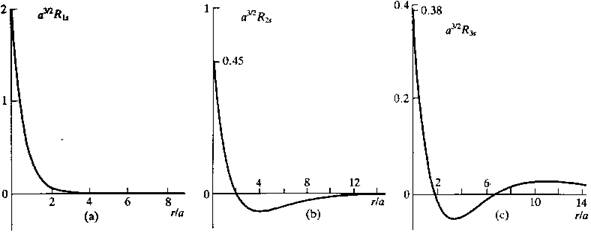
Рис.1.2. Радиальные составляющие 1s (a), 2 s (b), 3 s (c) орбиталей атома водорода.
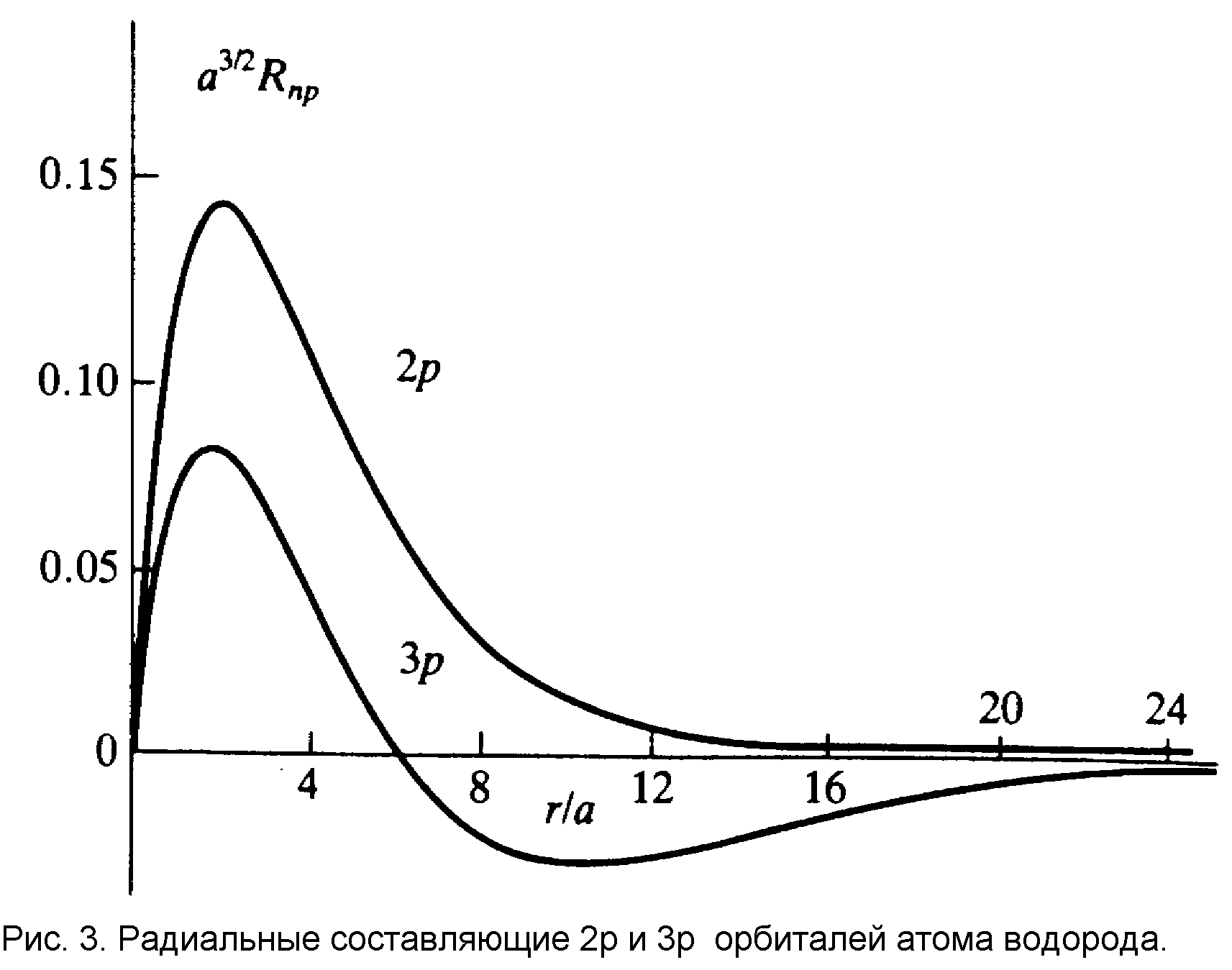
Отметим некоторые свойства радиальных функций.
1) Как следствие свойств полиномов Лягерра, радиальные функции с различными n и l ортогональны.
2) Имеются точки (поверхности), где функции Rn,l (r) обращаются в нуль; они называются узловыми точками (поверхностями) или просто узлами. Вероятность найти электрон в узле равна нулю.
Таблица 1.2. Радиальные функции (нормированные функции Rn,l ( r ))
| n | l | Rn,l ( r ) |
| 1 | 0 | 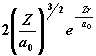
|
| 2 | 0 1 | 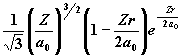
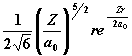
|
| 3 | 0 1 2 | 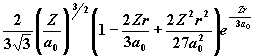
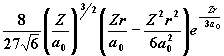
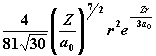
|
Радиальные функции с (n=1, l=0), (n=2, l=1), (n=3, l=2) и т.д. не имеют узловых точек; функции с (n=2, l=0), (n=3, l=1) и т.д. имеют одну узловую точку; функция с (n=3, l=0) – две узловые точки. Таким образом, число узлов радиальной функции равно (n-l-1).
3) Вероятность нахождения электрона в пространстве между значениями r и r+dr (слое) равна: 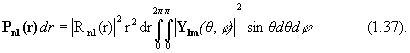
(из-за ортонормированности угловых функций - см. ниже - 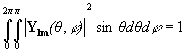 .
.
Функция Pnl (r), определяющая плотность вероятности нахождения электрона на расстоянии r от ядра, называется радиальной функцией распределения (см. рис.1.4)
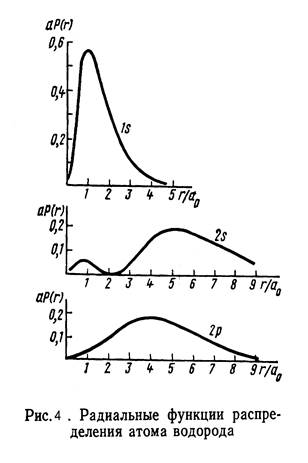 Приравнивая нулю производную Pnl по r, можно найти наиболее вероятное положение электрона на соответствующей орбитали. Для основного состояния атома водорода оно равно радиусу Бора
Приравнивая нулю производную Pnl по r, можно найти наиболее вероятное положение электрона на соответствующей орбитали. Для основного состояния атома водорода оно равно радиусу Бора 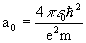 .
.
4) Вблизи ядра электрон-ядерный потенциал (1.5) становится неопределенным из-за стремления знаменателя к нулю. Чтобы волновая функция на ядре была конечна и не равна нулю, необходимо, чтобы ее радиальная часть удовлетворяла асимптотическому условию
(¶ R/¶ r)| r® 0 = -(Z/a0)Rr® 0 . (1.38)
5) На больших расстояниях от ядра атомная орбиталь зависит от r как
R ~ exp [ -(2I1)1/2 r], (1.39)
где I1 - первый потенциал ионизации.
Угловые функции Ylm (q , j ) - собственные функции оператора квадрата углового момента L2 - описывают в сферических координатах (q , j ) угловую зависимость вероятности нахождения электронов в центральном поле атома. Они представляют собой сферические гармоники:
Ylm(q, j) = (-1)(m+|m| )/2{[(2l+1)/4p](1-| m| )! / (1+| m| )!}1/2 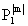 (cosq)exp(imj) (1.40)
(cosq)exp(imj) (1.40)
где l=0,1,2,..; m=-l, ...+l, 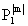 (cosq ) - присоединенные полиномы Лежандра.
(cosq ) - присоединенные полиномы Лежандра.
Это комплексные ортонормированные функции, из которых легко построить действительные комбинации, оставляющие АО собственными функциями того же одноэлектронного уравнения:
ylm+ = (1/ 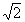 )[Ylm+ Yl-m),
)[Ylm+ Yl-m),
ylm- = -(i/ 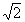 )[Ylm- Yl-m), l=0,1,2, ... , m=0,1,2 , ... , l (1.41)
)[Ylm- Yl-m), l=0,1,2, ... , m=0,1,2 , ... , l (1.41)
Таблица 1.3. Угловые части волновой функции атома, обладающего центральным полем.
| l | m | ylm | Линейная комбинация | обозначение |
| 0 | 0 | 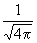
| - | s |
| 1 | 0 | 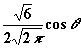
| - | pz |
| 1 | ± 1 | 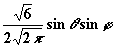
| 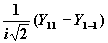
| py |
| 1 | ± 1 | 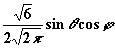
| 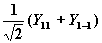
| px |
| 2 | 0 | 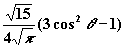
| - | dz2 |
| 2 | ± 1 | 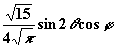
| 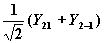
| dxz |
| 2 | ± 1 | 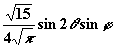
| 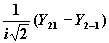
| dyz |
| 2 | ± 2 | 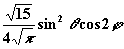
| 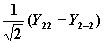
| dx2-y2 |
| 2 | ± 2 | 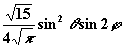
| 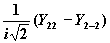
| dxy |
Как видно из таблицы 3 и рисунков 5 и 6, действительные угловые функции имеют простую интерпретацию в декартовых координатах. Для них, также как и для радиальных функций, характерно наличие узлов и узловых плоскостей.
При классификации электронных состояний атома придерживаются следующих представлений. Главное квантовое число n характеризует энергию орбитали. Орбитальное квантовое число l характеризует угловую зависимость орбитали (орбитальный момент). Для каждого l приняты свои обозначения (таблица 1.4 ).
Таблица 1.4. Обозначения орбиталей с различными угловыми зависимостями.
| l | 0 | 1 | 2 | 3 | 4 | 5 |
| Символ | s | р | d | f | g | h |
Важно понимать, что как результат приближения центрального поля угловая зависимость АО всех атомов одинакова!
Дата: 2019-02-19, просмотров: 431.