Промежуточными фторидами называют соединения с общей формулой UFn, где n - отношение фтора к урану в пределах 4<n<5. Индивидуальными соединениями обычно признают U4F7 (UF4,25) и U2F9 (UF4,5). Одновременно целесообразно рассмотреть и свойства пентафторида урана UF5. Однако более поздние исследования показали, что система U-F выглядит более сложной, так как фториды урана, подобно разобранным в свое время окислам урана, образуют непрерывный гомологический ряд типа UnF4n+2. Действительно, при п=1существует UF6 - известный нам гексафторид урана; при n=2 U2F10, т. е. UF5 —пентафторид урана; при n =3 U3F14= UF4,67. Соединение такого состава обнаружил экспериментально в определенных условиях американский ученый Лейбтон: n = 4, U4F18 или U2F9 - уже известный нам промежуточный фторид черного цвета. Значения n=5, 6 и 7 дают соответственно U5F22, U3F13 и U7F30 или UF4,4, UF4,33 и UF4,29, которые также идентифицированы Лейбтоном; n=8, U4F17 или UF4,25 - ранее упомянутый и довольно подробно описанный промежуточный фторид. Далее могут быть U9F38 и U10F42, Лейбтон упоминает даже UF4,12, UF4,1 и UF4,02. Например, UF4,1 - это 20-й член гомологического ряда. Но такие соединения уже трудно отличить от обычного тетрафторида урана UF4 даже с помощью рентгеноструктурного анализа.
Несомненно, что химия промежуточных фторидов урана еще ждет подробных исследований, так как наши знания в этой интересной и важной области все еще недостаточны.
Промежуточные фториды и пентафторид урана могут быть получены при действии фтора (фтор-газа) на тетрафторид урана по реакциям:
4UF4 + ½ F2 ® U4F17
2UF4 + ½ F2 ® U2F9
UF4 + ½ F2 ® UF5
Эти реакции практически необратимы. Другие реакции, позволяющие получить промежуточные фториды урана, - это обратимые реакции взаимодействия тетрафторида урана с гексафторидом:
7UF4 + UF6 « 2U4F17
3U4F17 + 2UF6 « 7U2F9
Поскольку эти реакции протекают ступенчато, можно подобрать условия (температуру, соотношение компонентов), которые обеспечат получение того или иного промежуточного продукта.
Установлено, что при 220° С и ниже какие-либо реакции между фтором и тетрафторидом урана не идут. Однако при 300° С и давлении 42 мм рт. ст. реакция между UF4 и F2 протекает с образованием промежуточных фторидов. Это видно из следующих данных:
| Давление пара UF6 , мм рт.ст. | |||
Получаемые продукты
Характерное свойство промежуточных фторидов, а также пентафторида - их малая термическая стойкость, обусловленная реакциями диспропорционирования при нагревании:
2UF5 « UF4 + UF6
2U2F9 « 3UF4 + UF6
2U4F17 « 7UF4 + 2UF6
 Чем выше температура, тем беднее гексафторидом урана образующиеся промежуточные соединения, т. е. тем ближе они к тетрафториду. Это объясняется обратимостью рассматриваемых реакций вследствие разложения получаемых соединений с отщеплением UF6. При умеренных температурах промежуточные фториды достаточно устойчивы. Так, при 300° С давление паров UF6 над U4F17 составляет всего 1,5 мм рт. ст.
Чем выше температура, тем беднее гексафторидом урана образующиеся промежуточные соединения, т. е. тем ближе они к тетрафториду. Это объясняется обратимостью рассматриваемых реакций вследствие разложения получаемых соединений с отщеплением UF6. При умеренных температурах промежуточные фториды достаточно устойчивы. Так, при 300° С давление паров UF6 над U4F17 составляет всего 1,5 мм рт. ст.
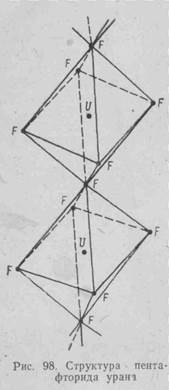
Промежуточные фториды не являются двойными соединениями типа xUF4 . yUF6, например UF4 . UF6, 3UF4 . UF6 или 7UF4 . UF6. Рентгеноструктурные исследования, например, UF5 показывают, что все ионы урана структурно эквивалентны (рис. 98). Однако существует и противоположная точка зрения, когда промежуточные фториды рассматривают как двойные фториды xUF4 . yUF6. Образование промежуточных фторидов, как будет показано в дальнейшем, используют в технологии для улавливания UF6 из отходящих газов гексафторидного производства.
В связи с тем, что температура плавления пентафторида урана низка (»400° С), он причиняет иногда на производстве неприятности. Образуясь из-за случайных отклонений процесса фторирования при средних температурах, он плавится, создает настыли, «течи» в аппаратах и т. п.
ГЕКСАФТОРИД УРАНА
 Гексафторид урана, пожалуй, наиболее интересное его соединение. Как уже говорилось, UF6 - это единственное легколетучее соединение урана. Он может быть получен при комнатной температуре в газообразном состоянии (правда, при пониженном давлении), что чрезвычайно важно для осуществления технологического процесса газовой диффузии и других физических методов разделения изотопов уран-235 и уран-238.
Гексафторид урана, пожалуй, наиболее интересное его соединение. Как уже говорилось, UF6 - это единственное легколетучее соединение урана. Он может быть получен при комнатной температуре в газообразном состоянии (правда, при пониженном давлении), что чрезвычайно важно для осуществления технологического процесса газовой диффузии и других физических методов разделения изотопов уран-235 и уран-238.
Существование гексафторида урана было установлено Дите в 1880 г. Первые исследования выполнили Руфф и Хайнцельман в 1909 г., хотя некоторые их результаты впоследствии не подтвердились. В настоящее время физические и химические свойства гексафторида урана подробно изучены как советскими, так и американскими исследователями.
Физические свойства гексафторида урана. Гексафторид урана - твердое, почти бесцветное вещество, кристаллы, сильно газящие белым дымом на воздухе.
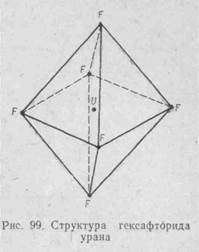
В молекуле UF6 центральный катион U6+ с радиусом 0,83 А полностью экранирован окружающими его шестью ионами фтора (ионный радиус 1,33 А). Это обусловливает молекулярный (а не ионный) характер кристаллической решетки гексафтори.да урана, его низкую температуру плавления и высокую летучесть (рис. 99).
Гексафторид урана при обычных условиях легко и обильно возгоняется, не плавясь, - сублимируется из газовой фазы осаждается в виде твердого продукта на холодных частях аппаратуры подобно инею. В табл. 44 приведено давление насыщенного пара гексафторида урана над твердым продуктом при различных температурах.
Таблица 44
Давление насыщенного пара гексафторида урана, находящегося в равновесии с твердым продуктом
| Температура, оС | Давление пара, мм рт.мт. | Температура, оС | Давление пара, мм рт.мт. | Температура, оС | Давление пара, мм рт.мт. |
| -200 | 10-6 | -20 | 3,11 | 50 | 552,4 |
| -150 | 1-11 | 0 | 16,9 | 56,5 | 760 |
| -100 | 4,5.10-5 | 25 | 119,5 | 60 | 910 |
| -50 | 1,2.10-1 | 40 | 295,4 | 64,5 | 1134 |
При температуре 56,5° С давление пара гексафторида урана над твердым продуктом составляет 760 мм рт. ст. Это температура «кипящего» гексафторида. При повышенном давлении гексафторид урана плавится, превращаясь в прозрачную подвижную бесцветную жидкость с плотностью 3,63 г/см3. Плотность твердого UF6 4,9—5,1 г/см3, а плотность его в газообразном состоянии по отношению к водороду совершенно точно отвечает половине молекулярной массы, т. е. 352/2 ==176. Это свидетельствует о том, что газообразный гексафторид урана ведет себя подобно идеальному газу, и никакой ассоциации молекул в газообразном состоянии не наблюдается.
Тройная точка для гексафторида урана определена как 64,05° С прибавлении пара 1134 мм рт. ст. (~1,5 атм). Давление насыщенного пара UF6 над жидким продуктов приведено в табл.45.
Таблица 45
Давление насыщенного пара гексафторида урана, находящегося в равновесии с жидким продуктом
| Температура, оС | Давление пара, мм рт.мт. | Температура, оС | Давление пара, мм рт.мт. |
| 64,05 | 1134 | 90 | 2362 |
| 65 | 1175 | 95 | 2765 |
| 70 | 1361 | 100 | 3020 |
| 80 | 1812 |

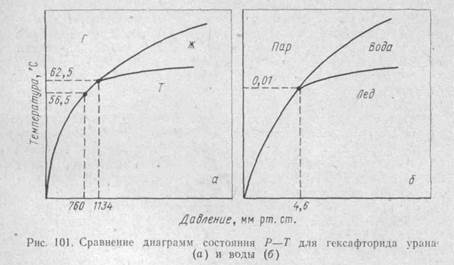
Диаграмма состояния Р—Т для гексафторида урана показана на рис. 100. Эта диаграмма в принципе напоминает диаграмму состояния Р—Т для обычной воды, где, как известно, также имеется тройная точка (лед, вода, пар) при температуре 0,01°С и давлении 4,6 мм рт. ст. (рис. 101). Диаграмма состояния гексафторида урана имеет исключительно важное значение для понимания целого ряда технологических вопросов производства гексафторида урана.
Химические свойства гексафторида урана. Гексафторид урана — вещество весьма реакционноспособное, легко вступающее в реакцию с другими веществами. С водой он реагирует очень бурно по реакции
UF6 + 2Н2О ® UO2F2 + 4НF,
поэтому на воздухе гексафторид урана сильно дымит. Активно реагируя почти со всеми металлами, UF6 образует на их поверхности прочные фторидные пленки, которые препятствуют дальнейшей реакции. Это относится прежде всего к таким металлам, как Fe, Cu, Ni, стойким в среде газообразного фтора вплоть до 400—450°С и поэтому широко используемым для изготовления соответствующей аппаратуры. Однако металлические Нg и Nа реагируют с фтором и UF6 уже на холоду; в этом случае продукты реакции не препятствуют ее протеканию.
UF6 не реагирует с Сl2, Вr2, О2, N2 и СО2. С водородом реакция UF6 + Н2 ® 2HF + UF4 идет очень медленно. Для ее ускорения требуются высокая температура, влияние ультрафиолетового излучения или электрического разряда. В отличие от водорода газообразный аммиак реагирует с UF6 даже при температуре сухого льда с образованием NH4UF5 и NH4F.
Гексафторид урана фторирует многие органические вещества (спирты, эфиры, бензол, толуол и т. п.), восстанавливаясь до UF4. В некоторых органических жидкостях он хорошо растворяется (например, в СCl4, CHCl3, C2H2Cl2, а также во фторуглеродах).
Значение и место гексафторида урана в атомной технике. Гексафторид урана широко используется в атомной промышленности. В принципе возможно самостоятельное применение UF6 в качестве ядерного топлива в газофазных реакторах. Однако в этом есть не только свои преимущества (легкость загрузки, выгрузки и циркуляции), но и множество трудностей технологического и инженерного порядка (радиационная неустойчивость, коррозия и т. п.). Во всяком случае применение UF6 в качестве непосредственного ядерного топлива - дело будущего. Более важно использование UF6 для разделения изотопов уран-238 и уран-235, поскольку UF6 является единственным урансодержащим веществом, существующим при обычной температуре в газообразном состоянии.
Первоначально для разделения изотопов урана пытались, например в США, использовать электромагнитный метод, основанный на различии скоростей ионов неодинаковой массы в электромагнитном поле. Однако электромагнитный метод не получил дальнейшего развития вследствие трудностей его практического осуществления.
В крупном промышленном масштабе разделение изотопов урана осуществляют методом газовой диффузии или методом центрифугирования. В обоих случаях используют газообразный гексафторид урана, являющийся и сырьем, и рабочим газом, и конечным продуктом процесса.
Метод газовой диффузии основан на молекулярном истечении газа, при котором поток отдельных молекул проходит через пористую перегородку с мельчайшими отверстиями. При этом соединение более легкого изотопа, в данном случае гексафторид урана-235, проходит легче и концентрируется за перегородкой. Соответственно тяжелый изотоп концентрируется перед перегородкой.
Максвелл показал, что относительная скорость, с которой молекулы газа попадают в малые отверстия, обратно пропорциональна квадратному корню из их молекулярных масс: V2/V1 = (M1/M2)1/2, в нашем случае (352/349)1/2 = 1,0043, где 352 и 349 -соответственно массы молекул гексафторида тяжелого и легкого изотопов урана. Таким образом, если газообразному UF6, приготовленному из природного урана, дать возможность проходить через пористую перегородку, то концентрация легких и тяжелых молекул до и после перегородки изменится в отношении 1,0043 (практически даже несколько меньше).
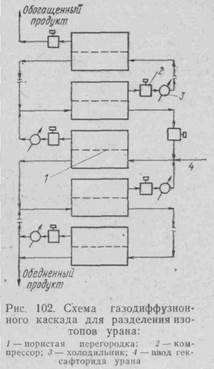 Очевидно, что эффект однократного прохождения ничтожно мал, но многократное повторение такого прохождения дает желаемый результат. Иначе говоря, следует строить каскад с очень большим числом ступеней разделения, или обогащения. Аппаратуру, используемую при этом, изготовляют прецизионно точной, она работает под вакуумом и абсолютно герметична. Размер пор в перегородках составляет 100—300 А. Схема газодиффузионного каскада показана на рис. 102.
Очевидно, что эффект однократного прохождения ничтожно мал, но многократное повторение такого прохождения дает желаемый результат. Иначе говоря, следует строить каскад с очень большим числом ступеней разделения, или обогащения. Аппаратуру, используемую при этом, изготовляют прецизионно точной, она работает под вакуумом и абсолютно герметична. Размер пор в перегородках составляет 100—300 А. Схема газодиффузионного каскада показана на рис. 102.
Чтобы получить уран, обогащенный изотопом уран-235 до 95% от исходных 0,71%, требуется огромное число ступеней каскада, например 3000—5000. На первый взгляд, число 5000 кажется чрезмерно большим. Однако его можно подсчитать из выражения (1,001)х= 99/0,7, где 1,001 - практический фактор разделения; 0,7 - содержание урана-235 в природном уране; 99 - содержание урана-235 в обогащенном уране; х - число разделительных каскадов. При этих условиях х=5000 каскадов.
Метод газовой диффузии разделения изотопов урана чрезвычайно дорог и энергоемок. Он требует большого количества достаточно сложного оборудования, огромных площадей производственных помещений, зданий большой протяженности и кубатуры. Сама аппаратура весьма дорога.
Вот некоторые данные о газодиффузионном заводе К-25 военного значения в Ок-Ридже (шт. Теннесси), США. Этот завод был построен в годы второй мировой войны, на нем была изготовлена первая атомная бомба, сброшенная на Хиросиму. Он представляет собой шестиэтажное здание в виде буквы П длиной 1,6 км и шириной 120 м. Площадь диффузионных перегородок в аппаратуре этого завода составляет несколько гектаров. Перегородки имеют около 1 млн. отверстий на 1 см2 с диаметром каждого не более 10-6 см.
Количество энергии, расходуемой на таком заводе, эквивалентно энергии, производимой несколькими крупнейшими электростанциями США. После войны было построено еще два таких же завода — в Портсмуте (шт. Огайо) и в Падьюке (шт. Кентукки). Все эти заводы при полной нагрузке потребляют 1/10 всей электроэнергии, производимой электростанциями США. Общая производственная площадь трех заводов 800 тыс. м2.
Обслуживающий персонал на каждом заводе около 1000 человек, в основном высококвалифицированных специалистов с техническим образованием. В период с 1943 по 1960 г. в США было вложено свыше 2 млрд. долл. в строительство и усовершенствование газодиффузионных заводов и переработано на них более 150 тыс. т урана, содержащего свыше 800 т урана-235. С 1964 г. газодиффузионные заводы США работают не на полную мощность, в основном в режиме производства слабообогащенного урана для нужд энергетики. Предполагается построить четвертый, еще более крупный газодиффузионный завод в шт. Алабама стоимостью 2,75 млрд. долл.
В Европе крупный газодиффузионный завод сооружает фирма «Евродиф», финансируемая капиталистами Франции, Италии, Бельгии, Испании и Ирана. Для снабжения этого завода электроэнергией будет построено четыре атомные электростанции мощностью по 925 Мвт каждая. Пуск комплекса намечен на 1978—1979 гг.
Несмотря на то, что газодиффузионная технология была единственной технологией, успешно используемой в зарубежной практике для разделения изотопов урана в течение более 25 лет, ее высокая энергоемкость является сдерживающим фактором. Поэтому в настоящее время разрабатывают и другие методы разделения изотопов урана.
Ближайший конкурент газодиффузионного метода – метод газового центрифугирования, основанный на разделении газов с разными молекулярными массами при прохождении через центробежное поле. Если коэффициент обогащения a невысок, то уравнение, связывающее a с молекулярными массами М1 и М2 разделяемых газов, может быть записано в следующем виде: a - 1 = (М2 - М1) (r22 –r12)w/2RT, где r1 и r2 — внутренний и внешний радиксы центрифуги; w — угловая скорость вращения (число оборотов, умноженное на 2p). Из этого уравнения видно, что эффективность разделения зависит не от отношения молекулярных масс, а от их разности, что особенно выгодно для разделения изотопов тяжелых элементов. В почти обратимом разделительном потоке при центрифугировании расходуется небольшое количество энергии главным образом на преодоление трения.
Уровень разработки центробежной технологии разделения изотопов урана в странах Западной Европы достиг стадии промышленного освоения. Усилиями ФРГ, Великобритании и Нидерландов построено три опытно-промышленные установки с центрифугами (по одной установке в каждой из стран). Считается, что накоплен достаточный опыт для строительства крупного завода.
В США также ведут разработки центрифуг для создания технологии, конкурентоспособной с газодиффузионной.
Основное преимущество центробежной технологии — в уменьшении удельного расхода электроэнергии в 10 раз и, следовательно, в меньшей зависимости от источников энергии. Кроме методов газовой диффузии и газового центрифугирования исследуют другие методы разделения урана: плазменный, лазерный, ионообменный, метод «разделительного сопла». Наиболее перспективным из них представляется лазерный метод, так как в принципе он позволяет почти в 200 раз уменьшить затраты энергии на разделение.
Как уже говорилось, единственным урансодержащим продуктом, пригодным для большинства из перечисленных методов, является UF6 . В природном уране всего 0,71% легкого изотопа. В результате обогащения получают два продукта: гексафторид урана с содержанием урана-235 2, 5, 10, 50 и 95% и обедненный «отвал», где содержание легкого изотопа понижено до 0,2—0,4%. Обогащенный уран в виде гексафторида перерабатывают химическими методами в тетрафторид урана, двуокись урана и металлический уран. Эти продукты принимают в качестве основы для твэлов, используемых в атомной энергетике, или для атомных бомб.
Дата: 2019-02-25, просмотров: 366.