Химические методы. Во многих технологических схемах исходные растворы содержат уран в виде уранил-сульфата или уранил-хлорида. В этом случае возможно:
1) восстановление гипосульфатом по реакции
2UО2Cl2 + Na2S2O4 + 4HCl ® 2UCl4 + Na2SO4 + SO2 + 2H2O
2) восстановление с помощью SnCl2;
3) восстановление ронгалитом NaHSO2.CH2O.2H2O;
4) восстановление тиомочевиной (NH2)2CSO2;
5) восстановление железным скрапом, цинковой пылью, порошком алюминия (пудрой) по реакции типа:
UO2 (SO4) + Feo + 2H2SO4 ® U(SO4)2 + FeSO4 + 2H2O
UO2 (SO4) + Zno + 2H2SO4 ® U(SO4)2 + ZnSO4 + 2H2O
6) восстановление некоторыми реагентами, например, формальдегидом, спиртом, и т.п. в присутствии катализаторов и при нагревании. Такими катализаторами могут служить сульфиды некоторых редких металлов. Опубликованы данные о восстановлении урана водородом в присутствии платинового катализатора.
Электрохимические методы. Под действием постоянного тока протекают следующие электрохимические реакции:
На катоде: UO22+ + 2е + H2SO4 ® U(SO4)2 + Н2О
На аноде: SO42- - 2е ® SO4;
SO4 ® SO3 + ½ O2;
SO3 + Н2О ® H2SO4;
H2SO4 ® 2H+ + SO42-
_____________________________________
H2O – 2e ® 2H+ + ½ O2
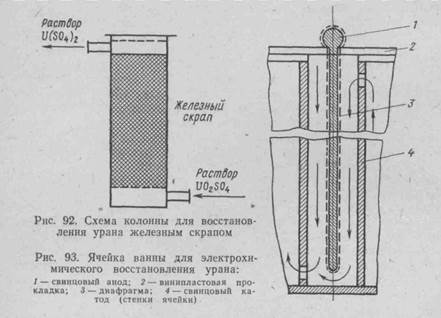
Процесс осуществляют в свинцовых ваннах, стенки и перегородки которых служат катодом. Аноды выполнены также из свинца. В качестве диафрагмы, разделяющей католит и анолит, применяют синтетическую ткань (перхлорвинил). Электровосстановление подчиняется законам Фарадея. Выход по току до стигает 90—95%, а степень восстановления урана 99—98%.
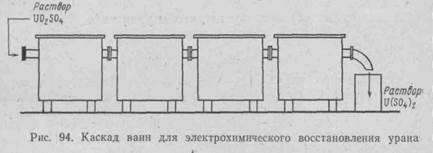
Ячейка ванны для электрохимического восстановления уранилсульфата показана на рис. 93. Обычно ванны соединяют в каскад с последовательным протеканием раствора и параллельной коммутацией постоянного тока (рис.94).
Достоинство метода электрохимического восстановления — отсутствие загрязнения раствора какими-либо примесями. Однако низкая растворимость получаемого сульфата урана U(SO4)2, составляющая не более 60—65 г/л по урану, обусловливает применение довольно разбавленных растворов. От этого недостатка свободен метод электрохимического восстановления уранил-хлорида, однако в этом случае сложнее подобрать стойкие материалы, в частности для анода. Недостаток процесса электрохимического восстановления - трудность увеличения масштаба и интенсификации, поэтому в промышленной практике он постепенно уступает место другим методам.
Методы фотохимического восстановления. Многие вещества, способные окисляться, активно восстанавливают U6+ под действием квантов света, например солнечного или искусственного света (ртутная лампа). Какие же это вещества? Ими могут быть различные органические соединения: этиловый спирт, формальдегид, муравьиная кислота, щавелевая кислота и др. Особенно хорошо идет процесс восстановления в присутствии фторид-ионов, так как образующийся UF4 сразу выводится из сферы реакции
UO2(NO3)2 + C2H5OH + 4HF + h u ® UF4 + CH3CHO + 2HNO3 + 2Н2О
Процессы фотохимического восстановления очень интересны, но на практике их в большом масштабе пока не применяют.
Для осаждения тетрафторида урана из его солей, содержащих уран в восстановительной форме, требуется НF, используемый обычно в виде плавиковой кислоты - продукта, содержащего 40% НF. Для получения тетрафторида «сухим» методом из двуокиси урана также необходим НF, в этом случае 100%. Таким образом, производство тетрафторида урана тесно связано с получением фтористого водорода и плавиковой кислоты.
Дата: 2019-02-25, просмотров: 379.