| Реакция с сывороткой | Подверженность | Связывание | ||||||||
| с Duffy- | ||||||||||
| анти- | инвазии | |||||||||
| Эритроциты | гликопротеинами | |||||||||
| Fy a | Fy b | Fy3 | Fy6 | P. | P. | P. | P. | |||
| knowlesi | vivax | knowlesi | vivax | |||||||
| Fy:1,2,2,6 | + | + | + | + | + | + | + | + | ||
| Человека | Fy:1, −2,2,6 | + | – | + | + | + | + | + | + | |
| Fy: −1,2,2,6 | – | + | + | + | + | + | + | + | ||
| Fy: −1, −2, −2, −6 | – | – | – | – | – | – | – | – | ||
| Обработанные | – | – | + | – | – | – | – | – | ||
| химотрипсином | ||||||||||
| Обезьян | Macaca mulatta | – | + | + | – | + | – | + | – | |
| Saimiri sciureus | – | – | + | + | + | + | + | – | ||
| Cebus apella | – | – | + | – | – | – | + | – | ||
| Aotus triviratus | – | + | + | + | + | + | + | + | ||
Протеины, связывающиеся с Duffy-положительными эритроцитами, но инертные по отношению к эритроцитам Fy(a −b −), обнаружены Haynes и соавт. [68], Wernheimer, Barnwell [177] в супернатантах культур P. vivax и P. knowle-si на этапе образования мерозоитов. Протеины, выделенные из P. knowlesi, и P. vivax, имели мол. массу 135 и 140 кДа соответственно. Связывание их с эри-троцитами удавалось ингибировать антителами анти-Fy6, а также хемокинами IL-8 и MGSA (Haynes и соавт. [68], Miller и соавт. [111], Wernheimer, Barnwell [177]). Обработка Duffy-положительных клеток химотрипсином предотвра-щала связывание этих протеинов с клетками, а обработка трипсином была
622
малоэффективной. Эритроциты Fy(a −b −), подвергнутые инвазии P. knowlesi, не связывали протеины, выделенные из культур указанного паразита (Mason и со-авт. [102], Haynes и соавт. [68]). Очищенный протеин паразита специфически связывался с очищенным Duffy-протеином. Гены, кодирующие синтез обоих протеинов, удалось клонировать. Установлено, что экстрацеллюлярные домены каждого из белков в шести регионах имели одинаковую аминокислотную по-следовательность (Adams и соавт. [9]). Клетки линии COS-7 экспрессировали участки, богатые цистеином, за счет которых формировались розетки с Duffy-положительными эритроцитами, но не эритроцитами Fy(a −b −) (Chitnis, Miller [33]). Розеткообразование блокировалось синтетическими пептидами, в кото-рых аминокислотные последовательности в позициях 8–42 были идентичны та-ковым на N-терминальном домене Duffy-гликопротеина (Chitnis и соавт. [32]). Эритроциты лиц, гетерозиготных по мочащему гену Fy, связывали меньшее ко-личество протеина P. vivax по сравнению с клетками людей, обладающих двумя генами FY. Это может свидетельствовать о том, что в районах, эндемичных по P. vivax, даже гетерозиготность по гену Fy создает селективные преимущества (Michon и соавт. [106]). Протеины P. knowlesi и P. vivax, вступающие в реакцию соединения с Duffy-гликопротеином эритроцитов человека, имели высокую сте-пень гомологии с гликопротеином P. falciparum (Adams и соавт. [9]). Анализ ли-гандов, связывающихся с Duffy-гликопротеинами, позволил идентифицировать вариабельные гены var, кодирующие эндотелиальные цитоадгезивные протеи-ны у P. vivax (Hadley, Peiper [63], Pogo, Chaudhury [135]).
Singh и соавт. [149] выделили функциональный участок протеина P. vivax – PvRII, связывающегося с Duffy-гликопротеином. Протеин PvRII оказался высоко-иммуногенным и стимулировал выработку специфических антител в высоком ти-тре. Последние ингибировали связывание P. vivax с эритроцитами. Протеин PvRII перспективен для создания вакцины против P. vivax, которая предохраняет также от заражения P. falciparum (Singh и соавт. [149], Williams и соавт. [180]).
Jilma-Stohlawetz и соавт. [82] сообщили о различиях в содержании хемоки-нов у мужчин и женщин. Содержание в плазме фактора хемотаксиса моноцитов было выше у мужчин, а также у лиц с фенотипом Fy(a −b −).
реципиентов с пересаженной почкой во время кризов отторжения (Segerer
8. соавт. [145, 146], Alkalin, Neylan [12]), а также у больных раком предстатель-ной железы (Lentsch [88]) концентрация хемокинов повышалась.
Н.Д. Герасимова [1] нашла повышенную частоту фенотипа Fy(a −) у онколо-гических больных.
Список литературы
35.Герасимова Н.Д. Распределение эритроцитарных антигенов и антител у онкологических больных: автореф. дис. … канд. биол. наук. – М., 2003. – 16 с.
36.Групповые системы крови и гемотрансфузионные осложнения / под ред. проф.
М.А. Умновой. – М.: Медицина, 1989. – 160 c.
623
α Доссе Ж. (Dausset J) Иммуногематология / пер. с фр. Ю.И. Лорие / под ред. П.Н. Косякова. – М: Медгиз, 1959. – 638 с.
α Мороков В.А. Генетические маркеры эритроцитов среди субпопуляций коми // Гематол. и трансфузиол. – 1989. – № 10. – С. 24–27.
α Мороков В.А. Случаи сенсибилизации резус-положительных лиц фенотипа CCDee антигенами эритроцитов // Гематол. и трансфузиол. – 1990. – № 5. – С. 30.
α Пискунова Т.М. Распределение фактора Даффи (Fy a ) среди населения Москвы // Вопросы антропологии. – 1964. – Вып. 18. – С. 104–108.
α Умнова М.А., Скачилова Н.Н., Пискунова Т.М. и др. Гемотрансфузионные осложнения, обусловленные несовместимостью по фактору Даффи (Fy a) // Пробл. гематол. – 1982. – № 12. – С. 11–16.
α Умнова М.А., Скачилова Н.Н., Пискунова Т.М. и др. Необычные антитела системы Даффи у больной гемотрансфузионным осложнением // Пробл. гематол. – 1977. – № 12. – С. 38–40.
α Adams J.H., Kim Lee Sim B., Dolan S.A. et al. A family of erythrocyte binding proteins of malaria parasites // Proc. Nat. Acad. Sci. USA. – 1992. – V. 69. – P. 340–350.
α Albrey J.A., Vincent E.E.R., Hutchinson J. et al. A new antibody, anty-Fy3, in the Duffy blood group system // Vox Sang. – 1971. – V. 20. – P. 29–35.
α Algora M., Barbolla L., Contreras M. Naturally occurring anti-D, anti-K, anti-Fy a, anti-Le ab // Vox Sang. – 1991. – V. 61. – P.141.
α Alkalin E., Neylan J.F. The influence of Duffy blood group on renal allograft outcome in African Americans // Transplantation. – 2003. – V. 75. – P. 1496–1500.
α Badakere S.S., Bhatia H.M. A fatal transfusion reaction due to anti-Duffy (Fy a): case report // Indian J. Med. Sci. – 1970. – V. 24. – P. 562–564.
α Badakere S.S., Bhatia H.M., Sharma R.S., Bharucha Z. Anti-Fy b (Duffy) as a cause of transfusion reaction: case report // Indian J. Med. Sci. – 1970. – V. 24. – P. 565–567.
α Baker J.B., Grewar D., Lewis M. et al. Haemolytic disease of the newborn due to anti-Duffy (Fy a) // Arch. Dis. Child. – 1956. – V. 31. – P. 298–299.
α Baldwin M., Shirey R.S., Coyle K. et al. The incidence of anti-Fy a and anti-Fy b antibodies in Black and White patients [Abstract] // Transfusion. – 1986. – V. 26. – P.546.
α Barnwell J.W., Nichols M.E., Rubinstein P. In vitro evaluation of the role of the Duffy blood group in erythrocyte invasion by Plasmodium vivax // J. Exp. Med. – 1989. – V. 169. – P. 1795–1802.
α Beattie K.M. Letter // Immunohematology. – 1984. – V. 1. – P. 14.
α Behzad O., Lee C.L., Gavin J., Marsh W.L. A new antierythrocyte antibody in the Duffy system: anti-Fy4 // Vox Sang. – 1973. – V. 24. – P. 337–342.
α Bony V., Gane P., Bailly P., Cartron J.-P. Time-course expression of polypeptides carrying blood group antigens during human erythroid differentiation // Brit. J. Haemat. – 1999. – V. 107. – P. 263–274.
α Bowen D.T., Devenish A., Dalton J., Hewitt P.E. Delayed haemolytic transfusion reaction due to simultaneous appearance of anti-Fy a and anti-Fy5 // Vox Sang. – 1988. – V. 55. – P. 36–36.
α Boyland I.P., Mufti G.J., Hamblin T.J. Delayed hemolytic transfusion reaction caused by anti-Fy b in splenec tomized patient // Transfusion. – 1982. – V. 22. – P. 402.
α Buchanan D.I., Sinclair M., Sanger R. et al. An Alberta Crew Indian with rare Duffy antibody, anti-Fy3 // Vox Sang. – 1976. – V. 30. – P. 114–121.
α Carreras Vescio L.A., Farina D., Rodigo M., Sola A. Hemolytic disease of the newborn caused by anti-Fy b // Transfusion. – 1987. – V. 27. – P. 366.
α Cedergren B., Giles C.M. An Fy x Fy x individual found in Northern Sweden // Vox Sang. – 1973. – V. 24. – P. 264–266.
α Chan-Shu S.A. The second example of anti-Duffy5 // Transfusion. – 1980. – V. 20. – P. 358–360.
624
с Chaudhuri A., Nielsen S., Elkjaer M.-L. et al. Detection of Duffy antigen in the plasma membranes and caveolae of vascular endothelial and epithelial cells of nonerythroid organs
Blood. – 1997. – V. 89. – P. 701–712.
с Chaudhuri A., Polyakova J., Zbrzezna V. et. al. Cloning of glycoprotein D cDNA, which encodes the major subunit of the Duffy blood group system and the receptor for the Plasmodium vivax malaria parasite // Proc. Nat. Acad. Sci. USA – 1993. – V. 90. – P. 10793–10797.
с Chaudhuri A., Polyakova J., Zbrzezna V., Pogo A.O. The coding sequence of Duffy blood group gene in humans and simians: restriction fragment length polymorphism, antibody and malarial parasite specificities, and expression in nonerythroid tissues in Duffy-negative individuals // Blood. – 1995. – V. 85. – P. 615–621.
с Chaudhuri A., Zbrzezna V., Johnson C. et. al. Purification and characterization of an erythrocyte membrane protein complex carrying Duffy blood group antigenicity: possible receptor for Plasmodium vivax and Plasmodium knowlesi malaria parasite // J. Biol. Chem. – 1989. – V. 264. – P. 13770–13774.
с Chaundhury A., Zbrzezna V., Polyakova J. et al. Expression of the Duffy antigen in K562 cells. Evidence that it is the human erythrocyte chemokine receptor // J. Biol. Chem. – 1994. – V. 269. – P. 7835–7838.
с Chitnis C.E., Chaudhury A., Horuk R. et al. The domain of the Duffy blood group antigen for binding Plasmodium vivax and P. knowlesi malarial parasites to erythrocytes // J. Exp. Med. – 1996. – V. 184. – P. 1531–1536.
с Chitnis C.E., Miller L.H. Identification of the erythrocyte binding domains in Plasmodium vivax and Plasmodium knowlesi proteins involved in erythrocyte invasion // J. Exp. Med. – 1994. – V. 180. – P. 497–506.
с Chown B., Lewis M., Kaita H. Atypical Duffy inheritance in three Caucasian families: a possible relationship to Mongolism // Amer. J. Hum. Genet. – 1965. – V. 17. – P. 188.
с Chown B., Lewis M., Kaita H. The Duffy blood group system in Caucasians: evidence for a new allele // Amer. J. Hum. Genet. – 1965. – V. 17. – P. 384–389.
с Colledge K.I., Pezzulich M., Marsh W.L. et al. Anti-Fy5, an antibody disclosing a probable association between the Rhesus and Duffy genes // Vox Sang. – 1973. – V. 24. – P. 193–199.
с Colligan D.A., Mackie A., Fraser R.H. Production of murine monoclonal anti-Fy b [Abstract]
Transfus. Med. – 2000. – V. 10 (Suppl. 1.). – P.6.
с Contreras M., Gordon H., Tidmarsh E. A proven case of maternal alloimmunization due to Duffy antigens in donor blood used for intrauterine transfusion // Brit. J. Haemat. – 1983. – V. 53. – P. 355–356.
с Cook P.J.L., Page B.M., Johnston A.W. et al. Four further families informative for 1q and the Duffy blood group // Cytogenet. Cell Genet. – 1978. – V. 22. – P. 378–380.
с Cutbush M., Mollison P.L. The Duffy blood group system // Heredity. – 1950. – V. 4. – P. 383–389.
с Cutbush M., Mollison P.L., Parkin D.M. A new human blood group // Nature. – 1950. – V. 165. – P. 188–189.
с Daniels G.L. ed. Third International Workshop on Monoclonal Antibodies Against Human Red Blood Cell and Related Antigens // Transfus. Clin. Biol. – 1997. – V. 4. – P. 99–114 (papers).
с Daniels G.L. Human Blood Groups. – 2-nd ed. – Oxford: Blackwell Science, 2002. – 560 p.
с Daniels G.L., Green C. Expression of red cell surface antigens during erythropoesis // Vox Sang. – 2000. – V. 78 (Suppl. 1). – P. 149–153.
с Darbonne W.C., Rice G.C., Mohler M.A. Red blood cells are a sink for interleukin 8, a leukocyte chemotaxin // J. Clin. Invest. – 1991. – V. 88. – P. 1362–1369.
с Dawson T.C., Lentsch A.B., Wang Z. et al. Exaggerated response to endotoxin in mice lacking the Duffy antigen / receptor for chemokines (DARC) // Blood. – 2000. – V. 96. – P. 1681–1684.
625
с de Winter R.J., Manten A., de Jong Y.P. et al. Interleukin 8 released after acute myocardial infarction is mainly bound to red cells // Heart. – 1997. – V. 78. – P. 598–602.
с Dickstein B., Kosanke J., Morris D. et al. Report of an autoantibody with mimicking all anti-Fy b specificity [Abstract] // Transfusion. – 1998. – V. 38 (Suppl. 1). – 37S.
с DiNapoli J., Garcia A., Marsh W.L., Dreizin D. A second example of anti-Fy5 // Vox Sang. – 1976. – V. 30. – P. 308–311.
с Dunstan R.A. Status of major red cell blood group antigens on neutrophils, lymphocytes and monocytes // Brit. J. Haemat. – 1986. – V. 62. – P. 301–309.
с Dunstan R.A., Simpson M.B., Rosse W.F. Erythrocyte antigens of human platelets: absence of Rh, Duffy, Kell, Kidd and Lutheran antigens // Transfusion. – 1984. – V. 24. – P. 243–246.
с Freisleben F. Fatal hemolytic transfusion reaction due to anti-Fy a (‘Duffy’) // Acta Path. Microbiol. Scand. – 1951. – V. 29. – P. 283–286.
с Gassner C., Kraus R.I., Dovc T. et al. Fy x is associated with two missence point mutations in its gene and can be detected by PCR-SSP // Immunohematology. – 2000. – V. 16. –
61–67.
с Giblett E.R., Hillman R.S., Brooks L.E. Transfusion reaction during marrow suppression in a thalassemic patient with a blood group anomaly and an unusual cold agglutinin // Vox Sang. – 1965. – V. 10. – P. 448–459.
с Goodrick M.J., Hadley A.G., Poole G. Haemolytic disease of the fetus and newborn due to anti-Fy a and the potential clinical value of Duffy genotyping in pregnancies at risk // Transfusion Med. – 1997. – V. 7. – P. 301–304.
с Gover P.A., Morton J.R. Transfusion reaction due to anti-Fy a in donor blood // Clin. Lab. Haematol. – 1990. – V. 12. – P. 233–236.
с Greenwalt T.J., Sasaki T., Gajewski M. Further examples of haemolytic disease of the newborn due to anti-Duffy (Fy a) // Vox Sang. – 1959. – V. 4. – P. 138–143.
с Habibi B., Fouillade M.T., Levanra I. et al. Antigene Fy x: etude quantitative chez les sujets Fy bFy x, Fy aFy x et Fy xFy x provenant de deux nouvelles families // Rev. Franc. Transfus. Immunohemat. – 1977. – V. 20. – P. 427–438.
с Habibi B., Perrier P. Salmon C. HD50 assay evaluation of the antigen Fy3 depression in Fy x individuals // J. Immunogenet. – 1980. – V. 7. – P. 191–193.
с Hadley T.J., David P.H., McGinnis M.H., Muller L.H. Identification of an erythrocyte component carrying the Duffy blood group Fy a antigen // Science. – 1984. – V. 223. –
597–599.
с Hadley T.J., Lu Z., Wasnoiwska K. et al. Postcapillary venule endothelial cells in kidney express a multispecific chemokine receptor that is structurally and functionally identical to the erythroid isoform, which is the Duffy blood group antigen // J. Clin. Invest. – 1994. –
94. – P. 985–991.
с Hadley T.J., Miller L.H., Haynes J.D. Recognition of red cells by malaria parasites: the role of erythrocyte-binding proteins // Transfus. Med. Rev. – 1991. – V. 5. – P. 108–122.
с Hadley T.J., Peiper S.C. From malaria to chemokine receptor: the emerging physiologic role of the Duffy blood group antigen // Blood. – 1997. – V. 89. – P. 3077–3091.
с Halverson G.R., Reid M.E., Yazdanbakhsh K. et al. The first murine monoclonal anti-Fy a produced by a transgenic mouse expressing the human Fy b antigen [Abstract] // Transfusion. – 1999. – V. 39 (Suppl. 1). – 92S.
с Hardman J.T., Beck M.L. Hemagglutination in capillaries: correlation with blood group specificity and IgG subclass // Transfusion. – 1981. – V. 21. – P. 343–346.
с Harris T. Two cases of autoantibodies that demonstrate mimicking specificity in the Duffy blood group system // Immunohematology. – 1990. – V. 6. – P. 87–91.
с Hausman E., Dzik W., Blanchard D. The red cell chemokine receptor is distinct from the Fy6 epitope // Transfusion. – 1996. – V. 36. – P. 421–425.
626
У Haynes J.D., Daltin J.P. , Klotz F.W. et al. Receptor-like specificity of a Plasmodium knowlesi malarial protein that binds to Duffy antigen ligands on erythrocytes // J. Exp. Med. – 1988. – V. 167. – P. 1873–1881.
У Hessner M.J., Pircon R.A., Johnson S.T., Luhm R.A. Prenatal genotyping of the Duffy blood group system by allele-specific polymerase chain reaction // Prenat. Diagn. – 1999. – V. 19. –
41–45.
У Horuk R., Chitnis C.F., Darbonne W.C. et al. A receptor for the malarial parasite Plasmodium vivax: the erythrocyte chemokine receptor // Science. – 1993. – V. 261. – P. 1182–1184.
У Horuk R., Colby T.J., Darbonne W.C. et al. The human erythrocyte inflammatory peptide (chemokine) receptor, biochemical characterization, solubilization, and development of a binding assay for the soluble receptor // Biochemistry. – 1993. – V. 32. – P. 5733–5738.
У Horuk R., Martin A.W., Wang Z. et al. Expression of chemokine receptors by subsets of neurons in the central nervous system // J. Immunol. – 1997. – V. 158. – P. 701–712.
У Ikin E.W., Mourant A.E., Pettenkofer H.J., Blumental G. Discovery of expected haemagglutinin, anti-Fy b // Nature. – 1951. – V. 168. – P. 1077.
У Ikin E.W., Mourant A.E., Plaut G. A second example of the Duffy antibody // Brit. Med.
– 1950. – V. i. – P. 584–585.
в Issitt P.D. Production of anti-Fy a in Black Fy(a −b −) individuals // Immunohematology. – 1984. – V. 1. – P. 11–13.
в Issitt P.D., Anstee D.J. Applied Blood Group Serology. – 4-th ed. – Durham, NC, USA: Montgomery Sc. Publ., 1998. – 1208 p.
в Iwamoto S., Li J., Ikemoto S., Kajii E. Identification of a novel exon and spliced form of Duffy mRNA that is predominant transcript in both erythroid and postcapillary venule endothelium // Blood. – 1996. – V. 87. – P. 378–385.
в Iwamoto S., Li J., Sugimoto N. et al. Characterization of the Duffy gene promoter: evidence for tissue-specific abolishment of expression in Fy(a −b −) of black individuals // Biochem. Biophys. Res. Commun. – 1996. –V. 222. – P. 852–859.
в Iwamoto S., Omi T., Kajii E., Ikemoto S. Genomic organization of the glycoprotein D gene: Duffy blood group Fy a / Fy b alloantigen system is associated with a polymorphism at the 44-amino acid residue // Blood. – 1995. – V. 85. – P. 622–626.
в Jensen N., Crosson J., Grotte D., Anderson D. Severe hemolytic reaction due to anti-Fy3 following partial red cell exchange for sickle cell disease (SCD) [Abstract] // Transfusion. – 1998. – V. 38 (Suppl.). – 8S.
в Ji T.H., Grossman M., Ji I. G protein-coupled receptors. I. Diversity of receptor-ligand interactions // J. Biol. Chem. – 1998. – V. 273. – P. 17299–17302.
в Jilma-Stohlawetz P., Homoncik M., Drucker C. et al. Fy phenotype and gender determine plasma levels for monocyte chemotactic protein // Transfusion. – 2001. – V. 41. – P. 378–381.
в Judson P.A., Anstee D.J. Comparative effect of trypsin and chemotrypsin on the blood group antigens // Med. Lab. Sci. – 1977. – V. 34. – P. 1–6.
в Kim H.H., Park T.S., Oh S.H. et al. Delayed hemolytic transfusion reaction due to anti-Fy b caused by primary immune response: a case study and a review of the literature // Immunohematology. – 2004. – V. 20. – P. 184–186.
в Kosinski K.S., Molthan L., White I. Three examples of anti-Fy3 produced in Negroes // Rev. Franc. Transfus. Immunohemat. – 1984. – V. 27. – P. 619–624.
в Le Van Kim C., Tournamille C., Kroviarski Y. et al. The 1.35-kb and 7.5-kb Duffy mRNA isoforms are differentially regulated in various regions of the brain, differ by the length of their 5 untranslated sequence, but encode the same polypeptide // Blood. – 1997. – V. 90. –
2851–2853.
в Lee J.S., Frevert C.W., Wurfel M.M. et al. Duffy antigen facilitates movement of chemokine cross the endothelium in vitro and promotes neutrophil transmigration in vitro and in vivo
J. Immunol. – 2003. – V. 170. – P. 5244–5251.
627
в Lentsch A.B. The Duffy antigen / receptor for chemokines (DARC) and prostate cancer. A role as clear as black and white? // FASEB J. – 2002. – V. 16. – P. 1093–1095.
в LePennec P.Y., Rouger P., Klein M.T. et al. Study of anti-Fy a in five black Fy(a −b −) patients
Vox Sang. – 1987. – V. 52. – P. 246–249.
в Levine P., Sneath J.S., Robinson E.A., Huntington P.W. A second example of anti-Fy b // Blood. – 1955. – V. 10. – P. 941–944.
в Lewis M., Kaita H., Chown B. The blood groups of a Japanese population // Amer. J. Hum. Genet. – 1957. – V. 9. – P. 274–283.
в Lewis M., Kaita H., Chown B. The Duffy blood group system in Caucasians: a further population sample // Vox Sang. – 1972. – V. 23. – P. 523–527.
в Li J., Iwamoto S., Sugimoto N. et al. Dinucleotide repeat in the 3′ flanking region provides a clue to the molecular evolution of the Duffy gene // Hum. Genet. – 1997. – V. 99. – P. 573–577.
в Libich M., Kout M., Giles C.M. Fy(a −b −) phenotype in Czechoslovakia // Vox Sang. – 1978. – V. 35. – P. 423–425.
в Lu X.-H., Hadley T.J., Xu L. et al. Upregulation of Duffy antigen receptor expression in children with renal disease // Kidney Int. – 1999. – V. 55. – P. 1491–1500.
в Lu Z., Wang Z., Horuk R. et al. The promiscuous chemokine binding profile of the Duffy antigen / receptor for chemokines is primarily localized to sequences in amino-terminal domain // J. Biol. Chem. – 1995. – V. 270. – P. 26239–26245.
в Luo H., Chaudhury A., Johnson K.R. et al. Cloning, characterization, and mapping of murine promiscuous chemokine receptor gene: homolog of the human Duffy gene // Genome Res. – 1997. – V. 7. – P. 932–941.
в Luo H., Chaudhury A., Zbrzezna Yu H., Pogo A.O. Deletion of the murine Duffy gene (Dfy) reveals that the Duffy receptor is functionally redundant // Mol. Cell. – 2000. – V. 20. – P. 3097–3101.
в Mallinson G., Soo K.S., Schall T.J. et al. Mutations in the erythrocyte chemokine receptor (Duffy) gene: the molecular basis of the Fy a / Fy b antigens and identification of a deletion in the Duffy gene of an apparently healthy individual with Fy(a −b −) phenotype // Brit. J. Haemat. – 1995. – V. 90. – P. 823–829.
в Mannessier L., Habibi B., Salmon C. Un novel example anti-Fy3 comportant une reactivite pseudo-anti-Fy a // Rev. Franc. Transfus. Immunohemat. – 1979. – V. 22. – 195–198.
в Marsh W.L. Present status of the Duffy blood group system // CRC Clin. Rev. Clin. Lab. Sci. – 1975. – V. 5. – P. 387–412.
в Mason S.J., Miller L.H., Shiroishi T. et al. The Duffy blood group determinants: their role in susceptibility of human and animal erythrocytes to Plasmodium knowlesi malaria // Br. J. Haematol. – 1977. – V. 36. – P. 327–335.
в Masouredis S.P., Sudora E., Mahan L., Victoria E.J. Quantitative immunoferritin microscopy of Fy a, Fy b, Jk a, U and Di b antigen site numbers on human red cells // Blood. – 1980. – V. 56. – P. 969–977.
в Meredith L.C. Anti-Fy5 does not react with e variants [Abstract] // Transfusion. – 1985. – V. 25. – P. 482.
в Michalewski B. Naturally occurring anti-Fy b + C W // Vox Sang. – 2001. – V. 80. – P. 235.
в Michon P., Wooley I., Wood E.M. et al. Duffy-null promoter heterozygosity reduces DARK expression and abrogates adhesion of P.vivax ligand required for blood-stage infection // FEBS. Lett. – 2001. – V. 495. – P. 111– 114.
в Miller L.H., Aikawa M., Johnson J.G., Shiroishi T. Interaction between cytochalasin B-treated malarial parasites and erythrocyte: attachment and junction formation // J. Exp. Med. – 1979. – V. 149. – P. 172–184.
в Miller L.H., Haynes J.D., McAuliffe F.M. et al. Evidence for differences in erythrocyte surface receptors for the malarial parasites, Plasmodium falciparum and Plasmodium vivax
J. Exp. Med. – 1977. – V. 149. – P. 277–281.
628
С Miller L.H., Mason S.J., Clyde D.F., McGinnis M. The resistance factor to Plasmodium vivax in Blacks: the Duffy blood group genotype, FyFy // N. Eng. J. Med. – 1976. – V. 295. –
302–304.
С Miller L.H., Mason S.J., Dvorak J.A. et al. Erythrocyte receptors for (Plasmodium knowlesi) malaria: Duffy blood group determinants // Science. – 1975. – V. 189. – P. 561–563.
С Miller L.H., McAuliffe F.M., Mason S.J. Erythrocyte receptors for malaria merozoites // Amer. J. Trop. Med. Hyg. – 1977. – V. 26(6). – P. 204–208.
С Mollison P., Cutbush M. Use of isotope-labelled red cells to demonstrate incompatibility in vivo // Lancet. – 1955. – V. i. – P. 1290–1295.
С Mollison P.L., Engelfriet P., Contreras M. Blood Transfusion in Clinical Medicine. –10-th ed. – Oxford: BSP, 1997. – 1033 p.
С Molthan L., Crawford M.N. Anti-Fy3: second example in a Black [Abstract] // Transfusion. – 1978. – V. 18. – P. 386.
С Moore S., Woodrow C.F., McClelland D.B.L. Isolation of membrane components associated with human red cell antigens Rh(D), (с), (E) and Fy a // Nature. – 1982. –
295. – P. 529–531.
в Morton J.A. Some observations on the action of blood-group antibodies on red cells treated with proteolytic enzymes // Brit. J. Haemat. – 1962. – V. 8. – P. 134–148.
в Moulds J.M., Hayes S., Wells T.D. DNA analysis of Duffy genes in American Blacks // Transfusion. – 1998. – V. 38. – P. 248–252.
в Mourant A.E., Kopec A.C., Domaniewska-Sobczak K. The Distribution of Human Blood Groups and Other Polymorphisms. – 2-nd. ed. – London: Oxford University Press, 1976.
в Mullighan C.G., Marshall S.E., Fanning G.C. et al. Rapid haplotyping of mutations in the Duffy gene using the polymerase chain reaction and sequence-specific primers // Tissue Antigens. –1998. – V. 51. – P. 195–199.
в Murdoch C., Finn A. Chemokine receptors and their role in inflammation and infectious diseases // Blood. – 2000. – V. 95. – P. 3032–3043.
в Murphy M.T., Templeton L.J., Fleming J. et al. Comparison of Fy b status as determined serologically and genetically // Transfus. Med. – 1997. – V. 7. – P. 135–141.
в Neote K., Darbonne W.C., Ogez J. et al. Identification of promiscuous inflammatory peptide receptor on the surface of red blood cells // J. Biol. Chem. – 1993. – V. 268. –
m 12247–12449.
в Neote K., Mak J.Y., Kolakowski L.F., Schall T.J. Functional and biochemical analysis of the Duffy antigen: identity with the red blood cell chemokine receptor // Blood. – 1994. – V. 84. –
m 44–52.
в Nichols M.E., Rubinstein P., Barnwell J. et al. A new human Duffy blood group specificity defined by a murine monoclonal antibody. Immunogenetics and association with susceptibility to Plasmodium vivax // J. Exp. Med. – 1987. – V. 166. – P. 776–785.
в Oakes J., Taylor D., Johnson C., Marsh W.L. Fy3 antigenicity of blood of newborn // Transfusion. – 1978. – V. 18. – P. 127–128.
в Oberdorfer C.E., Kahn B., Moore V. et al. A second example of anti-Fy3 in the Duffy blood group system // Transfusion. – 1974. – V. 14. – P. 608–611.
в Olsson M.L., Hansson C., Avent N.D. et al. A clinically applicable method for determining the three major alleles at Duffy (FY) blood group locus using polymerase chain reaction with allele-specific primers // Transfusion. – 1998. – V. 48. – P. 168–173.
в Olsson M.L., Smythe J.S., Hansson C. et al. The Fy x phenotype is associated with a missence mutation in the Fy b allele predicting Arg89Cys in the Duffy glycoprotein // Brit.
Haemat. – 1998. – V. 103. – P. 1184–1191.
В Olteanu T., Gerber D., Patridge H., Sarode R. Acute hemolytic transfusion reaction secondary to anti-FY3 // Immunohematology. – 2005. – V. 21. – P.48–53.
629
с Palatnik M., Rowe A.W. Duffy and Duffy-related human antigens in primates // J. Hum. Evol. – 1984. – V. 13. – P. 173–179.
с Parasol N., Reid M., Rios M. et al. A novel mutation in the coding sequence of the FY*B allele of the Duffy chemokine receptor gene is associated with an altered erythrocyte phenotype // Blood. – 1998. – V. 92. – P. 2237–2243.
с Peiper S.C., Wang Z., Neote K. et al. The Duffy antigen / receptor for chemokines (DARC) is expressed in endothelial cells of Duffy-negative individuals who lack the erythrocyte receptor // J. Exp. Med. – 1995. –V. 181. – P. 1311–1317.
с Pineda A.A., Taswell H.F., Brzica S.M. Delayed hemolytic transfusion reaction: an immunologic hazard of blood transfusion // Transfusion. – 1978. – V. 18. – P. 1–7.
с Pisacka M., Vytiskova J., Latinakova A. et al. Molecular background of the Fy(a −b −) phenotype in gypsy population living in the Czech and Slovak Republics [Abstract] // Transfusion. – 2001. – V. 41 (Suppl). – 15S.
с Pogo A.O., Chaudhury A. The Duffy protein: a malarial and chemokine receptor // Semin. Hemat. – 2000. – V. 37. – P. 122–129.
с Race R.R., Sanger R. Blood Groups in Man. – 6-th ed. – Oxford: BSP, 1975. – 659 p.
с Race R.R., Sanger R., Lehane D. Quantitative aspects of the blood group antigen Fy a // Ann. Eugen. – 1953. – V. 17. – P. 255–266.
с Reid M.E., Lomas-Francis C. The Blood Group Antigen: FactsBook. – 2-nd ed. – London: Academic Press, 2004. – 561 p.
с Rios M., Chaudhuri A., Mallinson G. et al. New genotypes in Fy(a −) individuals: nonsense mutation (Trp to stop) in coding sequence of either FY A of FY B // Brit. J. Haemat. – 2000. – V. 108. – P. 448–454.
с Riwom S., Janvier D., Navenot J.M. et al. Production of a new murine monoclonal antibody. With anti-Fy6 specificity and characterization of the immunopurified N-glycosylated Duffy-active molecule // Vox Sang. – 1994. – V. 66. – P. 61–67.
с Rollins B.J. Chemokines // Blood. – 1997. – V. 90. – P. 909–928.
с Rosenfield R.E., Vogel P., Race R.R. Un nouveau cas d’ anti-Fy a dans un serum humain // Rev. Hemat. – 1950. – V. 5. – P. 315–317.
с Sandler S.G., Mallory D., Wolfe J.S. et al. Screening with monoclonal anti-Fy3 provide blood for phenotype-matched transfusions for patients with sickle cell disease // Transfusion. – 1997. – V. 37. – P. 393–397.
с Sanger R., Race R.R., Jack J. The Duffy blood groups of New York Negroes: the phenotype Fy(a −b −) // Brit. J. Haemat. – 1955. – V. 1. – P. 370–374.
с Segerer S., Bohmig G.A., Exner M. et al. When renal allografts turn DARC // Transplantation. – 2003. – V. 75. – P. 1030–1034.
с Segerer S., Cui Y., Either F. et al. Expression of chemokines and chemokine receptors during human renal transplant rejection // Amer. J. Kidney Dis. – 2001. – V. 37. – P. 518–531.
с Shah V.P., Gilja B.K. Hemolytic disease of the newborn due to anti-Duffy (Fy a) // N.Y. St.
В Med. – 1983. – V. 83. – P. 244–245.
с Shimizu Y., Hiroko A., Soemantri A. et al. Sero- and molecular typing of Duffy blood group in Southeast Asians and Oceanians // Hum. Biol. – 2000. – V. 72. – P. 511–518.
с Singh S., Pandey K., Chattopadhayay R. et al. Biochemical, biophysical and functional characterization of bacterially expressed and refolded receptor binding domain of Plasmodium vivax Duffy-binding protein // J. Biol. Chem. – 2001. – V. 276. – P. 17111– 17116.
с Sosler S.D., Perkins J.T., Fong K., Saporito C. The prevalence of immunization to Duffy antigens in a population of known racial distribution // Transfusion. – 1989. – V. 29. –
505–507.
и Southcott M.J.G., Tanner M.J.A., Anstee D.J. The expression of human blood group antigens during erythropoesis in a cell culture system // Blood. – 1999. – V. 93. – P. 4425–4435.
630
В Spencer H.C., Miller L.H., Collins W.E. et al. The Duffy blood group and resistance to Plasmodium vivax in Honduras // Am. J. Trop. Med. Hyg. – 1978. – V. 27. – P. 664–670.
В Szabo M.C., Soo K.S., Zlotnik A., Schall T.J. Chemokine class differences in binding to the Duffy antigen-erythrocyte chemokine receptor // J. Biol. Chem. – 1995. – V. 270. –
25348–25351.
В Szymanski I.O., Huff S.R., Delsignore L. An autoanalyzer test to determine immunoglobulin class and IgG subclass of blood group antibodies // Transfusion. – 1982. – V. 22. – P. 90–95.
В Tamasauskas D., Powell V., Saksela K., Yazdanbakhsh K. A homologous naturally occurring mutation in Duffy and CCR5 leading to reducer receptor expression // Blood. – 2001. –
О 97. – P. 3651–3654.
У Tanner M.J.A., Anstee D.J., Mallinson G. et al. Effect of endoglycosidase F-Peptidyl N-glycosidase F preparations on the surface components of the human erythrocyte // Carbohydr. Res. – 1988. – V. 173. – P. 203–212.
У Tippett P., Gavin J. Duffy groups and malaria in monkeys [Abstract] // Transfusion. – 1979. – V. 19. – P. 662.
У Toivanen P., Hirvonen T. Antigens Duffy, Kell, Kidd, Lutheran and Xg a on fetal red cells // Vox Sang. – 1973. – V. 24. – P. 372–376.
У Toivanen P., Hirvonen T. Fetal development of red cell antigens K, k, Lu a, Lu b, Fy a, Fy b, Vel and Xg a // Scand. J. Haematol. – 1969. – V. 6. – P. 49–55.
У Tournamille C., Colin Y., Cartron J.-P., Le Van Kim C. Disruption of a GATA motif in the Duffy gene promoter abolishes erythroid gene expression in Duffy-negative individuals // Nature Genet. – 1995. – V. 10. – P. 224–228.
У Tournamille C., Filipe A., Wasniowska K. et al. Structure-function analysis of the extracellular domains of Duffy antigen / receptor for chemokines: characterization of antibody and chemokine binding sites // Brit. J. Haemat. – 2003. – V. 122. – P. 1014–1023.
У Tournamille C., Le Van Kim C., Gane P. et al. Arg89Cys substitution results in very low membrane expression of the Duffy antigen / receptor for chemokines in Fy x individuals // Blood. – 1998. – V. 92. – P. 2147–2152.
У Tournamille C., Le Van Kim C., Gane P. et al. Close association of the first and fourth extracellular domains of the Duffy antigen / receptor for chemokines by a disulphide bond is required for ligand binding // J. Biol. Chem. – 1997. – V. 272. – P. 16274–16280.
У Tournamille C., Le Van Kim C., Gane P., Cartron J.-P. Molecular basis and PCR-DNA typing of Fy a / Fy b blood group polymorphism // Hum. Genet. – 1995. – V. 95. – P. 407–410.
У Tsuneyama H., Uchikawa M., Shinozaki K. et al. A deletion in the Duffy gene of an apparently healthy individual with Fy(a −b −) phenotype [Abstract] // Transfusion. – 2000. – V. 40 (Suppl.). – 116S.
У van Loghem J.J., van der Hart M. Een nieuwe bloed-groep // Ned. Tijdschr. Geneeskd. – 1950. – V. 94. – P. 748–749.
У van’t Veer M.B., van Leeuwen I., Haas F.J.L.M. et al. Red-cell auto-antibodies mimicking anti-Fy b specificity // Vox sang. – 1984. – V. 46. – P. 88–91.
У Vengelen-Tyler V. Anti-Fy a preceding anti-Fy3 or –Fy5: a study of five cases [Abstract] // Transfusion. – 1985. – V. 25. – P. 482.
У Vetter O., Wegner H. A further case of anti-Fy b and the frequency of Duffy-antigens in the population of the city of Leipzig // Acta Genet. – 1967. – V. 17. – P. 338–340.
У Wasniowska K., Blanchard D., Janvier D. et al. Identification of the Fy6 epitope recognized by two monoclonal antibodies in the N-terminal extracellular portion of the Duffy antigen receptor for chemockines // Mol. Immunol. – 1996. – V. 33. – P. 917–923.
У Wasniowska K., Czerwinski M., Jachymek W., Lisowska E. Expression and binding properties of a soluble chimeric protein containing the N-terminal domain of the Duffy antigen // Biochem. Biophys. Res. Commun. – 2000. – V. 273. – P. 705–711.
631
с Wasniowska K., Eichenberg P., Kugele F., Hadley T.J. Purification of a 28 kD non-aggregating tryptic peptide of the Duffy blood group protein // Biochem. Biophys. Res. Commun. – 1993. – V. 192. – P. 366–372.
с Wasniowska K., Lisowska E., Halverson G.R. et al. The Fy a, Fy6 and Fy3 epitopes of the Duffy blood group system recognized by a new monoclonal antibodies: identification of a linear Fy3 epitope // Brit. J. Haemat. – 2004. – V. 124. – P. 118–122.
с Wasniowska K., Petit-Leroux Y., Tournamille C. et al. Structural characterization of the epitope recognized by the new anti-Fy6 monoclonal antibody NaM 185-2C3 // Transfus. Med. – 2002. – V. 12. – P. 205–211.
с Weistein L., Taylor E.S. Hemolytic disease of the neonate secondary to anti-Fy a // Amer. J. Obstet. Gynec. – 1975. – V. 121. – P. 643–645.
с Welch S.G., McGregor I.A., Williams K. The Duffy blood group and malaria prevalence in Gambian West Africans // Trans. R. Soc. Trop. Med. Hyg. – 1977. – V. 71. – P. 295–296.
с Wernheimer S.P., Barnwell J.W. Plasmodium vivax interaction with the human Duffy blood group glycoprotein: identification of a parasite receptor-like proteins // Exp. Parasitol. – 1989. – V. 69. – P. 340–350.
с Westhoff C.M., Reid M.E. The Kell, Duffy, and Kidd blood group systems // Immunohematology. – 2004. – V. 20. – P. 37–49.
с Williams D., Johnson C.L., Marsh W.L. Duffy antigen changes on red blood cells stored at low temperature // Transfusion. – 1981. – V. 21. – P. 357–359.
с Williams T.N., Maitland K., Bennett S. et al. High incidence of malaria in aWoolley I.J., Hotmire K.A., Sramkoski R.M. et al. Differential expression of the Duffy antigen receptor for chemokines according to RBC age and FY genotype // Transfusion. – 2000. – V. 40. –
В 949–953.
с Woolley I.J., Hotmire K.A., Sramkoski R.M. et al. Differential expression of the Duffy antigen receptor for chemokines according to RBC age and FY genotype // Transfusion. – 2000. – V. 40. – P. 949–953.
с Woolley I.J., Wood E.M., Sramkovski P.A. et al. Expression of Duffy antigen receptor for chemokines during reticulocyte maturation: using a CD71 flow cytometric technique to identify reticulocytes // Immunohematology. – 2005. – V. 21. – P. 15–20.
с Yazdanbakhsh K., Rios M., Storry J. et al. Molecular mechanisms that lead to reduced expression of Duffy antigens // Transfusion. – 2000. – V. 40. – P. 310–320.
с Zimmerman P.A., Wooley I., Masinde G.L. et al. Emergence of FY*A null in a Plasmodium vivax endemic region of Papua New Guinea // Proc. Nat. Acad. Sci. USA. – 1996. – V. 96. –
В 13973–13977.
632
Глава 11.
Система Kidd
Антигены системы Kidd (Кидд) – Jk a и Jk b – являются продуктами аллель-ных генов. Антигенные различия Jk a / Jk b обусловлены заменой Asp 280 Asn. Распределение их у представителей разных рас неодинаково. Антитела против антигенов Kidd представляют опасность в клиническом плане, поскольку вызы-вают замедленные посттрансфузионные реакции.
Антигены Kidd расположены на гликопротеине, имеющем 10 трансмембранных доменов (рис. 11.1). Определена его аминокислотная последовательность (рис. 11.2).
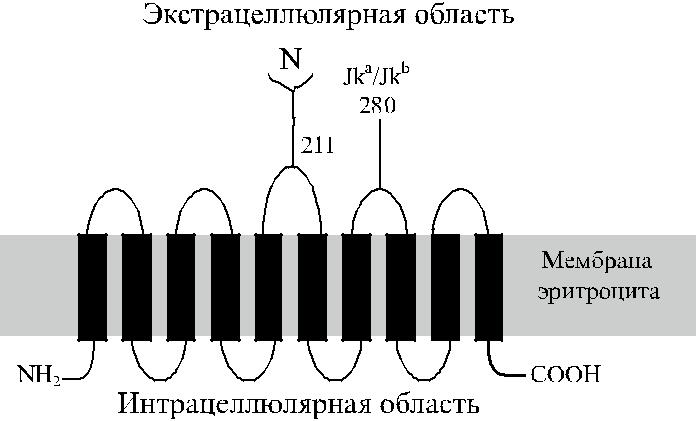
Рис. 11.1. Строение гликопротеина Kidd: 10 трансмем-бранных доменов, N- и C-цитоплазматические доме-ны, N-гликан на третьей экстрацеллюлярной петле, на
четвертой петле указана позиция 280, определяющая различие Jk a и Jk b.
| MEDSPTMVRV | DSPTMVRGEN | QVSPCQGRRC | FPKALGYVTG | DMKKLANQLK | 50 |
| DKPVVLQFID | WILRGISQVV | FVNNPVSGIL | ILVGLLVQNP | WWALTGWLGT | 100 |
| VVSTLMALLL | SQDRSLIASG | LYGYNATLVG | VLMAVFSDKG | DYFWWLLLPV | 150 |
| CAMSMTCPIF | SSALNSMLSK | WDLPVFTLPF | NMALSMYLSA | TGHYNPFFPA | 200 |
| KLVIPITTAP | NISWSDLSAL | ELLKSIPVGV | GQIYGCDNPW | TGGIFLGALL | 250 |
| LSSPLMCLHA | AIGSLLGIAA | GLSLSAPFED | IYFGLWGFNS | SLACIAMGGM | 300 |
| FMALTWQTHL | LALGCALFTA | YLGVGMANFM | AEGVLPACTW | PFCLATLLFL | 350 |
| IMTTKNSNIY | KMPLSKVTYP | EENRIFYLQA | KKRMVESPL | 389 |
Рис. 11.2. Последовательность аминокислот гликопротеина Kidd.
системе Kidd известен нулевой фенотип Jk(a −b −), который чаще встречает-ся у жителей Полинезии. На эритроцитах Jk(a −b −) отсутствуют антигены Jk a и Jk b,
и также антиген Jk3 (Jk ab). Идентифицировано 5 мутаций, инактивирующих ген JK.
633
Гликопротеин Kidd выполняет в клетке функцию транспортера мочевины.
Генный локус JK (SLC14A1) картирован на хромосоме 18 в позиции 18q11–q12.
Гликопротеин JK и ген JK
Задолго до выделения гликопротеина Kidd, картирования и клонирования гена JK было известно, что эритроциты, лишенные антигенов Kidd [Jk(a −b −)], не лизируются в 2М растворе мочевины, а эритроциты, содержащие антигены Kidd, лизируются указанным раствором. Уже тогда возникло предположение, что антигены Kidd участвуют в транспорте мочевины.
Используя нейлоновые мембраны с фиксированными к ним аффинно-очищенными IgG-антителами анти-Jk a, анти-Jk b и анти-Jk3, Sinor и соавт. [96] выделили из оболочки эритроцитов субстрат с мол. массой 45 кДа, несущий Jk-антигенную активность. Иммунопреципитат, выделенный с помощью анти-тел анти-Jk3 из эритроцитов всех фенотипов Kidd, за исключением Jk(a −b −), представлял собой гликопротеин с мол. массой 46–60 кДа. После удаления N-гликана из гликопептида обработкой его N-гликаназой мол. масса уменьши-лась до 36 кДа (Olives и соавт. [70]).
Электронная микроскопия эритроцитов, обработанных антителами IgG анти-Jk b, меченными ферритином, позволила установить, что эритроциты Jk(a −b + ) не-сут около 14 тыс. антигенных участков Jk b на 1 клетку (Masouredis и соавт. [53]).
Mannuzzu и соавт. [50] с помощью гидрофобных соединений ртути ингибировали транспорт мочевины и нашли, что количество участков, транспортирующих мочеви-ну, т. е. участков, несущих антигены Jk, составляет около 32 тыс. на 1 эритроцит.
Olives и соавт. [72] исследовали кДНК эритробластов человека с помощью ПЦР с праймерами, сконструированными по аминокислотной последователь-ности кроличьего транспортера мочевины. Иммунопреципитацией антителами анти-Jk3 авторы выделили полипептид с мол. массой 36 кДа.
Методом иммуноблоттинга с кроличьими антителами был получен полипеп-тид с мол. массой 46–60 кДа, который присутствовал в эритроцитах всех фено-типов Kidd, кроме Jk(a −b −) (Olives и соавт. [70]). Позднее было установлено, что ген HUT11 представляет собой аберрантный транскрипт или является арте-фактом клонирования (Sidoux-Walter и соавт. [93]). Другой ген – HUT11А, коди-рующий глютаминовую кислоту вместо лизина в положении 44 и 2 дипептида – валин и глицин – вместо 3 после позиции 227, производит гликопротеин Kidd и транспортер мочевины эритроцитов (Sidoux-Walter и соавт. [93], Irshaid и соавт. [37]). Продукт этого гена имеет мол. массу 43 кДа, содержит 389 аминокислот и на 63 % идентичен кроличьему транспортеру мочевины. Протеин содержит 10 трансмембранных доменов. Один из двух N-гликозилированных участков (Asn
19. расположен на третьем экстрацеллюлярном домене.
Ген JK (SLC14A1) имеет величину 30 кб и состоит из 11 экзонов (Lucien
В соавт. [48], Irshaid и соавт. [36]). Экзоны 1–3 и часть четвертого (табл. 11.1) представляют нетранслируемый 3ʹ регион, экзоны 4–11 кодируют протеин.
634
Участок, инициирующий трансляцию, расположен на 335 пар выше стартового транслируемого кодона в экзоне 4. Область между нуклеотидами −837 и −336 содержит эритроидоспецифические участки транскрипции GATA-1 и SP1,
с также TATA-бокс и инвертированный CAAT-бокс (Lucien и соавт. [48]). Идентифицированы 2 эритроидных транскрипта величиной 4,4 и 2 кб. Последний (меньший из них) образуется за счет пропуска в считывании экзона 3 (Lucien и
соавт. [48]).
| Таблица 11.1 | ||||||
| Организация гена JK | ||||||
|
|
| |||||
| Экзон | Количество пар | Позиция | Размер интрона, кб | |||
| оснований | кодируемых аминокислот | * | ** | |||
| 1 | 93 | 0,7 | ||||
| 2 | 64 | 2,4 | ||||
| 3 | 157 | 3,1 | ||||
| 4 | 172 | 1–50 | 0,6 | 0,543 | ||
| 5 | 190 | 51–113 | 3,55 | 3,0 | ||
| 6 | 129 | 114–156 | 1,9 | 2,0 | ||
| 7 | 193 | 157–221 | 2,5 | 2,5 | ||
| 8 | 148 | 222–270 | 0,27 | 0,217 | ||
| 9 | 135 | 271–315 | 8,6 | 9,0 | ||
| 10 | 50 | 316–332 | 1,4 | 1,4 | ||
| 11 | 551 | 333–389 | ||||
иПо Lucien и соавт. [48], **по Irshaid и соавт. [36].
Антигены Jk a и Jk b
Антиген Jk a, обнаруженый в 1951 г. Allen и соавт. [3], назван по инициалам 6-го ребенка американской белой женщины, миссис Kidd, родившегося с про-явлениями гемолитической болезни. Антитела анти-Jk a реагировали с эритро-цитами 77 % жителей г. Бостона (США).
Двумя годами позже (в Англии) Plaut и соавт. [78] нашли антитетичный ан-тиген – Jk b.
Среди европеоидов 76,4 % содержали антиген Jk a, 23,6 % – не содержали (Race, Sanger [82]). Эти данные позволили рассчитать частоту генов Jk a и Jk b (0,5142 и 0,4858), а также частоту генотипов Jk a / Jk a , Jk a / Jk b и Jk b / Jk b (0,2644; 0,4996 и 0,2360 соответственно). Указанные расчетные данные практически не отличались от фактических, полученных при обследовании 1051 канадской семьи сыворотками анти-Jk a и анти-Jk b: ген Jk a имел частоту 0,5162; Jk b – 0,4838 (Chown и соавт. [7], Race и Sanger [82]).
По результатам ДНК-типирования 106 шведов, частота генов Jk a и Jk b со-ставила 0,53 и 0,47 соответственно (Irshaid и соавт. [35]).
Mourant и соавт. [62], Tills и соавт. [102] суммировали результаты популя-ционных исследований, выполненных различными авторами (табл. 11.2).
635
Ген Jk a имеет частоту около 50 % среди жителей Европы, его частота выше (около 75 %) среди населения некоторых областей Африки и существенно ниже (20–30 %) в Азии (китайцы, японцы).
Гены Jk a и Jk b передаются по наследству кодоминантно. При обследова-нии более чем 2000 семей европеоидов установлено, что ожидаемая и факти-ческая частота фенотипов совпадает (Race и Sanger [82]). Существование ред-кого молчащего аллеля Jk не оказывало влияния на результаты исследования.
Таблица 11.2
Дата: 2019-02-24, просмотров: 344.