Статус самостоятельной групповой системы получили антигены, располагающи-еся на Rh-ассоциированном гликопротеине (RhAG). Ранее RhAG числился в системе резус как Rh50, но вскоре стало известно, что синтез указанного гликопротеина нахо-дится под контролем гена, расположенного на 6-й хромосоме независимо от локуса RH, располагающегося на 1-й хромосоме (Daniels [1]). Система включает 3 антигена: 2 часто встречающихся (Duclos и DSLK) и 1 редко встречающийся – Ol a.
Антиген Duclos описан Habibi и соавт. в 1978 г. [2]. Вначале он был включен
в систему резус под номером Rh38, однако позднее было установлено, что этот антиген является продуктом гена, независимого от локуса RH.
Антиген Ol a (от фамилии семьи Oldeide), обнаруженный Kornstad [3] у нор-вежцев, также был отнесен с системе резус, поскольку был ассоциирован со
339
слабой экспрессией антигенов С, с, Е и е, однако было показано, что он не явля-ется частью системы Rh.
Проведено секвенирование ДНК Duclos-отрицательного, DSLK-отрицательного и 2 Ol a-положительных лиц.
Рекомбинантные протеины удалось экспрессировать в клетках линии HEK
293. Ранее на этих клетках был экспрессирован мутантный RhAG с аминокис-лотной заменой Gln 106 Glu , который не реагировал с антителами анти-Duclos. Duclos-отрицательный и DSLK-отрицательный доноры оказались гомозиготны-ми по мутациям Gln 106 Glu и Lys 164 Gln соответственно. Антиген, откры-ваемый антителами анти-DSLK, напоминал антиген Duclos, поэтому получил свое обозначение в виде аббревиатуры DSLK (Duclos-like – Даклос-подобный). Анти-DSLK-антитела, так же как и анти-Duclos-антитела, давали отрицатель-ные реакции с эритроцитами RhnullU–, но реагировали с эритроцитами RhnullU +. Однако анти-DSLK-антитела образовались у Duclos-положительного лица, поэ-тому не могли быть идентичны анти-Duclos-антителам (Tsuneyama и соавт. [6]).
Два члена норвежской семьи Олдейд, имевшие фенотип Ol(a + ), оказались гетерозиготными по мутации Ser 227 Leu. Один индивид японского происхо-ждения с фенотипом Rhmod был гомозиготным по этой мутации, и его эритроци-
ты также были Ol(a + ) (Tsuneyama и соавт. [6]).
Синтез всех трех антигенов (Duclos, DSLK и Ol a) контролируется одним и тем же геном RHAG, который находится на хромосоме 6 в позиции 6p11-21.1. В номен-клатуре ISBT антигены Duclos, Ol a и DSLK получили обозначения 030001, 030002
и 030003 (RHAG1, RHAG2 и RHAG3) соответственно (Tilley и соавт. [4, 5]).
Список литературы
1. Daniels G.L. Human Blood Groups. – 2-nd ed. – Oxford: Blackwell Science, 2002. – 560 p.
2. Habibi B., Fouillade M.T., Duedary N. et al. The antigen Duclos: a new high frequency red cell antigen, related to Rh and U // Vox Sang. – 1978. – V. 34. – P. 302–309.
3. Kornstad L. A rare blood group antigen, Ol a (Oldeide), associated with weak Rh antigens // Vox Sang. – 1986. – V. 50. – P. 235–239.
4. Tilley L., Gaskell A., Poole J., Daniels G. Duclos-negative and susbstitutions in external loops of the Rh-associated glycoprotein // Vox Sang. – 2008. – V. 95 (Suppl.). – 37 (Abstract).
5. Tilley L., Green C., Poole J. et al. A new blood group system, RHAG: three antigens resulting from amino acid substitutions in the Rh-associated glycoprotein // Vox Sang. – 2010. – V. 98. – P. 151–159.
6. Tsuneyama H., Osagawara K., Uchikawa M. et al. Identification of two new mutations in the RhAG gene of Japanese with Rhmod phenotype // Trasfusion. – 2008. – V. 48 (Suppl.). – P. 185A −186A.
340
Глава 5.
Система Kell
Антигены системы Kell (Келл) (табл. 5.1) разделяют на 4 группы.
1-я группа – 11 антигенов, объединенных в 5 подгрупп: K и k; Kp a, Kp b и Kp c; Js a и Js b; K11 (Cote) и K17 (Wk a); K14 (San) и K24 (Cls). Аллельная взаи-мосвязь генов внутри подгрупп четко установлена.
2-я группа – 7 часто встречающихся антигенов: K12 (Boc), K13, L18,
K19 (Sub), K22, TOU и RAZ, не имеющих антитетичных партнеров.
3-я группа – 3 редко встречающихся антигена: Ul a, K23 и VLAN, молекуляр-ная основа которых расшифрована и представляет собой простые аминокислот-ные замены.
4-я группа – 3 часто встречающихся антигена: Ku, k-like и Km. Молекулярная основа этих антигенов не ясна. Для того чтобы установить аминокислотную по-следовательность, обусловливающую их специфичность, необходимо срав-нить два Kell-полипептида: содержащий и не содержащий указанные антигены. Однако лица, лишенные этих антигенов, практически не встречаются.
Kell-фенотип зависит от двух различных генных локусов. Синтез антигенно-го вещества Kell осуществляет локус KEL, который расположен на хромосоме
7. Экспрессию антигенов Kell контролирует другой локус – XK, находящийся на Х-хромосоме. Ген XK продуцирует Kx-протеин, который является подложкой и одновременно составной частью Kell-гликопротеина (рис. 5.1).
Локус KEL в отличие от локусов D и CE системы резус более компактен. Кроссинговер в нем не наблюдается, генные конверсии редки. Один гаплотип KEL продуцирует несколько часто встречающихся (общих для всех людей) Kell-антигенов, но не более одного редко встречающегося.
Антигены Kell расположены на Kell-гликопротеине (трансмембран-ном гликопротеине CD238), имеющем мол. массу 93 кДа. Основная часть Kell-антигенов размещается в экстрацеллюлярной части Kell-гликопротеина (см. рис. 5.1), что, по-видимому, и делает его столь иммуногенным.
Гликопротеины Kell относятся к цинксодержащим металлопротеинам. Они обладают свойствами эндопептидаз и имеют некоторое сходство с так называе-мым общим антигеном острого лимфобластного лейкоза.
Молекулярный субстрат большинства Kell-антигенов известен. Их серологи-ческий полиморфизм обусловлен простыми аминокислотными заменами в Kell-гликопротеине (см. табл. 5.1).
Система Kell тесно связана с двумя другими независимыми системами – Kx
341
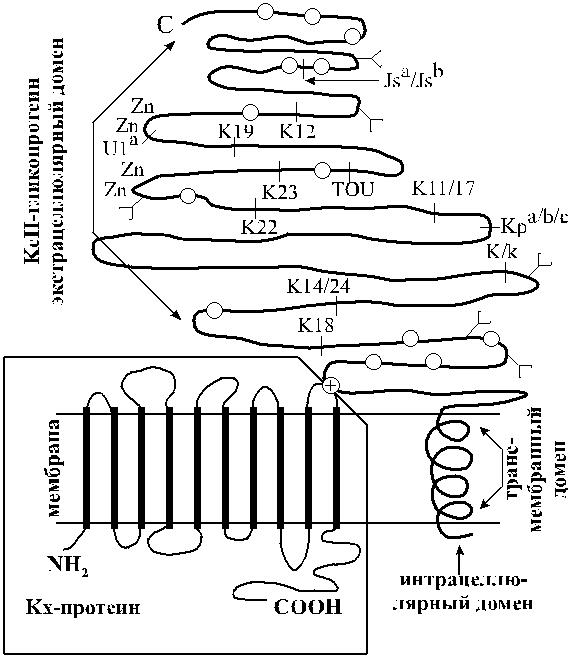
Рис. 5.1. Архитектоника Kell-гликопротеина и Kx-протеина (гипотетическая схема по Ho и соавт. [198] и др. авторам).
О – цистеиновые остатки,
 – цистеиновый остаток – место соединения Kell-гликопротеина и Kx-протеина,
– цистеиновый остаток – место соединения Kell-гликопротеина и Kx-протеина,
 – участки присоединения N-гликанов (гликозилирования),
– участки присоединения N-гликанов (гликозилирования),
| – позиции аминокислотных замен, определяющие специфичность антигенов Kell, Zn – цинксвязывающие участки.
и Gerbich. От последних зависит степень выраженности антигенов Kell на по-верхности клетки.
Описаны редкие фенотипы, в которых большинство Kell-антигенов сла-бо выражены или отсутствуют (фенотипы McLeod, Kmod, транзиторный K + или K −, Ko). Исключение представляет антиген Ku, который присутствует на всех эритроцитах, в том числе на Kell-дефицитных и Ko.
Отсутствие Kell-антигенов и ослабленная их экспрессия могут быть обу-словлены несколькими причинами: 1 – гомозиготностью по молчащему гену KEL-локуса; 2 – эпистатическим подавлением KEL-локуса – эпистазией генов Gerbich; 3 – блокадой антигенных участков Kell-гликопротеина аутоантитела-ми (транзиторный K −) или бактериальной модификацией (транзиторный K + ); 4 – нарушением синтеза Kx-протеина и другими, не вполне ясными причина-ми. Дефицитные Kell-фенотипы передаются по наследству (Kmod, McLeod), но, по-видимому, могут формироваться и как следствие соматических мутаций.
Наибольшей иммуногенностью обладает фактор K (синонимы: Kell, KEL1,
K1). Его определение регламентировано нормативными документами [54, 55] и является функциональной обязанностью иммуносерологов службы крови.
Антигены Kell представляют также интерес для антропологов [13] и судеб-ных медиков [3].
342
| Таблица 5.1 | |||||||
Антигены системы KEL
Обозначение
Karhula
Ul a
KEL10
Val 494 Glu
1968 [169]
у финнов 2,6
Santini
San
KEL14
> 99,9
1973 [195]
Pro / His / Cys
343
| Окончание табл. 5.1 | |||||||
|
| |||||||
| Обозначение | Частота среди | Молекулярная | Год открытия | ||||
| авторское | традиционное | ISBT | европеоидов, % | основа | [источник] | ||
| KTIM | KEL 30 | 2006 [*] | |||||
| KYO | KEL31 | 2006 [*] | |||||
| KUCI | KEL32 | > 99,9 | 2007 [*] | ||||
| KANT | KEL33 | > 99,9 | 2007 [*] | ||||
| KASH | KEL34 | > 99,9 | 2007 [*] | ||||
| Ko (null) | 1957 [125] | ||||||
| McLeod | Очень редко | 1961 [86] | |||||
| KEL- | Leach | 1985 [204] | |||||
| Mullins | 1988 [308] | ||||||
| дефицитные | |||||||
| фенотипы | Allen | 1993 [147] | |||||
| Kmod | 1995 [322] | ||||||
| Транзиторный | Редко | K − стали K + | [278] | ||||
| K +/K − | K + стали K − | [344, 380, 397] | |||||
* Kell-антигены, исключенные из системы Kell, ** Антигены пара-KEL,
[*] См. гл. 37 раздел «Системы Kell и Kx».
Номенклатура
До 1961 г. было принято буквенное обозначение антигенов Kell: K, k, Kр а, Kр b, Js а и т. д. В 1961 г. Allen и Rosenfield [89] предложили буквенно-цифровое обозначение: K1 (K), K2 (k), K3 (Kр а), K4 (Kp b) и т. д., которое было положено в основу международной классификации.
В соответствии с рекомендациями номенклатурного комитета Международного общества трансфузиологов – International Society of Blood Transfision (ISBT) с 1985 г. для обозначения указанной системы принят символ KEL.
По классификации ISBT каждой системе антигенов эритроцитов присво-ен трехзначный код, каждому антигену – трехзначный номер, например: си-
стеме АВО – 001, антигену А – 001001, В – 001002, MNSs – 002, Rh-Hr – 004, Lutheran – 005 и далее в хронологическом порядке их открытия. Системе анти-генов KEL присвоен код 006. Антиген K обозначается как 006001, антиген k – 006002, антигены Пенни и Раутенберг соответственно 006003 и 006004 и т. д.
В повседневной практической работе чаще используют буквенное (K, k, Kp a, Kp b) или буквенно-цифровое (K1, K2, K3, K4) обозначение (см. табл. 5.1).
Некоторые антигены после уточнения переведены в другие антигенные си-стемы. Так, антигены K w, KL, Kx, причисленные сначала к системе KEL, из нее выведены, поскольку относятся к другим антигенным системам.
344
По правилам ISBT при перемещении антигена из одной системы в другую или исключении из номенклатуры его порядковый номер остается свободным и не используется для обозначения каких-либо других антигенов. В связи с этим в номенклатуре системы KEL имеются пропуски – номера 008, 009, 015, первона-чально присвоенные антигенам K w, KL и Kx соответственно.
Аргументы в пользу шестизначного обозначения ISBT, пригодного для ком-пьютерной обработки, неоспоримы, однако традиционное обозначение более удобно и информативно для большинства иммуносерологов. Антитетическая связь между антигенами более наглядна при обозначении K и k, Kp a и Kp b, Js a и Js b, чем K1 и K2, K3 и K4, K6 и K7.
K и k
В 1945 г., вскоре после открытия резус-фактора, англичане Coombs, Mourant
и Race [132] разработали антиглобулиновую пробу, получившую название про-бы Кумбса. Фактор Kell (K) был одним из первых антигенов, открытых с помо-щью этого метода.
Анализируя причину желтухи у новорожденного одной из родильниц (мис-
сис Kelleher), Coombs, Mourant и Race [133] обнаружили необычные анти-
тела, которые нельзя было отнести к системе резус. Сыворотка крови г-жи Kelleher реагировала с эритроцитами мужа и ребенка, а также эритроцитами примерно 7 % произвольно взятых лиц независимо от их групповой- и резус-принадлежности. Новый фактор эритроцитов получил название Kell (K) – по фамилии носительницы антител.
Позднее антитела такой же специфичности выявили Wiener, Sonn-Gordon [396] в сыворотке крови больных, перенесших гемотрансфузионные осложнения.
В настоящее время обнаружение анти-K-антител не является редкостью. Антиген K – сильный иммуноген, и даже одна трансфузия эритроцитов, одна беременность или один аборт могут вызвать аллоиммунизацию [7, 21, 79]. По иммуногенности фактор K стоит на втором месте после D. Частота анти-Kell-антител среди аллоиммунизированных составляет более 5 %, что еще раз под-черкивает значение фактора K в трансфузиологии и необходимость типирова-ния доноров и реципиентов по этому антигену [20, 21, 23, 24].
Спустя 3 года после открытия Kell-фактора Levin и соавт. [249] обнаружили антитела, агглютинирующие эритроциты 99,8 % лиц, и установили антитетич-ную связь определяемого с их помощью антигена с антигеном Kell. Второй ан-тиген был назван Cellano (k) (в русской транскрипции Челлано) также по фами-лии женщины, в крови которой были выявлены антитела. Аллельность генов K
и k подтверждена популяционными и посемейными исследованиями [250, 251, 318, 339]: K и k являются продуктом кодоминантных аллелей. Лица, не содер-жащие антигена K, всегда содержат k и, наоборот, лица, не имеющие k, содер-жат K. Оба антигена могут присутствовать на эритроцитах вместе – фенотип Kk. Отсутствие обоих антигенов (фенотип Ko) встречается редко и, как правило,
345
сочетается с патологией (см. K o). Как указано выше, антиген K имеет обозначе-ние ISBT KEL1, антиген k обозначают как KEL2.
Kp a и Kр b
Третий антиген системы Kell, Пенни (Penney), получивший обозначение Kp a, описали в 1957 г. Allen и Lewis [87]. Те же авторы совместно с Fudenberg [88] обнаружили аллельный фактор Раутенберг (Rautenberg), обозначенный соответ-ственно Kр b.
Открытие антигенов Kp a и Kp b изменило представление о том, что Kell яв-ляется простой диаллельной системой, включающей только 2 антигена, K и k,
а представляет собой полиаллельную систему. Антигену Kp a присвоено обозна-
чение ISBT KEL3, антигену Kр b – KEL4.
Гены Kp a и Kp b имеют своеобразное сцепление с генами k и K. Они переда-ются по наследству в виде одного из трех комплексов: kKp a, kKp b или KKp b, но не KKp a [141, 154, 252, 318, 402]. Комплекс KKp a формируется при наследова-нии гена K от одного родителя, а гена Kp a – от другого. Иными словами, фено-тип K + Kp(a + ) соответствует положению генов K транс Kp a. Одновременная передача потомству K и Kp a от одного родителя (K цис Kp a) до настоящего вре-мени не выявлена, несмотря на большое количество обследованных семей. Таким образом, антиген K наследуется всегда с антигеном Kp b (K цис Kp b), а ан-тиген Kp a – всегда с антигеном k (Kp a цис k).
Ген Kp a подавляет активность других генов KEL, расположенных в позиции цис (см. Kp a -эффект).
Частота антигена Kp а составляет 2,3 %, антигена Kр b – 99,9 % [55, 87, 141, 318] (см. табл. 5.1, 5.7, 5.8).
Антиген Kр b, по-видимому, более иммуногенен, чем Kp a. Об этом свиде-тельствует следующий расчет: на 0,1 % реципиентов Kp(b −) приходится 99,9 %
доноров Kp(b + ), а на 2,3 % реципиентов Kp(a −) – 97,7 % доноров Kp(a + ).
Вероятность аллоиммунизации реципиента (или беременной) антигеном Kp a в 23 раза выше, чем антигеном Kp b. В то же время антитела анти-Kp a встречаются не намного чаще, чем анти-Kp b.
Kр c
Антиген Kp c впервые был описан в 1945–1946 гг. Callender, Race и Paykoc [117, 118] в одной английской семье. В то время этот антиген именовали Levay
в соответствии с сывороткой анти-Levay, с помощью которой он был обнару-жен. Только 34 года спустя, в 1979 г., Yamaguchi с соавт. [403] и Gavin с соавт. [173] установили, что антиген Levay и антиген Kp c представляют собой иден-тичную специфичность. Авторы нашли донора, японку, эритроциты которой Kp(a −b −) реагировали с сывороткой, содержащей анти-Levay-антитела, т. е. были Kp(a −b −c + ). При исследовании семьи пробанда ими было установлено, что антиген Levay (Kp c) относится к системе Kell и является продуктом гена Kp c, третьего аллеля сублокуса Kp.
346
Антиген Kp c относят к редким – его частота составляет 0,23 % [225] (см. табл. 5.1). Единичные гомозиготы Kp c / Kp c, описанные Daniels [57] среди японцев, были выявлены в результате идентификации анти-Kp b-антител, содержащихся
в их сыворотках.
Kikuchi и соавт. [225] нашли 2 членов одной японской семьи, которые имели фенотип Kp(a −b −с + ) и являлись гомозиготными по гену Kp c и гену K o.
Антиген Kp c (Levay) был обнаружен, как указывалось выше, среди англичан [117, 118] и у 1 испано-американца Kp(a +b −c + ), имевшего анти-Kp b-антитела.
Lee и соавт. [241] установили, что специфичность антигенов Kp a, Kp b и Kp c обусловлена простыми нуклеотидными заменами в кодоне 281 экзона 8 (см. табл. 5.1). Антиген Kp a инициирован триплетом TGG, кодирующим трипто-фан. Триплет CGG, кодирует аргинин, что соответствует антигену Kp b. Триплет CAG, кодирующий глютамин, обусловливает специфичность Kp c.
В экспериментах с сайтнаправленным мутагенезом Yazdanbakhsh и соавт.
[404] подтвердили, что отличие Kp a и Kp b обусловлено именно указанной заме-
ной – Trp 281 Arg.
Мутации Kp a и Kp c являются весьма информативными и могут быть исполь-зованы при генотипировании с помощью ПЦР [150, 241].
Js a и Js b
Антиген Sutter (Саттер) – Js а, описали в 1958 г. Giblett [175] и годом позже Giblett и Chase [176] у американских негров, проживающих в Сиэтле (США). Антитела анти-Js a авторы обнаружили у белого американца (мистера Sutter), по-лучившего переливание эритроцитов, как теперь очевидно, от донора негра.
Антиген Js a практически не встречается у европейцев – все они, за крайне редким исключением, Js a-отрицательные (Mourant и соавт. [290]). Антиген Js a был обнаружен лишь у одного белого европейца [318] и в одной арабской се-мье, живущей в Израиле (Levene и соавт. [246]). У японцев антиген Js a не най-ден (Ito и соавт. [209]). Носителями антигена Js а являются исключительно не-гры, среди которых около 16 % имеют группу Js(a + ) [176, 212, 352].
Через 5 лет после открытия антигена Js a Walker и соавт. [386, 387] обнаружи-ли антитетичный антиген Js b, который оказался в противоположность антигену Js a часто встречающимся и присутствовал на эритроцитах большинства доно-ров, как негров, так и белых. Антитела анти-Js b были найдены авторами в сыво-ротке негритянской женщины, по-видимому, гомозиготной по Js a (Js а / Js а), по-скольку она была Js(a + ); 4 ее детей, 2 сестры и 10 их детей также были Js(a + ). При исследовании сыворотки женщины с эритроцитами 1269 доноров негров Walker и соавт. [387] нашли 13 образцов, давших отрицательный результат. Исследование этих 13 образцов сывороткой анти-Js a показало, что 12 из них со-держат антиген Js а. Иными словами, почти все лица Js(b −) оказались Js(a + ), что указывало на аллельные отношения генов Js a и Js b.
Из 10 848 американских негров, тестированных Beattie и соавт. [100] с
347
помощью сыворотки анти-Js b, только 34 (0,31 %) были Js(b −). Лиц с фенотипом Js(а +b −) среди европеоидов и монголоидов не обнаружено.
Первое время после открытия антигена Js а, а затем Js b считали, что они пред-ставляют собой новую систему, независимую от ранее открытых. Установлено, что антигены Js а и Js b не связаны с системой АВО, Rh-Hr, Р, Lutheran и др. Недоказанной оставалась лишь возможная связь Js а и Js b с системой Kell. Трудность заключалась в том, что антиген Js а в сочетании с антигеном K встре-чается крайне редко (Js а практически отсутствует у белых, K редко выявляли у негров,) и проследить характер их наследования на примере одной семьи дли-тельное время не представлялось возможным.
Первые данные о том, что Js a и Js b могут относиться к системе Kell, получи-ли Stroup и соавт. [357]. Авторы показали, что клетки Ko, лишенные антигенов K и k, не содержат также Js а и Js b, т. е. являются Js(a −b −). Далее было установ-лено, что фенотип McLeod и другие Kell-дефицитные фенотипы наряду с пода-вленной продукцией антигенов Kell характеризуются слабой экспрессией анти-генов Js а и Js b, что также послужило основанием считать гены Js а и Js b частью локуса KEL.
Обследование около 4000 доноров негров позволило выявить 6 человек с ред-ким фенотипом K + Js(a + ), а последующие семейные исследования подтвердили, что антигены Js a и Js b контролируются локусом KEL (Morton и соавт. [288]).
Принадлежность к той или иной группе по антигенам Js обусловлена 2 ну-клеотидными заменами в экзоне 17 локуса KEL, кодирующими соответствую-щую аминокислотную последовательность.
По данным Lee и соавт. [240], антиген Js a ассоциирован с замещением
С 1910, кодирующим Pro в позиции 597 и замещением G 2019, кодирующим Leu в позиции 633; антиген Js b ассоциирован с замещением T 1910, кодирую-щим Leu в позиции 633.
Yazdanbakhsh и соавт. [404], используя сайтнаправленный мутагенез, под-твердили, что Js a / Js b-полиморфизм обусловлен заменой С 1910 Т.
Антиген Js а получил индекс ISBT KEL6, антиген Js b – KEL7.
K11 и K17 (Cote и Wk a )
Cote (K11)
Guevin и соавт. [186] в 1971 г. и затем в 1976 г. [185] исследовали сыворот-ку крови француженки из Канады миссис Cote. Сыворотка реагировала с эри-троцитами всех фенотипов, за исключением собственных эритроцитов женщи-ны и 2 из 8 ее сибсов. Тот факт, что антитела Cote-сыворотки, как обозначили ее авторы, не взаимодействовали с эритроцитами Ko, указывал на принадлежность выявляемого с их помощью антигена к системе Kell. Эритроциты фенотипа McLeod, на которых очень слабо экспрессированы антигены системы Kell, визу-ально не реагировали с сывороткой Cote, однако были способны адсорбировать эти антитела. Антиген, определяемый сывороткой Cote, получил обозначение
348
K11 и был причислен к категории пара-Kell-антигенов. Лица, не имеющие ан-тигена K11 (фенотип K: −11), встречаются редко. В период открытия и изуче-ния этого антигена, до начала 1980-х годов, было описано всего лишь несколько случаев [185, 195, 223, 318, 335].
Wk a (K17)
Антиген Wk a получил свое название по фамилии донора (г-на Weeks), кровь которого была перелита больному и послужила причиной появления антител, обозначенных анти-Wk a. Антиген Wk a встречается редко. По данным Strange и соавт. [356], из 11 076 доноров Оксфорда и Бристоля только 32 человека имели этот антиген. Авторы обратили внимание на определенную связь антигена Wk a
с системой Kell, в частности они отметили, что антиген Wk a чаще встречается в комбинации с антигеном k, чем K. Так, в упомянутой рандомизированной вы-борке из 11 076 доноров частота Wk(a + ) составила 0,3 %. В то же время среди 6956 специально отобранных лиц с фенотипом K +k + частота лиц Wk(a + ) со-ставила 0,1 % (7 человек), что, несомненно, свидетельствует о частичном сце-плении генов Wk a и k. Соотношения генов K, Wk a и k напоминают соотноше-ние генов K, Ul a и k. В последнем случае ген Ul a подобно гену Wk a чаще на-следуется в комбинации с геном k, чем с K. По-видимому, существует не иссле-дованное еще явление более частого сочетания широко распространенных ге-нов по сравнению с сочетанием редких генов. Эти различия могут проявлять-ся при сравнении относительных показателей частоты сочетания генов, напри-мер при сравнении частоты лиц K + Wk(a + ) и K −Wk(a + ) с частотой распреде-ления антигенов K, Wk a и k в популяции. Уместно отметить, что среди пример-но 1000 доноров с эритроцитами Kp(a + ) не было обнаружено ни одного че-ловека Wk(a + ), что является дополнительным свидетельством связи антигена Wk a с системой Kell.
Окончательное заключение о том, что антиген Wk a принадлежит системе Kell, Strange и соавт. [356] сделали благодаря обследованию членов семей 5 из 7 упомянутых выше лиц K + Wk(a + ). Оказалось, что Wk a всегда передавался по наследству с k и авторы не наблюдали иных рекомбинаций. Таким образом, список редких Kell-антигенов был пополнен еще одним антигеном (Wk a), полу-чившим номер K17.
Аллельная связь Wk a и Cote
Некоторое время антиген Cote, обнаруженный Guevin и соавт. [185], и ан-тиген Wk a, описанный Strange и соавт. [356], считались независимыми друг от друга. Антигену Cote, как упоминалось выше, был присвоен номер K11, анти-гену Wk a – K17, в порядке их регистрации. После того как были найдены лица
с фенотипом Wk(a −)Cote + и, наоборот, Wk(a + )Cote −, стало ясно, что указан-ные антигены являются антитетичными и контролируются четвертой парой аллельных генов системы Kell – Wk a и Wk b [335, 356] (если ген Cote имено-вать как Wk b). Антиген Wk b (K11) встречается почти у 100 % людей, антиген
349
Wk a (K17) – примерно у 0,3 %, поэтому фенотип Wk(a +b −) представляет со-бой чрезвычайную редкость.
K11 и K17 различаются одной нуклеотидной заменой (T → C) в экзоне 8 гена KEL. Т 1025 кодирует Val в позиции 302 – K11; C 1025 – Arg в позиции 302 – K17 (Lee и соавт. [241]). Эта мутация создает дополнительный MscI-участок ре-стрикции в аллеле K17.
K14 и K24
В 1973 г. Heisto и соавт. [195] и затем в 1976 г. Wallace и соавт. [388] описали часто встречающийся антиген, который получил обозначение K14, поскольку, как показали авторы, имел отношение к системе Kell. Антитела анти-K14 были обнаружены в сыворотке крови жительницы местечка Каюн (штат Луизиана, США), имевшей 7 беременностей, трансфузий не было. Четвертая и пятая бе-ременности закончились искусственным прерыванием, шестая и седьмая – рож-дением живых доношенных детей. Оба новорожденных имели положительную прямую пробу Кумбса, вызванную K14-антителами. У последнего новорожден-ного наблюдали анемию и гипербилирубинемию, однако обменного перелива-ния крови не потребовалось. Родители женщины имели фенотип K: −14 и, как указали авторы, не являлись кровными родственниками.
Второй образец анти-K14-антител обнаружили Frank и соавт. [166]. Первоначально эти антитела были названы анти-Dp, но вскоре Sabo и соавт. [336] показали, что анти-Dp и анти-K14 представляют собой одну и ту же специфичность. Женщина, у которой нашли анти-Dp (=K14)-антитела, была жительницей местечка Байу (того же штата). Она также имела беременности (гемотрансфузий не было), однако в отличие от первого пробанда ее родители были двоюродными братом и сестрой. Поскольку женщинам с анти-K14-антителами не производили трансфузий, авторы не могли сделать какого-либо заключения относительно значения этих антител в клинике.
Антиген K24 (Cls), антитетичный антигену K14, обнаружили в 1985 г. Eicher
и соавт. [160]. Антитела к этому редкому антигену найдены у белой женщи-ны, жительницы Нового Орлеана (все тот же штат Луизиана). При исследова-нии ее сыворотки с 60 образцами стандартных эритроцитов, содержащих раз-личные редко встречающиеся антигены Kell, авторы нашли единственный обра-зец, с которым она дала положительную реакцию. Этот образец был K14 −. Два других образца эритроцитов K14 −, взятые для дополнительного исследования, также агглютинировались этой сывороткой. Таким образом, эксперименты убе-дительно показали, что эритроциты, не содержащие антигена K14, содержат ан-тиген K24, иными словами, K14 и K24 представляют собой пару антитетичных антигенов.
Далее Eicher и соавт. [160] нашли, что антигену K24 свойствен эффект дозы, в частности титр анти-K24-антител с эритроцитами K14 −K24 + (K24 / K24) су-щественно превышал результаты титрования этих антител с эритроцитами
K14 + K24 + (K14 / K24).
350
Молекулярно-биологические исследования Lee и соавт. [234] подтвердили, что K14 и K24 являются аллелями (см. Молекулярная основа антигенов Kell).
Получены мышиные моноклональные IgG анти-K14-антитела [144, 297].
Дата: 2019-02-24, просмотров: 362.