56. 1990-х годах 2 лаборатории независимо друг от друга получили совершен-но одинаковые клоны кДНК полипептидов RhcЕ (Cherif-Zahar и соавт. [208], Avent и соавт. [148]).
Выделение кДНК, соответствующей полипептиду D, было осуществлено не-зависимо 3 исследовательскими группами (Le Van Kim и соавт. [418], Arce и со-авт. [138], Kajii и соавт. [390]). Последовательность аминокислот в белках, по-лученных при помощи кДНК RhD, отличалась от аминокислотной последова-тельности полипептида RhсЕ по 34–36 аминокислотным остаткам из 417 после-довательностей (рис. 4.7).
179
| D | MSSKYPRSVR | RCLPLWALTL | ||||||||
| cE | 50 | - - - - - - - - - - | - - - - - - - - - - | |||||||
| D | EAALILLFYF | FTHYDASLED | QKGLVASYQV | GQDLTVMAAI | GLGFLTSSFR | |||||
| cE | - - - - - - | - - - - | - - - - - - - - - - | - - - - - - - - - - | - - - - - - - - - L | - - - - | - - - N- - | |||
| 100 | ||||||||||
| D | RHSWSSVAFN | LFMLALGVQW | AILLDGFLSQ | FPSGKVVITL | FSIRLATMSA | |||||
| cE | - - - - - - | - - - - | - - - - - - - - - - | - - - - - - - - - - | - - P- - - - - - - | - - - - - - - - - - | ||||
| 150 | ||||||||||
| D | LSVLISVDAV | LGKVNLAQLV | VMVLVEVTAL | GNLRMVISNI | FNTDYHMNMM | |||||
| cE | M - - - - - | AG- - | - - - - - - - - - - | - - - - - - - - - - | - T - - - - - - - - | - - - - - - - - LR | ||||
| 200 | ||||||||||
| D | HIYVFAAYFG | LSVAWCLPKP | LPEGTEDKDQ | TATIPSLSAM | LGALFLWIFW | |||||
| cE | -F - - - - | - - - - | -T - - - - | - - - - | - - K - - - - | N - - | R - - - - - - - - - | - - - - - - - M - - | ||
| 250 | ||||||||||
| D | PSFNSALLRS | PIERKNAVFN | TYYALVVSVV | TAISGSSLAH | PQGKISKTYV | |||||
| cE | - - V- - P | - - - - | - -Q- - - - | M - - | - - - - - A - | -300-- | - - - - - - - - - - | - - R | - - -M - - - | |
| D | HSAVLAGGVA | VGTSCHLIPS | PWLAMVLGLV | AGLISVGGAK | YLPGCCNRVL | |||||
| cE | - - - - - - | - - - - | - - - - - - - - - - | - - - - - - - - - - | - - - - -I - - - - | C - - | V - - - - - - | |||
| 350 | ||||||||||
| D | GIPRSSIMGY | NFSLLGLLGE | IIYIVLLVLD | TVGAGNGMIG | FQVLLSIGEL | |||||
| cE | - -R - I -V- HS | I - - - - - | - - - - | -T - - - - - | - - R | - - WN - - - - - - | - - - - - - - - - - | |||
| 400 | 417 | |||||||||
| D | SLAIVIALTS | GLLTGLLLNL | KIWKAPHEAK | YFDDQVFWKF | PHLAVGF | |||||
| cE | - - - - - - | - - - - | - - - - - - - - - - | - - - - - - - V - - | - - - - - - - - - - | - - - - - - - | ||||
Рис. 4.7. Аминокислотная последовательность транскриптов гена D и cE по Mouro и соавт. [496] и Schenkel-Brunner [597]. Пунктир означает одинаковую аминокислотную последовательность сравниваемых полипептидов.
Полипептиды D и сЕ имеют высокую степень гомологии: клон полипепти-да D, выделенный Arce и соавт. [138], был на 96 % идентичен клону полипепти-да сЕ по последовательности нуклеотидов кДНК и на 92 % идентичен по струк-туре белка.
Le Van Kim и соавт. [418] показали, что полученные ими клоны кДНК явля-ются продуктом гена D, поскольку фрагменты геномной ДНК, с которыми со-впадали эти клоны, были получены от людей с фенотипом D +.
В то же время Kajii и соавт. [390] установили, что полученные ими клоны не были продуктом гена D, поскольку кДНК была идентифицирована у человека с фенотипом D −C +c + E +e + [390, 665, 666].
Данные о том, что у некоторых людей фенотип D − обусловлен делецией гена D, были получены Colin и соавт. [233] в экспериментах с использованием мето-да Саузерн-блот.
Клонирование Rh-гликопротеинов
Moore и Green [481] обнаружили, что в процессе иммунной преципита-ции полипептидов D и сЕ специфическими антителами одновременно с по липептидами преципитируются N-гликозилированные белки, получившие на-
звание RhAG (Rh-ассоциированные гликопротеины), или Rh-гликопротеины. Компоненты этих белков, сопровождающие полипептиды D и еС, имели не-
сколько отличающуюся мол. массу, но одинаковую N-концевую аминокислот-ную последовательность [147].
180
Ridgwell и соавт. [565] клонировали фрагменты кДНК, соответствующие
Rh-связанному гликопротеину, и выделили кДНК полной длины из библио-теки кДНК костного мозга человека. Полученный Rh-гликопротеин содер-жал 409 аминокислот и имел, подобно полипептидам Rh, 12 мембранных до-менов с внутриклеточными N- и С-концевыми участками. Аминокислотная
последовательность Rh-гликопротеина и Rh-полипептида различалась. Сходство ограничивалось двумя аминокислотными остатками в первом и пя-том домене: Glu 13 и Glu 146 – в гликопротеине Rh, Glu 21 и Glu 146 – в по-липептиде Rh [565].
Структура генов RH
1972 г. Ruddle и соавт. [587] удалось определить, что генный локус систе-мы резус расположен на хромосоме 1. Затем он был картирован на коротком плече хромосомы в участке 1p34.3–p36.13 [211, 453, 462].
Когда была получена кДНК, соответствующая Rh-полипептидам, ее можно было использовать в качестве зонда в Саузерн-блоте для исследования геном-ной ДНК, т. е. определения структуры генов RH.
Результаты этих исследований подтвердили, что локус RH включает 2 очень похожих гена (СЕ и D), а один из этих генов отсутствует в гДНК, выделенной у нескольких неродственных лиц D − [233]. Таким образом была установлена мо-лекулярная основа общего для европеоидов фенотипа Rh −, который часто обу-словлен делецией гена D.
Ген D включает 10 экзонов и имеет организацию, похожую на структуру гена СЕ, но не идентичную ей (см. рис. 4.7).
Гены D и CE различаются по интрону 4 [138]. В гене СЕ имеется деле-ция 650 пар нуклеотидов, начинающаяся в интроне 4 от нуклеотида 181 [146]. Интрон 4 гена СЕ имеет 1976 пар нуклеотидов. Нуклеотиды в положении 1–181
831–1076 примерно идентичны в генах D и СЕ. Интрон 5 генов D и СЕ вклю-чает 1636 пар нуклеотидов. Имеется 29 нуклеотидных различий между этими двумя генами (98,2 % гомологии).
Организация гена СЕ исследована Cherif-Zahar и соавт. [209]. В связи с тем что антиген D обусловлен геном, отсутствующим у людей Rh −, определение молекулярной структуры антигенов Сс и Ее упростилось.
Mouro и соавт. [496] экстрагировали матричную РНК людей с редким фе-нотипом СсЕе и использовали синтетические олигонуклеотидные праймеры в присутствии обратной транскриптазы для получения кДНК полной длины, со-ответствующей продукту гена СЕ.
Присутствие антигенов Е и е было обусловлено заменой пролина на аланин
с позиции 226. Пролин в этой позиции придавал субстрату специфичность Е, аланин – специфичность е (см. рис. 4.5).
При сравнении кДНК лиц, содержащих антигены C и c, ситуация ока-залась сложнее. Наблюдали 6 различий в нуклеотидах, одна часть из кото-
181
рых (Cys 16, Ile 60, Ser 68, Ser 103) коррелировала с экспрессией C, другая (Trp 16, Leu 60, Asn 68, Pro 103) – с экспрессией с (hr') [496]. Эта находка была подтверждена амплификацией гДНК от людей с известным фенотипом: экзон 1 и 2 кодировал остатки, специфичные для антигенов Сс, а экзон 5 – специфичные для антигенов Ее.
Cherif-Zahar и соавт. [208] высказали предположение, что, хотя антигены Сс
В Ее являются продуктами одного и того же гена и кодированы одним видом мРНК, возможен альтернативный сплайсинг, формирующий несколько белков. Полипептид полной длины кодирует экспрессию антигенов Ее, а не Сс; сплай-сеоформа, в которой отсутствует экзон 5, кодирует экспрессию Сс, но не Ее. Гипотеза подтверждается тем фактом, что из препаратов мРНК людей Rh − мо-гут быть выделены разные продукты гена СЕ.
По мнению Umenishi и соавт. [666], сплайсеоформы не являются произво-дными гена СЕ; они могут также происходить от гена D. Некоторые сплайсео-формы выделены из незрелых эритробластов.
О экспериментах Smythe и соавт. [618] антигены с и Е были получены de novo на поверхности эритроидных клеток K562, в которые был введен ретро-вирус, комбинированный с кДНК, соответствующей сЕ-экспрессии. Поскольку использованная кДНК была полной длины, это отчетливо подтвердило, что ан-тигены с и Е находятся на одном и том же полипептиде.
Аминокислотная замена, определяющая Е- и е-специфичность [Pro 226 (ан-тиген Е), Ala 226 (антиген е)], находится в четвертой внеклеточной петле по-липептида СЕ. Эта локализация полностью соответствует серологическим раз-личиям антигенов Е и е. Однако антигенные различия обусловлены не толь-ко аминокислотной заменой, но и соответствующим молекулярным окружени-ем. Полипептид D также имеет остаток аланина в положении 226, но не несет е-антигенности.
Структура антигенов С и с сложнее, потому что полипептиды СЕ имеют 4 аминокислоты для антигена С и 4 – для антигена с, одна из которых [Ser 103 (антиген С) или Pro 103 (антиген с)] расположена на второй внеклеточной пет-ле полипептида.
Три из четырех аминокислот (Ile 60, Ser 68, Ser 103), которые отличают С-активный полипептид от с-активного, обнаружены также в D-полипептиде. Эти 3 аминокислоты кодируются экзоном 2 гена СЕ и экзоном 2 гена D. Не исключено, что именно благодаря этому подобию антигенов D и C антитела анти-D могут содержать анти-С-специфичность даже в тех случаях, когда эри-троциты, послужившие антигенным стимулом, не имели серологически выяв-ляемого антигена С, т. е. это был «чистый D». Во многом идентичная топология полипептидов, кодируемых генами D и CE, лежит в основе перекрестных реак-ций антигенов и антител системы резус.
Считается, что гены RH синтезируют полипептиды, несущие Rh-антигены, не используя субстанций-предшественников.
182
Антиген D и его варианты
Антиген D (резус-антиген, резус-фактор, стандартный резус-антиген) после групповых антигенов А и В имеет наибольшее значение в трансфузиологии и акушерстве. Он присутствует у лиц с генотипом D / D и D / d. Как и другие Rh-антигены, антиген D содержится в мембране эритроцитов. Со слюной он не вы-деляется и в других жидкостях и тканях организма не представлен. Лица, не со-держащие антигена D, естественных антител против него, подобных групповым изогемагглютининам, не имеют.
Формирование эпитопов D кодируется экзонами 4 и 5 гена RHD. Avent и со-авт. [143], Huang [355] считают, что конверсия генов в этих экзонах обусловли-вает крайне низкую экспрессию D-антигена.
большинства людей D − имеется полная делеция гена RHD [138, 233, 368, 418, 616]. Соответствующего генетического эквивалента в виде d / d у них не найдено.
В редких случаях у людей D − наблюдали частичную делецию гена RHD [146, 368, 512], особенно среди лиц с фенотипом Cde, cdE, имевших экзоны RHD-гена, которые не были функциональными.
Описаны лица D– с генотипом Cde / Cde, имеющие практически сохранен-ный RHD-ген [137, 146]. У одного из этих лиц (рис. 4.8, строка Rо Har) полно-мерный ген RHD имел одну точку мутации С → Т в нуклеотиде 121, превра-щающую кодон глицина 41 в стоп-кодон [146]. Три другие мутации были об-наружены в RHD-транскриптах этого пробанда: в кодоне 215 – ТТС → СТС
(Phe → Leu), в кодоне 216 – TTG → CTG (Leu → Leu) и в кодоне 330 – TAC → CAC (Tyr → His).
другого человека было выпадение 4 нуклеотидов в секторе экзона 4 [137], что, как полагают авторы, могло привести к повреждению считывания нормаль-ного гена, в результате чего ген не проявлял себя фенотипически.
Иммунодоминантные протеины D + и D − отличаются 36 аминокислотными заменами, из которых 8 расположены на внеклеточных гидрофильных петлях протеина в позиции 169, 170, 172, 233, 238, 350, 353, 354. Эти замены с их моле-
кулярным окружением, по-видимому, и являются D-несущими детерминантами, способными связываться с анти-D-антителами.
Green [319], Le Van Kim и соавт. [418], Schmitz и соавт. [600] полагали, что экспрессию антигенов D, C и с обусловливает цистеиновый остаток, располо-женный экзофациально в позиции 285.
Suyama и соавт. [646] не разделяли эту точку зрения, предположив, что Cys 285 не является определяющим в экспрессии антигена D.
Smythe и соавт. [618] применили трансфекцию генов RH в клетки K562, что-бы экспрессировать антигены Rh. В некоторые клетки К562 вводили мутантный ген D, кодирующий в позиции 285 аланин вместо цистеина. Трансфектные клет-ки экспрессировали одно и то же количество D-антигена независимо от того, что кодировала вживляемая кДНК в позиции 285 – цистеин или аланин.
183









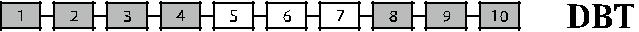
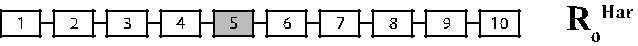
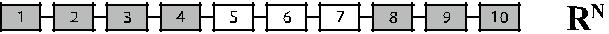





Рис. 4.8. Гибридные гены парциальных антигенов D. Темные прямоугольники – экзоны гена RHD, светлые прямоугольники – экзоны гена RHCE. Бук-вами справа обозначен антигенный комплекс, коди-руемый данным геном.
Экспрессия антигена D
Выраженность антигена D на эритроцитах не является константной величи-ной и меняется в широких пределах: от очень сильной до очень слабой, с тру-дом выявляемой. Во многом она зависит от сочетания факторов Rh, имеющих-ся у человека.
Считается, что отсутствие одних антигенов Rh сопровождается повышен-ным синтезом других, чтобы обеспечить формирование полноценной клеточ-ной мембраны. Так, в отсутствие полипептидов, несущих антигены Сс, ген RHD производит дополнительное число полипептидов D, восполняя таким обра-зом нехватку структурных элементов в мембране клетки. Высказывалось пред-положение, что сильный D-антиген на таких клетках обусловлен отсутствием конкуренции генов Сс и Ее в освоении общей для них и гена D субстанции-предшественника. При делеции гена D компенсаторную функцию берут на себя гены RHCE, нарабатывая большее, чем обычно, количество СЕ-полипептидов.
184
Имеются и другие предположения относительно неодинаковой экспрес-сии антигена D у разных индивидов, например CDe и cDE. В частности, по-липептиды Се и се, переплетающиеся в оболочке эритроцита с полипептида-ми D, затрудняют доступ анти-D-антител к участкам D-антигена, в результа-те чего создается видимость слабого реагирования эритроцитов D + с анти-D-сыворотками. При отсутствии полипептидов Се и се в оболочке эритроцитов связыванию D-антигенов с анти-D-антителами ничто не мешает, и реакция вы-глядит более сильной, хотя на тех и на других эритроцитах могло присутство-
вать одинаковое количество антигенных детерминант. Полипептиды сЕ в мень-шей степени блокируют доступ антител к D-антигену, чем белки, несущие Се-антигены, вследствие чего антиген D выражен сильнее, когда он находится в комбинации с антигеном сЕ, и менее выражен – в комбинации с антигеном Се.
Следует также иметь в виду, что антигенные участки подсчитывают по коли-честву связавшихся с ними антител и это не всегда отражает истинное их число. Скрытые от доступа антител участки, расположенные в толще мембраны, а воз-можно, и на эндоцеллюлярной ее части, могут оставаться не учтенными.
На выраженность антигена D влияет ген С, ингибирующий в положении транс продукцию полипептидов D (см. D u). Ингибирующий эффект гена С на ген D проявляется и в положении цис. Так, по данным Rochna и Huges-Jones [568], эритроциты лиц CDe / cde содержат меньше антигенных участков D, чем эритроциты лиц cDE / cde, у которых ген С отсутствует.
Первое место по количеству серологически активных D-антигенных участ-ков на поверхности клетки (до 200 тыс. на 1 клетку) занимают эритроциты го-мозигот −D −/ −D − и *D*/*D* (табл. 4.10). Антиген D на этих клетках выражен столь сильно, что многие сыворотки анти-D с неполными антителами агглю-тинируют эти эритроциты в солевой среде подобно полным агглютининам. По силе реакции эти эритроциты напоминают клетки, обработанные протеолитиче-скими ферментами. Последние удаляют с эритроцитов белки, препятствующие взаимодействию Rh-антигенов с неполными антителами. Эритроциты гетерози-гот −D −/СDе и *D*/СDе реагируют с неполными антителами слабее. Не все сы-воротки, агглютинирующие эритроциты гомозигот, способны агглютинировать эритроциты гетерозигот. Эритроциты с другими генотипами, представленными на рис. 4.9, не агглютинируются неполными антителами в солевой среде.
у лиц (C)D(e), имеющих сниженную экспрессию (С) и (е), содержится мень-ше серологически активного D-антигена, чем у лиц −D − и *D*, однако суще-ственно больше, чем у гомозигот сDE / cDE. Далее в соответствии с рис. 4.9 выраженность D-антигена на эритроцитах убывает в последовательности: cDE / CDe > cDe / cde > CDe / CDe > cDE / cde > CDe / cde > Cde / cDe. Последний ге-
нотип, Cde / cDe, в котором C и D находятся в позиции транс, нередко представ-ляет собой Cde / cD u e, продуцирующий слабый антиген Du. Эритроциты Du мо-гут нести менее 500 D-антигенных участков, что находится на грани выявления даже такой чувствительной методикой, как непрямая проба Кумбса.
185
| Таблица 4.10 | ||||||||
Дата: 2019-02-24, просмотров: 401.