Задолго до установления молекулярных различий в структуре полипептидов Rh и кодирующих их генов иммуносерологи классифицировали мутации, даю-щие начало новым групповым признакам, по поведению тех или иных антиге-нов и антител в серологических реакциях.
Доссе [50] разделил мутации на 3 категории.
Мутации с полной автономностью. Примером такой мутации служили ан-тигены С и С W в системе антигенов СС Wс, гены которых до последних лет счи-тались аллельными (см. С W и С X). Антиген C W полностью автономен по отноше-нию к антигену С. Это проявляется в том, что люди СС, Сс и сс могут выраба-тывать антитела анти-С W. Некоторые сыворотки анти-С содержат комбиниро-ванные антитела анти-С + С W в несепарируемой форме и не могут быть разделе-ны на анти-С и анти-С W адсорбцией эритроцитами С и С W. Вместе с тем чистые анти-С W-антитела (без примеси анти-С) встречаются относительно часто.
Вначале предполагали, что антиген С W наследуется независимо от С и с, проявляя полную автономность. Однако вскоре выяснилось, что он чаще при-сутствует в эритроцитах С +, чем в эритроцитах С −.
Аналогичными автономными свойствами обладает антиген С X по отношению
и антигенам С, с и С W, а также антиген E W по отношению к антигенам Е и е. Мутации без автономности. Этот тип мутации отражается на количе-
стве синтезируемого антигенного субстрата, не затрагивая его специфиче-ских свойств. Например , эритроциты Du агглютинируются не всеми сыворот-ками анти- D, которые в 100 % случаев реагируют с обычными эритроцитами D +. Du не имеет собственной антигенной специфичности, отличающейся от D, однако передается по наследству кодоминантно, как D и все другие груп-повые антигены. Антитела анти -D могут быть полностью удалены из сыво-ротки адсорбцией эритроцитами Du, но сыворотка анти-D не может быть раз-делена на анти-D и анти-Du дифференциальной адсорбцией. В совокупно-сти все эти признаки свидетельствуют о существовании генной мутации или
171
модификации гена D, которая не является автономной и проявляется лишь в виде слабовыраженного антигенного вещества.
Можно привести и другие примеры мутаций без автономности: С и Сu, Е и Еu.
Промежуточные мутации. Например, антиген сv, описанный Race и соавт.
[549], имеет признаки двух антитетичных антигенов – С и с, представляя собой некую промежуточную форму этих антигенов. Эритроциты сv агглютинируются полными и неполными анти-с-антителами с такой же интенсивностью, как эри-троциты гомозигот с / с, а также реагируют с некоторыми сыворотками анти-С. Между тем специфические анти-сv-антитела в чистом виде не встречаются.
Промежуточные формы антигенов наследуются кодоминантно.
Согласно современным представлениям о молекулярной структуре антиге-нов Rh (см. Строение системы Rh) приведенная классификация мутаций на основе иммуносерологических особенностей эритроцитов может показаться несколько наивной, однако именно такого рода сопоставления побудили моле-кулярных биологов искать объяснение групповым различиям на молекулярно-генетическом уровне.
Связь локуса RH с хромосомой 1
\endash \e том, что гены RH находятся на хромосоме 1, свидетельствовал ряд фактов. К началу 1970-х годов накопились данные о частичной сцепленности генов
RH с генами наследственного эллиптоцитоза, глюкозо-6-фосфатдегидрогеназы (G-6-PD), пептидазы-С (PepC) и фосфоглюкомутазы (PGM 1).
Результаты семейных исследований указывали на то, что перечисленные гены образуют взаимосвязанную группу близкорасположенных локусов и на-следуются вместе независимо от пола. Из накопленных сведений можно было сделать только один вывод: гены RH не расположены на хромосомах X и Y. Вопрос, на какой хромосоме они располагаются, оставался открытым.
Сдвиг в этой области достигнут благодаря гибридизации ядерных клеток мыши
в человека (Ruddle и соавт. [587]). При культивировании гибридных клеток, име-ющих 2 набора хромосом (человека и мыши), человеческие хромосомы посте-пенно вытеснялись мышиными. Эта модель оказалась удобной для изучения про-дукции ферментов, в частности пептидазы С. Установлено, что утрата хромосо-
мы 1 сопровождалась потерей способности культивируемых клеток продуцировать пептидазу-С, а поскольку гены PepC, G-6-PD, PGM 1 и RH связаны, было сделано заключение, что вся группа генов, в том числе ген RH, находится на хромосоме 1.
Дополнительные данные в поддержку этого заключения были получены Marsh и соавт. [462]. Авторы наблюдали больного миелофиброзом, у которого была кровяная химера: 7 % эритроцитов, циркулирующих в его кровотоке, были резус-положительными (CcDee), а остальные 93 % – резус-отрицательными (cde). Один из родителей больного имел фенотип CCDee, т. е. не содержал га-плотипа cde, который мог передать по наследству. Сам пациент передал гапло-тип CDe своему сыну. Авторы предположили, что эритроциты CcDee пациента
172
происходили из ростка, в котором гаплотипы CDe и cde были функциональны-ми, а эритроциты cde происходили из ростка, в котором гаплотип CDe являлся молчащим (cde/ − − −). При хромосомном анализе выявлена делеция короткого плеча хромосомы 1 в 95 % ядерных клеток крови пациента, на основании чего авторы заключили, что потеря небольшого участка короткого плеча хромосо-мы 1, очевидно, привела к потере функционального гаплотипа CDe. Поскольку пациент был гетерозиготен по локусу PGM 1 и содержал оба типа этого фермен-та, авторы сделали вывод, что локус RH не только расположен на хромосоме 1, но и отстоит от центромеры хромосомы дальше, чем локус PGM 1.
В 1975 г. Turner и соавт. (цит. по Issitt и Anstee [374]) обследовали семью аме-риканских индейцев, в которой одни из членов были гомозиготны по гаплоти-пу −D −, другие – гетерозиготны, а третьи не имели этого гаплотипа. У гомози-гот была обнаружена делеция короткого плеча обеих хромосом 1, у гетерози-гот – делеция короткого плеча одной хромосомы, а у родственников, не имев-ших гаплотипа −D −, делеции не было.
Хромосомный анализ лиц Rhnull и −D − не выявил корреляций, подобных опи-санным выше. Хромосомные аберрации (делеции и транслокации) не во всех случаях можно выявить существующими цитологическими методами исследо-вания. Обнаружение корреляции серологических и кариологических признаков большая редкость. В литературе имеются сообщения о пациентах с кровяными химерами, содержащими 2 популяции эритроцитов, различающиеся по антиге-нам Rh. Однако эритроцитарные химеры, так же как и снижение экспрессии ан-тигенов в период обострения болезни, наблюдают редко, и их трудно связать с изменениями в хромосоме 1, которые чаще всего отсутствуют.
Лишь с появлением методов молекулярной биологии, гибридизации in situ кДНК было достоверно установлено Cherif-Zahar и соавт. [211] место располо-жения локуса RH на коротком плече хромосомы 1, а именно в районе 1р34.3– 1р.36.13. Локусы групп крови Fy (Duffy), Sc (Scianna), Cr (DAF, Cromer), Kn (CR1, Knops) и Rd (Radin) также расположены на хромосоме 1.
Строение системы Rh
Химия антигенов Rh
Долгое время химическая структура антигенов Rh оставалась загадкой. Многочисленные попытки выделить этот антиген в чистом виде и проверить его серологические свойства резус-антителами были безуспешными. Высказывалось суждение о том, что этот антиген в серологически активном виде не может суще-ствовать вне клеточной мембраны и, будучи выделенным из нее, тотчас инакти-вируется. Такое мнение поддерживалось сведениями о том, что нагревание и вы-сушивание эритроцитов снижают серологическую активность антигенов Rh.
Разработка адекватных методов исследования гидрофобных структур мем-браны эритроцитов дала существенный сдвиг в этой области. Появились
173
сообщения Green [316] о том, что экспрессия антигенов D и С на эритроцитах связана с тиоловыми группами, и, следовательно, эти антигены по своей при-роде относятся к белкам , а не к полисахаридам, как считали раньше по анало-гии с полисахаридами А и В.
Использование глутатионмалеимидмембранных зондов также указывало на причастность экзофациальных тиоловых групп к D-специфичности. Однако значение свободных тиоловых групп в формировании антигенов Rh было по-ставлено под сомнение Suyama и соавт. [646].
Далее было показано (Green [315]), что липидные фракции, экстрагиро ванные из стромы эритроцитов n-бутанолом, а также получаемый при этом не-растворимый белковый осадок не обладают серологической активностью по отдельности, но при объединении этих фракций специфическая D-активность субстрата вновь проявляется. Таким образом, стала проясняться белково-липидная природа субстанции Rh.
Hughes-Jones и соавт. [366] подтвердили, что основными компонентами, не-обходимыми для экспрессии антигена D, являются фосфолипиды, поскольку обработка мембран эритроцитов фосфолипазами А2 и С инактивировала анти-гены D, Сс и Ее. Интересная деталь: как было установлено Hughes-Jones и со-авт. [366], Green и соавт. [320], анти-D-антитела, адсорбированные на эритро-цитах D +, предотвращали инактивацию антигена D фосфолипазой А2, что ука-зывало на специфичность воздействия этого фермента именно на структуру-носитель антигена D.
Попытки выделить и идентифицировать белок Rh, предпринятые до 1980-х годов, позволили составить общую физико-химическую характеристику антиге-нов Rh. Предварительно установлено, что белок D имеет мол. массу 7–10 кДа. Другие исследователи сообщили, что антигены Rh расположены на анионном транспортном белке в полосе 3 [678]. Полоса 3, как теперь известно, соответ-ствует антигенам Diego. Впоследствии полученные результаты были объяснены излишним протеолизом полипептидов D при очистке, а также тем фактом, что оба белка одинаково гидрофобны и мигрируют вместе в процессе выделения из мембраны эритроцитов.
Прорыв в исследовании антигенов Rh произошел в начале 1980-х годов, ког-да появились методы выделения растворимых комплексов «D-анти-D» имму-нопреципитацией антигенов специфическими антителами, меченными ради-оактивным йодом (Moore и соавт. [483], Ridgwell и соавт. [564]). Вскоре были идентифицированы полипептиды с мол. массой 32–34 кДа, несущие серологи-ческую активность D, Cс и Eе, и отсутствовашие на эритроцитах Rhnull. Каждый полипептид содержал экзофациальные тиоловые группы [564].
Далее выяснилось, что антигены е и Е расположены на одном полипеп тиде, а антиген D – на другом.
Картирование Rh-полипептидов, проведенное Bloy и соавт. [172], Blanchard и соавт. [168], показало, что фракции, иммунопреципитированные
174
сыворотками анти-с и анти-Е, практически идентичны, а фракции, иммуно-преципитированные сыворотками анти-D, существенно от них отличаются.
Hughes-Jones и соавт. [363] не наблюдали конкурентного подавления связыва-ния анти-с-антител антителами анти-Е и анти-D, а также ингибиции связывания анти-Е-антител антителами анти-с и анти-D, что свидетельствовало о размещении антигенов D, с и Е на разных участках полипептидов. При картировании установ-лено, что полипептид D имеет отличительные участки, не характерные для поли-пептидов с и Е, и это полностью совпало с результатами иммунопреципитации.
Gahmberg [295] отметил, что полипептид D не содержит углеводов в отли-чие от других белков, расположенных на внеклеточной поверхности мембраны эритроцитов. Такое заключение было основано на невозможности пометить полипептид D галактозоксидазой и перийодатом, неспособностью очищенно-го полипептида связываться в лектиновых колонках, а также неэффективно-
стью обработки эндо -N-ацетилглютаминазой Н и эндо-β- галактозидазой. Гликозилирование как обычная составляющая синтеза мембранных элемен-
тов не характерно для белка Rh. Он собирается в виде комплекса, включающе-го готовые полипептиды Rh и гликопротеины Rh, причем полипептиды Rh явля-ются продуктом одного гена, расположенного на хромосоме 1, а гликопротеины Rh – продуктом другого гена, расположенного на хромосоме 6. Точно так же со-бираются антигены системы Kell: белок Kx ковалентно связывается с гликозили-рованным гликопротеином Kell, но оба субстрата являются продуктами разных генов, один из которых расположен на аутосоме, другой (Kx – на хромосоме Х.)
После того как полипептиды Rh были идентифицированы , несколько групп исследователей попытались изучить их аминокислотную последова-тельность, а также создать олигонуклеотидные зонды и выделить ДНК, ко-дирующую Rh. Наиболее эффективными оказались методы препаративной иммунопреципитации (Avent и соавт. [147], Bloy и соавт. [172] с использо-ванием мышиных и человеческих моноклональных антител. Другие иссле-дователи (Saboori и соавт. [590]) использовали для очистки белков неимму-нологические методы , в частности хроматографию в гидроксиапатите каль-ция (Saboori и соавт. [589]). Очищенные полипептиды метили радиоактив-ным йодом и расщепляли химотрипсином.
Исследования показали, что полипептид Rh, преципитированный анти-D-антителами, имел ту же N-концевую последовательность (до остатка 13), что
и полипептид Rh, преципитированный мышиными моноклональными антите-лами серии R6A [147]. Однако, поскольку антитела R6A реагировали с эри-троцитами D −−, следовал вывод, что антиген D находится на другом полипеп-тиде, реагирующем с анти-D-антителами, и что анти-D-антитела человека и моноклональные антитела R6A мыши определяют 2 разных, но тесно связан-ных полипептида. Исследование аминокислотной последовательности белков, выделенных хроматографией в гидроксиапатите из клеток D + и D −, подтвер-дило их сходство [172, 590].
175
Предположение о том, что полипептиды Rh могут быть связаны в мембра-не эритроцитов с гликозилированным компонентом (гликопротеин Rh), было впервые высказано Gahmberg [295]. Далее было установлено, что гликопро-теин Rh, преципитированный анти-D-антителами вместе с полипептидом Rh, имеет мол. массу 45–70 кДа, а полипептид Rh – 30 кДа.
Когда стало ясно, что полипептиды Rh связаны в клеточной мембране с гли-копротеинами Rh, появились высказывания, что одни антигены Rh могут быть экспрессированы на полипептиде, а другие – на гликопротеине. Не исключали
18. третий вариант: некоторые антигены Rh представляют собой комплекс, со-стоящий из участков полипептида и гликопротеина. Присутствуя порознь, эти участки полипептида и гликопротеина не являются иммуногенными, а когда присутствуют одновременно, их комплекс приобретает иммуногенность.
Однако в последующих работах было установлено, что белковые последо-вательности, определяющие специфичность антигенов Rh, расположены на полипептидах, а не на гликопротеинах.
Структура полипептидов Rh
Антигенные детерминанты Rh расположены на негликозилированных не-фосфорилированных полипептидах с мол. массой 30–32 кДа [129, 295, 483]. Полипептиды RhD и RhcE представляют собой цепь из 12 связанных со скелетом мембраны доменов [348], пересекающих мембрану эритроцита от эндо- до экзо-целлюлярного уровня (рис. 4.5 и 4.6). Основная часть полипептида размещена в фосфолипидном бислое. На внешней стороне клетки домены соединены 6 высту-пающими над поверхностью мембраны петлями, на которых также могут распо-лагаться серологически выявляемые Rh-антигены. N- и C-концевые участки по-липептида погружены внутрь клетки [196]. Полипептид RhD, полученный искус-ственно в трансфектных клетках с помощью олигонуклеотидных праймеров и со-ответствующих кДНК людей Rh +, состоит из 417 аминокислот [147, 172, 590]. Из такого же числа аминокислот состоит полипептид RhcE, полученный таким же способом с использованием кДНК людей Rh − [138, 390, 418].
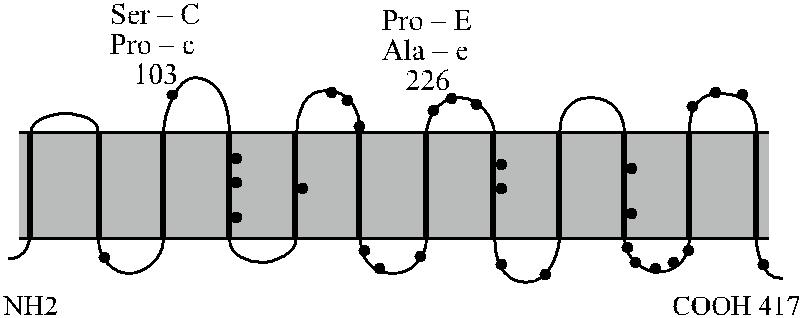
Рис. 4.5. Топология мембранных доменов Rh-Hr по Schenkel-Brunner [597].
176
Полипептид сЕ имеет 6 цистеиновых остатков, 5 из которых расположены в ци-топлазматических петлях. Шестой цистеин (Цис-285) находится в 5-й внеклеточной петле [564]. Цистеин в позиции 311 полипептида RhcE замещен на тирозин в поли-пептиде RhD. Отдельные последовательности (мотивы), например Cys – His – Leu – Ile – Pro в положении 285–289, являются общими для всех эпитопов: D, Cc и Ee.
Высокая степень гомологии между генами RHD и RHCE способствует ген-ной конверсии, неравновесному кроссинговеру и образованию в результате это-го гибридных генов, кодирующих продукцию новых антигенов Rh [597].
Rh-протеины высокогидрофобны и весьма прочно соединены с други-ми гидрофобными белками мембраны [336]. Обнаружена определенная связь Rh-полипептидов с гликофорином В, антигенами LW, гликопротеином, несу щим антигены Duffy, гликопротеином CD47 и так называемым Rh-ассоцииро ванным гликопротеином.
Rh-антигены устойчивы к воздействию протеолитических ферментов [295]. Антигены D и c (hr') разрушаются под воздействием N-этилмалеинимида, хлор-меркурибензоната и 2-нитробензойной кислоты. Это послужило для исследо-вателей основанием полагать, что Rh-субстанция содержит тиоловые группы [316, 319, 600, 646].
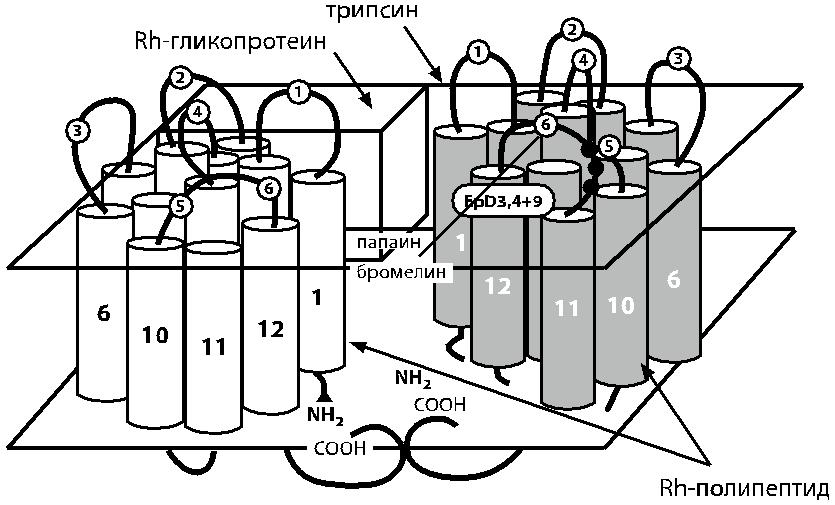
Рис. 4.6. Предполагаемая трехмерная структура доменов Rh-полипептида и Rh-ассоциированного гликопротеина в мембране эритроцита (по Avent [141]). Светлые и тем-ные цилиндры представляют домены Rh-полипептидов D и СЕ с N- и C-терминальными группами. На заднем плане условно представлен Rh-ассоциированный гликопротеин. Указаны участки разрывов при действии трипсина, папаина или бромелина, место рас-положения эпитопов D3, D4 и D9, экзо- и эндоцеллюлярные петли Rh-полипептида.
Как отмечали Dahr и соавт. [242], серологическая активность D-антигена утрачивалась под действием цистеиновых реагентов. После обработки эритро-
цитов дитионитробензойной кислотой (ДТНБК) антиген D инактивировался, однако активность его вновь восстанавливалась под действием дитиоэри-
тритола. В то же время под действием глютатиона активность D-антигена не
177
восстанавливалась. Обработка эритроцитов хлормеркурифенилсульфониковой
кислотой приводила практически к полной потере активности антигена D, кото-рая не восстанавливалась дитиоэритритолом.
Йодацетамид не инактивировал D-антиген – это согласовывалось с предпо-ложением Dahr и соавт. о том, что цистеиновые остатки являются непосред-ственной составной частью D-антигена. Авторы пришли к выводу, что цистеи-новая модификация Rh-протеина, в частности Cys 285 в 5-й внеклеточной пет-ле, приводит к модификации антигена Rh.
Серологическая активность Rh-антигенов, как показал Green [317, 318], во многом зависела от содержания липидов в мембране эритроцитов. После вытяж-ки липидов из стромы n-бутанолом Rh-активность утрачивалась, а после инкуба-ции стромы с липидным экстрактом она полностью восстанавливалась. Как ука-зывает Schenkel-Brunner [597], липиды необходимы для оптимальной простран-ственной ориентации других структурных молекул в мембране эритроцита.
Обработка эритроцитов фосфолипазой, расщепляющей жирные кислоты, лектином, фосфатидилэтаноламином или фосфатидилсерином выраженно ин-гибировала активность антигенов c, D и e [320, 3366, 530].
На серологическую активность Rh-антигенов влияло обезвоживание мем-браны эритроцитов [154, 181, 609]. Высокий уровень холестерола (соотноше-ние холестерола и фосфолипидов 1,55) совпадал с повышенной вязкостью мем-браны и большей выраженностью D-антигена. Низкий уровень холестерола (со-отношение холестерола и фосфолипидов 0,55) сопровождался меньшей вязко-стью мембраны и менее активным реагированием D-антигена [597].
Отсутствие Rh-полипептидов у людей с фенотипом Rhnull сопряжено с изме-нениями в структурной организации липидного слоя мембраны и нарушением водно-ионного транспорта в клетке.
Из ранних работ (до 1960 г.) известно, что резус-антиген термолабилен и слабеет при высушивании (П.Н. Косяков [69]). Сыворотки антирезус снижа-ли свою активность при смешивании со стрептомицином, дериватами рибону-клеиновой кислоты, некоторыми сахарами и другими химическими вещества-ми, из чего авторы делали предположения о возможной химической природе резус-антигена.
Наличие в эритроцитах Rh + Rh-ассоциированного гликопротеина, по-видимому, вводило в заблуждение исследователей, полагавших, что антигены резус имеют полисахаридную природу.
Дата: 2019-02-24, просмотров: 415.