1. 1см3 раствора 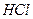 С
С 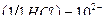 моль/дм3, переносят в катодное пространство ячейки.
моль/дм3, переносят в катодное пространство ячейки.
2. Фиксируют значение 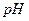 и заносят его в табл. 13.1.
и заносят его в табл. 13.1.
Данные для определения 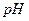 в точке эквивалентности.
в точке эквивалентности.
Таблица 13.1.
| № точки | Время, сек | рН |
3. Одновременно включают секундомер и тумблер ВКЛ источника постоянного тока (в верхнее положение).
4. Электролиз проводят до скачка 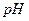 , фиксируя значения
, фиксируя значения 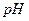 через каждые 10 секунд и занося их в табл. 13.1.
через каждые 10 секунд и занося их в табл. 13.1.
5. Выключают ток тумблером ВКЛ.
6. Построив кривую 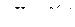 , определяют значение
, определяют значение 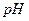 в точке эквивалентности (
в точке эквивалентности ( 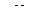 ) и заносят его в табл. 13.2.
) и заносят его в табл. 13.2.
Данные кулонометрического титрования.
Таблица 13.2.
| Объем раствора НCl, см3 | рН начальное | Генерационный ток, мА | Время электролиза, сек | pН в точке эквивалентности | Найдено НCl, мг |
Проведение предэлектролиза
1. Перед выполнением контрольной задачи фиксируют значение рН фонового электролита (оно должно быть не более 6). В случае необходимости доводят рН раствора до 6 (вносят 1-3 см3 раствора 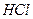 ).
).
2. Включают перемешивание. Тумблер ВКЛ источника постоянного тока устанавливают в верхнее положение и поводят предэлектролиз фонового раствора до тех пор, пока 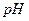 раствора не достигнет
раствора не достигнет 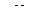 .В этот момент выключают ток тумблером ВКЛ.
.В этот момент выключают ток тумблером ВКЛ.
Определение концентрации кислоты в контрольной пробе
1. Аликвотную часть (5-10 см3) анализируемого раствора, полученного по пункту 13.2.1.1 быстро переносят в катодное пространство ячейки. Включают мешалку.
2. Одновременно включают секундомер и тумблер ВКЛ источника постоянного тока.
3. Фиксируют с помощью миллиамперметра точное значение тока генерации и заносят его в табл.13.2.
4. Электролиз проводят до достижения 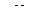 . В этот момент одновременно выключают ток (тумблером ВКЛ) и секундомер.
. В этот момент одновременно выключают ток (тумблером ВКЛ) и секундомер.
5. Время электролиза до достижения точки эквивалентности 
 и объем аликвоты раствора
и объем аликвоты раствора 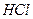 заносят в табл.13.2.
заносят в табл.13.2.
6. Проводят многократное (3-5 раз) титрование различных по объему (от 2 до 10 см3) порций испытуемого раствора, вводя каждую из них последовательно в один и тот же фоновый электролит. Ввод следующей порции раствора должен происходить непосредственно после завершения предыдущего опыта, в противном случае необходимо проведение предэлектролиза до достижения 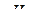 .
.
7. Результаты измерений заносят в табл.13.2.
8. Рассчитывают массу хлороводородной кислоты в испытуемом растворе для каждого опыта по формуле:
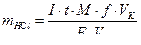 ,
,
где 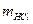 – масса
– масса 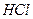 , мг;
, мг;
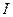 - генерационный ток,
- генерационный ток, 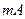 ;
;
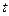 – время генерации, сек;
– время генерации, сек;
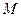 – молярная масса
– молярная масса 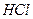 , г/моль;
, г/моль;
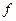 – фактор эквивалентности (равен 1);
– фактор эквивалентности (равен 1);
 – объем мерной колбы, см 3;
– объем мерной колбы, см 3;
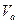 - объем аликвоты испытуемого раствора, см3;
- объем аликвоты испытуемого раствора, см3;
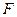 - постоянная Фарадея.
- постоянная Фарадея.
9. Находят концентрацию кислоты для каждого опыта и среднее значение концентрации кислоты в анализируемом растворе.
Дата: 2018-12-28, просмотров: 628.