Сущность метода потенциометрического титрования состоит в том, что конечную точку титрования фиксируют по резкому изменению потенциала индикаторного электрода. Метод кислотно-основного титрования основан на реакции
H+ + OH- = H2O
Приборы и реактивы
1. Установка для потенциометрического титрования (рис. 12.1) .
2. Иономер универсальный ЭВ – 74.
3. Стеклянный и хлорсеребряный электроды.
4. Магнитная мешалка.
5. Химический стакан вместимостью 50 см3.
6. Коническая колба вместимостью 250 см3.
7. Пипетка вместимостью 10 см3.
8. Бюретка вместимостью 25 см3.
9. Мерная колба вместимостью 100 см3.
10. Гидроксид натрия, водный раствор 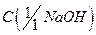 = 0,1 моль/дм3.
= 0,1 моль/дм3.
11. Соляная кислота, водный раствор 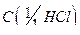 = 1 моль/дм3.
= 1 моль/дм3.
12. Соляная кислота, водный раствор 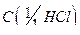 = 0,1 моль/дм3 (стандартный раствор).
= 0,1 моль/дм3 (стандартный раствор).
13. Уксусная кислота, раствор 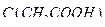 = 1 моль/дм3.
= 1 моль/дм3.
14. Ацетон.
15. Индикатор метиловый оранжевый, водный раствор с массовой долей 0,1%.
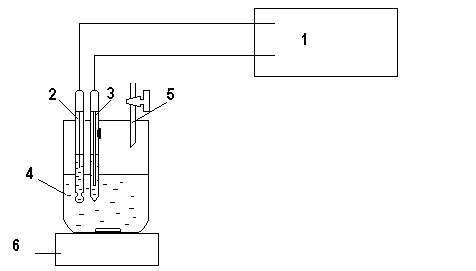
Рис 12.1. Схема установки для потенциометрического титрования:
1. Иономер ЭВ – 74. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4. Ячейка. 5. Бюретка. 6. Магнитная мешалка.
Ход работы
12.2.1.1. Установление титра рабочего раствора 
1. Бюретку заполняют раствором  .
.
2. Отбирают пипеткой 10 см3 стандартного 0,1 моль/дм3 раствора 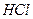 и переносят в колбу для титрования.
и переносят в колбу для титрования.
3. Добавляют 1-2 капли метилового оранжевого и титруют раствором  до изменения окраски индикатора.
до изменения окраски индикатора.
4. Записывают объем израсходованного раствора 
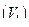 c точностью до 0,1 см3.
c точностью до 0,1 см3.
5. Повторяют титрование с новой порцией стандартного раствора 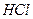 и записывают объем раствора
и записывают объем раствора 
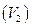 Результаты двух титрований должны различаться не более, чем на 0,1 см3.
Результаты двух титрований должны различаться не более, чем на 0,1 см3.
6. Рассчитывают среднее значение объема израсходованного раствора  по формуле:
по формуле:
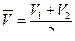
7. Рассчитывают молярную концентрацию эквивалентов раствора  по формуле, используя рассчитанное среднее значение
по формуле, используя рассчитанное среднее значение 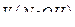 :
:
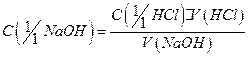
где 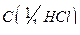 – молярная концентрация эквивалентов раствора
– молярная концентрация эквивалентов раствора 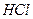 моль/дм3;
моль/дм3;
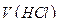 - объем
- объем 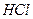 , взятый на титрование, см3;
, взятый на титрование, см3;
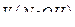 – объем раствора
– объем раствора  , см3;
, см3;
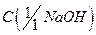 – молярная концентрация эквивалентов раствора
– молярная концентрация эквивалентов раствора  моль/дм3;
моль/дм3;
12.2.1.2. Подготовка анализируемого образца 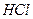 к титрованию
к титрованию
Анализируемый образец, содержащий 5-10 см3 1М раствора 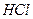 , количественно переносят в мерную колбу объемом 100 см3 и доводят объем раствора до метки дистиллированной водой.
, количественно переносят в мерную колбу объемом 100 см3 и доводят объем раствора до метки дистиллированной водой.
12.2.1.3. Подготовка иономера к работе в режиме определения рН
1. Стеклянный и хлорсеребрянный электроды присоединяют к гнездам "Изм." и "Всп." соответственно и опускают в ячейку с анализируемым раствором.
2. При нажатой кнопке "t" вращением ручки "температура раствора" устанавливают по верхней шкале температуру, соответствующую комнатной.
3. Нажимают кнопки "+" и "рХ".
4. Выбирают диапазон измерений нажатием кнопок "-1-19" (грубо) или один из точных диапазонов "-1-4"; "4-9"; "9-14"; "14-19".
5. Значения рН определяют по нижней (грубо) или верхней (точно) шкалам иономера.
Дата: 2018-12-28, просмотров: 741.