1. В стакан для титрования отбирают аликвотную часть анализируемого раствора (5-10 см3).
2. Проводят ориентировочное и точное титрование раствором 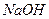 с точным титром (см. пункт 12.2.1.3), обнаруживая два скачка потенциала (первый – небольшой и второй – основной). Результаты записывают в таблицу 12.1.
с точным титром (см. пункт 12.2.1.3), обнаруживая два скачка потенциала (первый – небольшой и второй – основной). Результаты записывают в таблицу 12.1.
3. Титрование повторяют 2-3 раза.
4. Строят кривые титрования в координатах 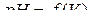 и
и  .
.
5. По второму скачку находят средний объем раствора 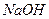 , израсходованный на титрование суммы кислот.
, израсходованный на титрование суммы кислот.
6. Для определения содержания хлороводородной кислоты отбирают аликвотную часть испытуемого раствора (10 см3), к ней приливают двойной объем ацетона и проводят потенциометрическое титрование раствором 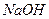 c точным титром (см. пункт 12.2.1.3).
c точным титром (см. пункт 12.2.1.3).
7. Титрование повторяют 2-3 раза.
8. Строят кривые титрования в координатах 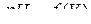 и
и  и находят средний объем раствора
и находят средний объем раствора 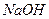 , пошедшего на титрование хлороводородной кислоты, по первому скачку потенциала.
, пошедшего на титрование хлороводородной кислоты, по первому скачку потенциала.
9. Рассчитывают содержание хлороводородной кислоты в граммах и молях по известной формуле.
10. Рассчитывают содержание уксусной кислоты в граммах и молях (по разности объемов титранта, затраченных на суммарное титрование обоих кислот в водном растворе и на титрование хлороводородной кислоты в водно-ацетоновой среде).
Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
Метод основан на потенциометрическом титровании ионов 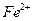 раствором бихромата калия в сернокислой среде с индикаторным платиновым электродом и хлорсеребряным электродом сравнения. При титровании протекает следующая реакция:
раствором бихромата калия в сернокислой среде с индикаторным платиновым электродом и хлорсеребряным электродом сравнения. При титровании протекает следующая реакция:
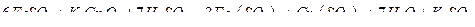
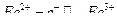
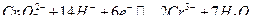
Приборы и реактивы
1. Установка для потенциометрического титрования (рис. 12.1).
2. Иономер универсальный ЭВ-74.
3. Платиновый и хлорсеребряный электроды.
4. Магнитная мешалка.
5. Химический стакан вместимостью 100 см3.
6. Пипетка вместимостью 10 см3.
7. Бюретка вместимостью 25 см3.
8. Мерная колба вместимостью 100 см3.
9. Серная кислота, раствор 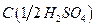 = 1 моль/дм3.
= 1 моль/дм3.
10. Бихромат калия, стандартный раствор 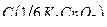 =0,01моль/дм3.
=0,01моль/дм3.
11. Сульфат железа (II), раствор 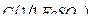 = 0,1 моль/дм3 (готовится перед анализом).
= 0,1 моль/дм3 (готовится перед анализом).
12. Хлорид железа (III), раствор 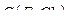 = 0,3 моль/дм3 .
= 0,3 моль/дм3 .
13. Хлорид олова, раствор w 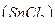 = 1% масс. в растворе хлороводородной кислоты
= 1% масс. в растворе хлороводородной кислоты 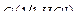 = 1 моль/л.
= 1 моль/л.
14. Хлороводородная кислота, раствор 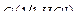 = 1 моль/дм3.
= 1 моль/дм3.
Ход работы
Подготовка анализируемого образца к титрованию
Анализируемый раствор, содержащий 10-20 см3 раствора сульфата железа (II) и 5-10 см3 хлорида железа (III) переносят в мерную колбу вместимостью 100 см3.
Приливают мерным цилиндром 10 см3 раствора серной кислоты и доводят до метки дистиллированной водой.
12.2.3.2. Подготовка иономера к работе в режиме определения потенциала
1. Платиновый и хлорсеребрянный электроды присоединяют к гнездам "Изм." и "Всп." соответственно и опускают в ячейку с анализируемым растворим.
2. Нажимают на кнопку "t" и вращением ручки "температура раствора" устанавливают по верхней шкале температуру, соответствующую комнатной.
3. Нажимают кнопки "—" и "mV".
4. Выбирают диапазон измерений нажатием кнопок "-1-19" (грубо) или один из точных диапазонов "-1-4"; "4-9"; "9-14"; "14-19".
5. Значения потенциала определяют по нижней (грубо) или верхним (точно) шкалам иономера.
Дата: 2018-12-28, просмотров: 706.