1. Начинают измерения с наиболее разбавленного раствора нитрата калия C(1/1KNO3) = 10-5 моль/дм3 (колба 5). Переносят пипеткой 20 см3 раствора из колбы 5 в стакан для измерений.
2. Электроды промывают дистиллированной водой, высушивают фильтровальной бумагой и погружают в испытуемый раствор.
3. Нажимают кнопки "mV" и «-1-19». Находят значение потенциала грубо по шкале «-1-19», затем точно, выбрав одну из точных шкал.
4. Аналогично находят значение потенциала для растворов 4,3,2 и 1.
5. Строят график в координатах 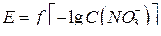 для пяти растворов.
для пяти растворов.
6. Результаты заносят в таблицу 12.3.
Данные для построения градуировочного графика.
Таблица 12.3.
| № раствора | Концентрация 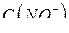 , моль/л , моль/л
| 
| Потенциал Е, mV |
Контрольная задача. Определение концентрации нитрат – иона в водном растворе
1. Переносят 20 см3 анализируемого раствора в измерительный стакан прибора.
2. Опускают в раствор промытые водой и высушенные фильтровальной бумагой электроды.
3. По шкале «-1-19» находят диапазон значения потенциала.
4. Точное значение потенциала находят, выбрав одну из точных шкал нажатием соответствующей кнопки прибора.
5. По градуировочному графику определяют 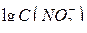 .
.
6. Рассчитывают содержание нитрат-иона и массу нитрата в анализируемом растворе по известной формуле.
12.3. Вопросы для самоподготовки.
1. На чем основаны потенциометрические методы анализа?
2. Что представляют собою электроды I, II и III рода? Приведите примеры.
3. Какие функции выполняют индикаторные электроды и какие – электроды сравнения? Какие требования к ним предъявляются?
4. На каком принципе основана работа ионселективных электродов? Их классификация и принцип действия.
5. В чем сущность потенциометрического определения рН раствора? Какие индикаторные электроды могут быть использованы для определения рН?
6. Указать область применения, достоинства и недостатки прямой потенциометрии.
7. В чем сущность некомпенсационного метода потенциометрического титрования и титрования под током?
8. Чем обусловлен выбор пары электродов? Выбор координат для построения кривых титрования? Привести примеры с использованием различных типов реакций: нейтрализации, редоксиметрии, осаждения, комплексообразования.
9. Как найти точку эквивалентности при потенциометрическом титровании?
10. В чем достоинства и недостатки метода потенциометрического титрования? Назовите области его применения.
Кулонометрия
Цель и задачи работы
Изучение возможностей и аппаратурного оформления кулонометрии, овладение приемами практического применения кулонометрического титрования в амперостатическом режиме и прямой кулонометрии в потенциостатическом режиме.
Программа работы
Дата: 2018-12-28, просмотров: 648.