1. В анодное пространство ячейки наливают 40 смз раствора серной кислоты, погружают рабочий электрод – платиновую пластину. Катодное пространство ячейки заполняют серной кислотой и помещают в него вспомогательный электрод. Камеру для хлорсеребряного электрода сравнения заполняют насыщенным раствором хлорида калия. Электролитические ключи заполняют серной кислотой и соединяют камеры.
2. В анодное пространство опускают стержень магнитной мешалки. Включают перемешивание.
3. Вводят в анодное пространство 2 см3 исследуемого вещества. Снимают анодную поляризационную кривую, начиная запись от начального равновесного потенциала.
4. Строят поляризационную кривую в координатах  . Выбирают потенциал рабочего электрода (в середине площадки предельного тока).
. Выбирают потенциал рабочего электрода (в середине площадки предельного тока).
Проведение предэлектролиза
1. В анодное пространство ячейки наливают 40 смз раствора серной кислоты, погружают рабочий электрод – платиновую сетку и якорь магнитной мешалки. Включают перемешивание.
2. На источнике начального напряжения блока БЗН потенциостата устанавливают выбранный потенциал рабочего электрода (U 1 или U 2) и включают выходное напряжение.
3. Предэлектролиз фона проводят в течение 15 мин.
13.2.4.4. Контрольная задача. Определение содержания 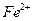 в анализируемом образце
в анализируемом образце
1. Отключают ячейку. Быстро вводят пипеткой в ячейку 0,5 см3 анализируемого раствора.
2. Одновременно включают ячейку и секундомер.
3. Записывают значения миллиамперметра через каждые 10 сек. (таблица 6.5), строят графики зависимости  и
и  .
.
Данные потенциостатической кулонометрии
Таблица 13.5.
| № точки | Время, сек | Показания миллиамперметра, I, mV | 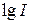
|
4. По графику  определяют
определяют 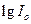 (как отрезок отсекаемый продолжением прямой на оси ординат) и
(как отрезок отсекаемый продолжением прямой на оси ординат) и 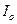 . Для трех произвольных точек рассчитывают
. Для трех произвольных точек рассчитывают 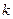 , где
, где 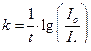 .
.
5. Рассчитывают среднее значение k и количество электричества по формуле:
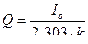
6. Рассчитывают содержание ионов 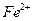 в мг в анализируемом образце по формуле:
в мг в анализируемом образце по формуле:
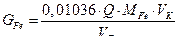
где 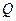 – количество электричества,
– количество электричества,
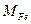 – атомная масса Fe, г/моль;
– атомная масса Fe, г/моль;
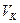 – объем мерной колбы, см 3 ;
– объем мерной колбы, см 3 ;
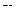 - объем аликвоты испытуемого раствора, см3 .
- объем аликвоты испытуемого раствора, см3 .
13.3. Вопросы для самоподготовки
1. В чем различие методов прямой кулонометрии и кулонометрического титрования?
2. Какие законы лежат в основе метода кулонометрии? Сформулируйте их.
3. Каковы особенности метода кулонометрического анализа в амперостатическом и потенциостатическом режимах?
4. Привести принципиальную схему установки для кулонометрического титрования.
5. Назвать наиболее распространенные способы фиксирования точки эквивалентности в кулонометрическом титровании.
6. Привести примеры кулонометрического титрования: а) электрогенерированными окислителями; б) электрогенерированными восстановителями; в) с использованием реакций осаждения и комплексообразования; г) с использованием реакций кислотно-основного взаимодействия.
7. Укажите достоинства и недостатки кулонометрических методов анализа. Чем ограничена область применения этих методов?
Кондуктометрия.
Цель и задачи работы.
Изучение возможностей и аппаратурного оформления кондуктометрии, овладение приемами практического применения кондуктометрического титрования.
Программа работы.
Дата: 2018-12-28, просмотров: 716.