С помощью неинвазивных методов невозможно в клинике изолированно оценить влияние миогенных, нейрогенных и эндотелиальных компонентов тонуса микрососудов. Метод ЛДФ предоставляет в этом отношении уникальные диагностические возможности. Оценить тонус микрососудов возможно, применяя амплитудно-частотный анализ колебаний кровотока (Крупаткин А.И., 2003; Крупаткин А.И., Сидоров В.В., Меркулов М.В.и др., 2004).
Природа нейрогенного тонуса (НТ) связана с активностью a-адренореценторов (в основном a1) мембраны ключевых и отчасти сопряженных гладкомышечных клеток. Поэтому НТ может увеличиваться как при возрастании активности симпатических нервов-вазоконстрикторов, так и на фоне денервационной гиперчувствительности сосудистой стенки. Сенсорные нейропептиды – вазодилататоры могут влиять как на миогенный тонус по бессинаптическим механизмам, так и участвовать в пресинаптическом торможении симпатической активности, снижая НТ.
Очевидно, что регистрируемые амплитуды осцилляций кровотока эндотелиального, нейрогенного и миогенного эндотелиально-независимого происхождения прямо связаны с величинами просвета микрососудов, а, следовательно, и с мышечным тонусом. Снижение амплитуды осцилляций сочетается с повышением тонуса и жесткости самой сосудистой стенки, и наоборот, повышение амплитуд является следствием снижения сосудистого тонуса.
Нейрогенный тонус прекапиллярных резистивных микрососудов определяется по формуле:
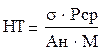 ,
,
s - среднее квадратическое отклонение показателя микроциркуляции, Рср – среднее артериальное давление, Ан – наибольшее значение амплитуды колебаний перфузии в нейрогенном диапазоне, М – среднее арифметическое значение показателя микроциркуляции.
Миогенный тонус (МТ) метартериол и прекапиллярных сфинктеров определяется как:
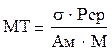 .
.
МТ обратно пропорционален амплитуде осцилляций миогенного диапазона (Ам.). Эндотелиально-зависимый компонент тонуса (ЭЗКТ) можно определить по формуле:
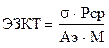 ,
,
где Аэ – амплитуда колебаний в эндотелиальном диапазоне. Параметр s в приведенных выражениях применен с целью нормировки и уменьшения погрешности при не стандартизированных условиях проводимых исследований.
На рис. 4.5 показана локализация регуляции нейрогенного и миогенного тонусов.
 Поскольку имеются отличия в регуляции артериол и анастомозов (здесь присутствует значительная доля симпатических адренергических механизмов регуляции), с одной стороны, и прекапиллярных сфинктеров (отсутствие симпатической иннервации), с другой стороны, то это позволяет неинвазивно оценивать соотношения шунтового и нутритивного кровотока.
Поскольку имеются отличия в регуляции артериол и анастомозов (здесь присутствует значительная доля симпатических адренергических механизмов регуляции), с одной стороны, и прекапиллярных сфинктеров (отсутствие симпатической иннервации), с другой стороны, то это позволяет неинвазивно оценивать соотношения шунтового и нутритивного кровотока.
Показатель шунтирования (ПШ) вычисляется по формуле: ПШ = МТ/НТ = Ан/Ам. Таким образом, чем выше амплитуда нейрогенных колебаний, а это значит, что НТ понижен, и уменьшены амплитуды миогенных колебаний (МТ – повышен), то ПШ увеличен; и наоборот. Данная формула применима в физиологических условиях, когда доминирующими осцилляциями в артериолах являются осцилляции нейрогенного диапазона. Если в условиях патологии или иных состояниях доминируют осцилляции эндотелиального ритма, то в указанной формуле следует заменить Ан на Аэ. Кроме того, если значение ПШ меньше 1, то это означает поступление значительного объема крови в нутритивное звено на фоне спазма шунтов, например, при активации симпатического вазомоторного рефлекса.
Функциональные пробы
При ЛДФ исследованиях системы гемомикроциркуляции кожи в клинике для выявления адаптационных резервов системы микроциркуляции, оценки состояния механизмов регуляции тканевого кровотока, а также общего функционального состояния микроциркуляторного русла применяют функциональные пробы. Флоуметрия, дополненная функциональными пробами, позволяет получить характеристики, отражающие не только факт системного и органного нарушения микроциркуляции, но и более детально проследить его патогенез.
К традиционно используемым функциональным пробам, относят следующие:
1. Дыхательная проба (проба с задержкой дыхания) и другие вегетативные вазоконстрикторные пробы.
2. Постуральная проба.
3. Холодовая проба.
4. Тепловая проба.
5. Окклюзионная проба.
6. Фармакологическая (ионофоретическая) проба.
7. Электростимуляционная проба.
Дыхательная проба
Вазомоторный рефлекс, запускаемый быстрым и глубоким вдохом вызывает констрикцию артериол и кратковременное уменьшение кожного кровотока у большинства людей. При проведении дыхательной пробы регистрируют фоновую величину перфузии кровотока, а затем реакцию перфузии в ходе 15-секундной задержки дыхания на высоте глубокого вдоха. При этом на практике достаточно определить среднюю величину степени спада кривой не более, чем для двух вдохов с интервалом 1-2 минуты. Стандартизация глубины вдоха с помощью спирометрии не повышает эффективность диагностики, в связи с чем факт глубокого вдоха достаточен для трактовки результатов (Du Buf-Vereijken et al.,1997).
Впервые вышеупомянутый рефлекс детально описали B.Bolton с соавторами в 1936 году, показавшие также, что вазоконстрикторный ответ зависит от интактности симпатической периферической иннервации - он отсутствовал в пальцах конечности после денервации и десимпатизации. В то же время вазоконстрикторный ответ сохранялся при полной манжеточной окклюзии кровотока верхней конечности, т.е. сохранность перфузии не играет основной роли в его появлении (Bolton B.et al, 1936). При изучении природы этого рефлекса было показано, что афферентная стимуляция возникает при растяжении грудной клетки на глубоком вдохе. Но в ряде работ указывалось на преимущественную роль растяжения грудных вен как инициирующего фактора, т.к. рефлекс вызывался без выраженного растяжения грудной клетки (De Lalla, 1948). Gilliatt R.W. c соавторами (Gilliatt R.W. et al., 1948) наблюдали его у больных с параплегией и полным нарушением функции проводимости спинного мозга выше уровня расположения сегментов симпатической иннервации верхних конечностей. Поэтому высказывались мнения, что рефлекс не связан с гипотензией на вдохе и с вовлечением барорефлекторной цепи каротидного синуса. Предполагалось, что это чисто спинальный рефлекс, а афферентные волокна входят в спинной мозг преимущественно в зоне верхнегрудных сегментов. Но полностью детали афферентных и эфферентных путей рефлекса не ясны до сих пор.
Рефлекс вызывает значительное снижение кровотока. Плетизмографическими исследованиями кистей рук продемонстрировано уменьшение его на 80% и более, а при капилляроскопии ногтевого ложа отмечено быстрое и полное прекращение капиллярного кровотока (Mulinos M.G., Shulman I.,1939). Когда кровоток конечности прекращали манжеточной окклюзией плечевой артерии, то последующий глубокий вдох вызывал временное быстрое ускорение капиллярного кровотока, видимо, за счет изгнания крови при констрикции более проксимальных артериол. В настоящее время инспираторный дыхательный сосудистый ответ (the inspiratory gasp vascular response – IGVR) чаще измеряют в коже ладонной поверхности пальцев кисти и подошвенной поверхности пальцев стопы в ходе ЛДФ-исследований (Khan F. et al., 1991; Netten P.M. et al., 1996).Эти зоны кожи богаты анастомозами и часто используются для оценки нейрососудистой функции у больных с диабетом (Wilson S.B. et al., 1992; Abbot N.C. et al., 1993), болезнью Рейно (Wollersheim H. et al., 1991), эритромелалгией (Littleford R.C. et al., 1999), лепрой (Abbot N.C. et al., 1993), при нарушениях иннервации конечностей и после трансплантации (Крупаткин А.И., 2003; Крупаткин А.И., Сидоров В.В., Меркулов М.В.и др., 2004). Отдельные авторы применяют с этой же целью фотоплетизмографию (Barron S.A. et al.,1993).
Определен ряд факторов, которые могут влиять на величину снижения кровотока в ходе дыхательной пробы – кожная температура (Oberle J. et al., 1988), возраст, наследственные факторы (Lau Y.T. et al., 1995; du Buf-Vereijken et al., 1997). Согласно данным (Mayrovitz H.N. et al., 2002) уровень уменьшения перфузии при дыхательной пробе мало зависит от наличия или отсутствия артериоло-венулярных анастомозов кожи, в связи с чем кожу как тыла, так и ладонной поверхности пальцев можно использовать для оценки вегето-сосудистой регуляции. С возрастом проявляется тенденция к менее выраженной реакции уменьшения перфузии при проведении дыхательной пробы (Khan F. et al.,1992).
 Дыхательная проба не только проста в применении, но и высокоинформативна (рис. 4.6). В участках кожи с высокой плотностью симпатической иннервации (акральные зоны конечностей, особенно пальцы кисти) она положительна у всех здоровых лиц.
Дыхательная проба не только проста в применении, но и высокоинформативна (рис. 4.6). В участках кожи с высокой плотностью симпатической иннервации (акральные зоны конечностей, особенно пальцы кисти) она положительна у всех здоровых лиц.
В чём особенности трактовки результатов вазоконстрикторных тестов, в том числе дыхательной пробы? Реакция сосуда на активацию адренергических волокон зависит как от влияний со стороны симпатической иннервации, так и от реактивности сосудистой стенки. Поэтому величина снижения кровотока при дыхательной пробе отражает результирующую этих двух процессов, которые трудно оценить изолированно. Например, при исходном спазме приносящих микрососудов или венозном застое с включением венуло-артериолярных механизмов отмечена более низкая реакция на дыхательную пробу. В связи с вышеизложенным физиологическую трактовку результатов ЛДФ для оценки функции симпатической периваскулярной иннервации целесообразно осуществлять по двум параметрам – исходному нейрогенному тонусу в покое и относительной величине снижения ПМ при дыхательной пробе. Нормирование необходимо для сглаживания влияния исходного состояния сосуда на показатели вазоконстрикторной функциональной пробы. Амплитуду спада при дыхательной пробе можно оценивать по формуле:
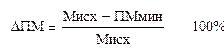 (4.2)
(4.2)
где ПМмин. – минимальная величина ПМ при дыхательной пробе, а Мисх. – исходная величина ПМ. Величина DПМ зависит от состояния вегетативной регуляции. Ранее сообщалось, что норматив DПМ для пальцев кисти составляет 32,8%, но эта величина характерна для лиц, ведущих активный образ жизни и спортсменов. Для основной популяции норматив DПМ кожи подушечки 2-ого пальца – 40%, а 5-ого пальца – 52%.
Основные варианты нарушений амплитуды симпатического вазомоторного рефлекса, диагностируемые с помощью ЛДФ, представлены в таблице 4.1.
DПМ при дыхательной пробе отражает симпатическую регуляцию, ограниченную преимущественно нейро-сосудистым синапсом. При застарелой денервации и дефиците симпатических волокон следует учитывать появление денервационной гиперчувствительности сосудов с появлением рецепторов во внесинаптических пространствах, на которые могут влиять минимальные концентрации циркулирующих катехоламинов. В этом случае показатель DПМ снижается, хотя исходный нейрогенный тонус повышен. Соответственно, при полной симпатической денервации сосудов рефлекторные симпатические вазоконстрикторные пробы ЛДФ могут быть отрицательными, а попытки вызвать вазодилатацию с помощью симпатических блокад безуспешными.
Дата: 2019-02-02, просмотров: 430.