Как известно, существуют оптимальные соотношения между длиной волны зондирующего излучения и размером частицы, от которой возможно получить детектируемый сигнал – при уменьшении длины волны зондирующего излучения уменьшается размер детектируемой частицы. В отличие от ультразвуковых методов диагнос-тики, основанных на эффекте Допплера, при применении более коротковолнового зондирующего лазерного излучения, возможно получить отраженный сигнал наибольшей амплитуды от отдельных эритроцитов из более тонкого слоя, около 1 мм (Fagrell B., 1994). Этот слой зондирования может содержать в зависимости от типа ткани следующие звенья гемомикроциркуляторного русла: артериолы, терминальные артериолы, капилляры, посткапиллярные венулы, венулы и артериоло-венулярные анастомозы.
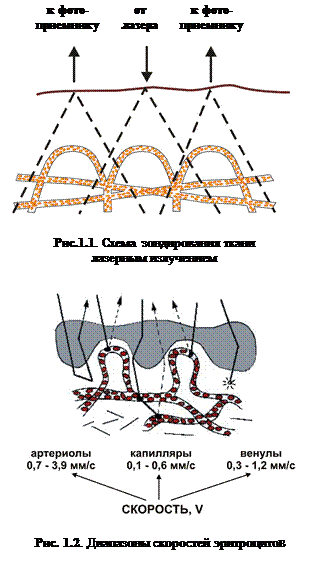
Схема взаимодействия лазерного излучения с тканью показана на рис. 1.1, 1.2.
При взаимодействии лазерного излучения с тканью отраженный сигнал имеет две составляющие: постоянную и переменную. Постоянный сигнал обусловлен отражением от неподвижных структур зондируемой ткани. Переменный сигнал связан с движущимися частицами – эритроцитами.
 При взаимодействии лазерного излучения с неподвижной тканью рассеянное излучения имеет ту же частоту, что и зондирующее излучение, при взаимодействии с движущимися эритроцитами частота рассеянного излучения отличается от частоты падающего излучения в соответствии с допплеровским эффектом. Допплеровский сдвиг частоты связан со скоростью эритроцитов известным выражением: Δ f = 2 nV/λ (где: Δ f – допплеровский сдвиг частоты, n – показатель преломления излучения в ткани, V – скорость эритроцитов, λ – длина волны зондирующего излучения).
При взаимодействии лазерного излучения с неподвижной тканью рассеянное излучения имеет ту же частоту, что и зондирующее излучение, при взаимодействии с движущимися эритроцитами частота рассеянного излучения отличается от частоты падающего излучения в соответствии с допплеровским эффектом. Допплеровский сдвиг частоты связан со скоростью эритроцитов известным выражением: Δ f = 2 nV/λ (где: Δ f – допплеровский сдвиг частоты, n – показатель преломления излучения в ткани, V – скорость эритроцитов, λ – длина волны зондирующего излучения).
Кровеносные сосуды микроциркуляторного русла могут быть ориентированы по отношению к фронту волны зондирующего излучения под разными углами. Максимальная частота допплеровского сдвига возникает, когда векторы направления распространения фронта волны излучения и скорости движения эритроцита параллельны. Этой ситуации соответствует частотный сдвиг около 4,4 кГц для скорости эритроцитов 1 мм/с и длины волны гелий-неонового лазера 0,638 мкм при показателе преломления ткани 1,4. Для эритроцитов, которые движутся под углом к направлению зондирующего излучения, величина допплеровского сдвига частоты уменьшается пропорционально значению косинуса этого угла.
Доставка лазерного излучения к ткани и прием отраженного сигнала в приборах, реализующих метод ЛДФ, осуществляются, как правило, с помощью световодного зонда, состоящего из трех световодных волокон. Одно световодное волокно используется для передачи зондирующего излучения, а два других – являются приемными, по которым отраженное излучение доставляется к прибору для фотометрирования и дальнейшей обработки (рис. 1.1).
В зависимости от задач исследования микроциркуляции крови применяются лазерные источники мощностью 1-2 мВт, излучающие в диапазоне от зеленой до ближней инфракрасной длины волны. Глубина зондирующего слоя зависит от длины волны: чем короче длина волны, тем тоньше слой. Это обстоятельство объясняется различным поглощением излучения в биологических тканях молекулами меланина, гемоглобина, бета-каротина и билирубина.
Поглощение излучения молекулами гемоглобина является наиболее значительным для коротковолнового излучения – это приводит к уменьшению величины детектируемого рассеянного излучения. Для указанного диапазона от зеленой до инфракрасной длины волны толщина зондируемого слоя ткани может составлять от 0,5 до 2 мм (Anderson R.R., 1981).
Следует различать понятия толщины зондирующего слоя и глубины проникновения излучения в ткань.
Толщина зондирующего слоя определяется исходя из условия наибольшей величины интенсивности отраженного излучения по направлению к приемнику, причем интенсивность зондирующего излучения выбирается низкая, чтобы не вызвать стимуляцию микроциркуляции крови. Максимальная интенсивность отраженного назад излучения определяется условием первичного однократного рассеяния фотона на эритроците. При следующем вторичном рассеянии интенсивность отраженного излучения в десять раз слабее по сравнению с интенсивностью первичного акта рассеяния. Поэтому результаты вторичного рассеяния не вносят существенный вклад в отраженный сигнал.
Глубина проникновения излучения в ткань определяется поглощением и рассеянием вперед от лазерного источника. Когда излучение распространяется в биологической ткани, только незначительная часть (около 3-7%) отражается назад. Наибольшая величина мощности излучения частично поглощается или рассеивается вперед в соответствии с законом Дебая-Релея (Исимару А., 1981). Объем зондируемой ткани в методе ЛДФ определяется геометрией и оптическими параметрами световодного зонда и составляет, как правило, около 1 мм3 для излучения в красной видимой области спектра Указанный объем ткани кожи может содержать зону, включающую восходящую из глубины дермы артериолу, от которой отходят до пяти ответвлений, множество капилляров и сопутствующую нисходящую венулу с девятью сходящими посткапиллярными венулами (Braverman I.M., 1990). В этом объеме эритроциты движутся с разными линейными скоростями: от 0,68 до 3,87 мм/с в артериолах; от 0,1 до 0,6 мм/с в капиллярах и от 0,32 до 1,21 мм/с в венулах (Фолков Б. и Нил Э., 1976) (рис.1.2). Число эритроцитов в объеме 1 мм3 может достигать несколько десятков тысяч.
Следовательно, амплитуда отраженного сигнала формируется в результате отражения излучения от ансамбля эритроцитов, движущихся с разными скоростями и по-разному количественно распределенных в артериолах, капиллярах, венулах и артериоло-венулярных анастомозах. Поэтому в методе ЛДФ применяется алгоритм усреднения, который позволяет получить средний допплеровский сдвиг частоты по всей совокупности эритроцитов, попадающих в зондируемую область. В результате такого усреднения методом ЛДФ оценивается изменение потока эритроцитов. Для этого проводят обработку отраженного сигнала электронным путем, осуществляя усреднение по скоростям (допплеровским сдвигам частоты). Очевидно, что мощность отраженного излучения складывается из отдельных актов отражения излучения на каждом эритроците и, следовательно, зависит от их концентрации. На выходе прибора формируется результат флоуметрии - сигнал, амплитуда которого пропорциональна скорости и количеству эритроцитов.
Результат флоуметрии может быть представлен выражением:
ПМ = K × Nэр × Vср, (1.1)
где: ПМ – показатель микроциркуляции (амплитуда сигнала в вольтах), K – коэффициент пропорциональности (К = 1), Nэр – количество эритроцитов, Vср – средняя скорость эритроцитов в зондируемом объеме.
Таким образом, в неинвазивном методе ЛДФ результирующий параметр определяет динамическую характеристику микроциркуляции крови – изменение потока крови (перфузии ткани кровью) в единицу времени в зондируемом объеме.
В англоязычных публикациях встречаются разные названия измеряемого параметра при ЛДФ – это red (blood) cell flux, blood flux (flow), volume flux. В 1992 году в Лондоне European Laser Doppler User Group (ELDUG) было рекомендовано применять при исследованиях единый термин «Laser Doppler Perfusion» (перфузия) для описания выходного сигнала, определяемый как произведение линейной скорости эритроцитов на их концентрацию (Almond N., 1994).
Амплитуда сигнала, пропорциональная указанному произведению, измеряется в относительных или перфузионных единицах (пф.ед.). Это связано с принципиальными трудностями при калибровке метода ЛДФ in vitro и in vivo (Borgos J., 2000). При калибровке in vitro организуется, как правило, движение эритроцитов в трубках малого диаметра. В этом случае отмечается увеличение доплеровского сдвига частоты в результате эффектов многократного рассеяния фотона на эритроцитах. Второй принципиальный момент, что калибровочная система неустойчивая, так как в трубках малого диаметра происходит агрегация эритроцитов, что приводит к изменению динамической ситуации. Результаты калибровки in vivo путем сравнения метода ЛДФ с другими известными методами, косвенно оценивающими состояние микроциркуляции, могут быть применимы с большой осторожностью. Поток крови, определяемый выражением (1.1), не может быть выражен в абсолютных единицах, например, в мл/c/куб.мм (Stefanovska A., Bracic M., 1999), так как при окклюзии регистрируется броуновское движение остаточной крови, так называемый «биологический ноль», который учесть при калибровке не представляется возможным.
Формирование ЛДФ-сигнала
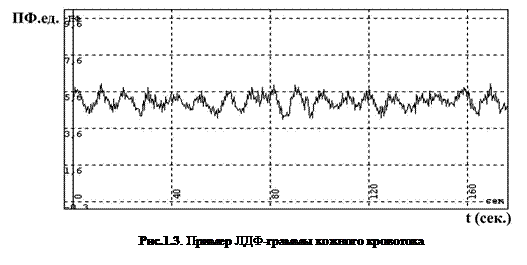
В методе ЛДФ выходной сигнал непрерывно регистрируется в течение времени исследований, и диагностика состояния микроциркуляции крови основывается на анализе графической записи изменений перфузии, которая называется ЛДФ-граммой.
На рис.1.3 представлена характерная ЛДФ-грамма кожного кровотока на мониторе компьютера. Ось ОХ – это время записи (t) в секундах, ось OY – показатель микроциркуляции ПМ в относительных перфузионных единицах (пф.ед.).
ЛДФ-сигнал имеет постоянную и переменную от времени составляющие, поэтому показатель микроциркуляции (перфузии) можно представить следующим выражением:
ПМ ( t) = М + δПМ ( t), (1.2)
где: М – постоянная составляющая перфузии и δПМ ( t) – переменная составляющая перфузии.
Постоянная составляющая М - это средняя перфузия в микроциркуляторном русле за определенный промежуток времени исследований или за выбранный временной интервал анализа ЛДФ-граммы. Именно постоянная составляющая перфузии М является тем параметром, который сравнивают, когда диагностика основана только на анализе базального кровотока или в ходе исследований оцениваются реакции микроциркуляторного русла на функциональные пробы. Так как перфузия является динамической характеристикой и определяется выражением (1) в единицу времени, то для получения числового значения определяют среднюю величину перфузии в заданном временном интервале:
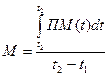 (1.3)
(1.3)
где: t2 – t1 – интервал усреднения. Временной интервал усреднения определяется частотой передачи информации в компьютер для последующей обработки.
Переменная составляющая ЛДФ-сигнала δПМ ( t) обусловлена факторами, влияющими на постоянство потока крови в микроциркуляторном русле, то есть связана с обстоятельствами, изменяющими величину скорости Vср и концентрацию Nэр эритроцитов. Характер изменения величины δПМ ( t) определяется вариациями во времени как просветами сосудов, их внутренними диаметрами, которые контролируются активными механизмами, так и пассивными факторами в системе микроциркуляции (Schmid-Schonbein H.et.al., 1992).
Колебания перфузии регистрируются в виде сложного, непериодического процесса. Многие авторы отмечали, что режимы хаотических колебаний в физиологических системах более оптимальны для их существования, чем периодические (Трубецков Д.И., 2004). Исследования динамических процессов у здоровых индивидуумов свидетельствует о том, что наблюдаемый «хаос» присущ самой природе динамического процесса в организме. Та или иная степень хаотичности, характеризующая режим функционирования здорового индивидуума, может изменяться вследствие патологии в ту или иную сторону (Анищенко В.С., 2002). Любая биологическая система должна быть колебательной для того, чтобы она могла сохраниться и не погибнуть. Неэлектрические колебания проявляются в виде временных изменений концентрации химических веществ и механических колебаний. Поддержание незатухающих колебаний осуществляется в результате присутствия регуляторных факторов и механизмов обратной связи (Флейшман А.Н., 1999).
Активные факторы контроля микроциркуляции (факторы, непосредственно воздействующие на систему микроциркуляции) – это эндотелиальный, миогенный и нейрогенный механизмы регуляции просвета сосудов, тонуса сосудов. Эти факторы контроля регуляции модулируют поток крови со стороны сосудистой стенки и реализуются через ее мышечный компонент.
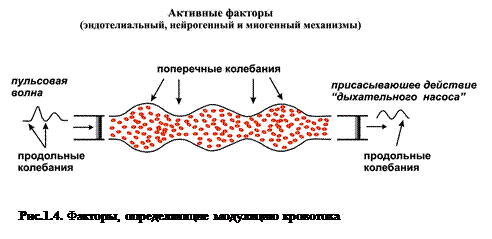
Пассивные факторы (факторы, вызывающие колебания кровотока вне системы микроциркуляции) – это пульсовая волна со стороны артерий и присасывающее действие «дыхательного насоса» со стороны вен. Эти колебания проникают с кровотоком в зондируемую область, так как микроциркуляторное русло, являющееся составной частью системы кровообращения, топографически расположено между артериями и венами.
Влияние активных и пассивных факторов на поток крови приводит к изменению скорости и концентрации потока эритроцитов. Эти изменения вызывают модуляцию перфузии, определяемую выражением (1.1), регистрируются в виде сложного колебательного процесса (рис.1.3).
Активные механизмы создают поперечные колебания (рис.1.4) кровотока в результате чередования сокращения и расслабления мышц сосудов (сменяющие друг друга эпизоды вазоконстрикции и вазодилатации). Пассивные факторы организуют продольные колебания кровотока, выражающие в периодическом изменении объема крови в сосуде. В артериолах характер изменения объема определяется пульсовой волной, в венулах – рабочим ритмом «дыхательного насоса».
В переменной составляющей δПМ ( t) содержится ценная информация о модуляции кровотока. Ее расшифровка, анализ и интерпретация позволяет диагностировать состояние сосудистого тонуса и механизмов регуляции кровотоком в микроциркуляторном русле. Если постоянная составляющая ЛДФ-сигнала М характеризует величину перфузии, то δПМ ( t) – механизмы контроля за перфузией.
Таким образом, для диагностики патофизиологического состояния микроциркуляторного русла следует анализировать обе составляющие, причем величина М является дополнительным, справочным параметром.
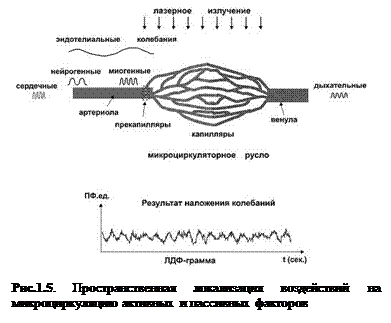
Исполнительным объектом или «мишенью» активных факторов контроля является мышечный компонент сосудистой стенки. Пассивные факторы также влияют на сосудистую стенку посредством колебаний кровотока. На рис.1.5 схематично показана пространственная локализация воздействий на мышцы сосудистой стенки активных факторов. В физиологических условиях мишенью нейрогенной регуляции являются артериолы и артериоло-венулярные анастомозы, миогенная регуляция в чистом виде локализована на прекапиллярах и сфинктерах, эндотелиальная регуляция диаметра сосудов затрагивает преимущественно прекапиллярное звено (артерии, артериолы, прекапилляры). В капиллярах регистрируются миогенные и пульсовые колебания, проникающие с кровотоком при движении через прекапилляры (Meyer M.F. et.al. 2003). Регистрируемый в ЛДФ-грамме колебательный процесс является результатом наложения колебаний, обусловленных активными и пассивными факторами.
Дата: 2019-02-02, просмотров: 546.