Включает как химические, так и биофизические компоненты - экстравазальные (влияющие на гладкую мускулатуру сосуда извне) и интравазальные (влияющие на нее изнутри). Внешнее давление интерстициальной среды играет незначительную роль для регуляции сосудов поверхностных тканей в отличие от тканей почек или головного мозга, находящихся в замкнутых пространствах. Для поддержания кровотока, адекватного потребностям тканей, существует самоуправление периферии в виде гистометаболических, кислородозависимых и гистомеханических механизмов (Зайчик А.Ш., Чурилов Л.П., 2001). Их сочетание поддерживает местный микроциркуляторный кровоток, например, при целесообразности рабочей гиперемии, относительно независимо от центральных рефлекторных и гемодинамических влияний. Рефлекторные факторы при этом могут вызывать сужение сосудов соседних нефункционирующих тканей и стабилизировать средние параметры кровообращения органа или части тела.
 Гистомеханический механизм связан с активной миогенной реакцией в ответ на растяжение гладкомышечных клеток при изменении трансмурального давления: при повышении внутрисосудистого давления гладкая мускулатура сокращается, а при снижении - расслабляется. Длительно поддерживаемое сокращение сосуда в ответ на растяжение его давлением – компонент миогенного тонуса. Миогенную реакцию рассматривают как переходный процесс, предшествующий установлению нового уровня миогенного тонуса после изменения трансмурального давления (Родионов И.М. и др., 2001). Возможность избыточности повышения миогенного тонуса сдерживается гистометаболическими и кислородозависимыми механизмами. Миогенная ауторегуляция (эффект Бейлиса) способствует стабилизации кровоснабжения мышц (в коже этот эффект также присутствует выражен слабо), так как при повышении давления объемная скорость кровотока не меняется или возрастает несущественно. Механизм этой реакции обусловлен активацией чувствительности к растяжению ионных каналов в клетках гладкой мускулатуры и не зависит от нейрогенных влияний, сохраняясь даже после перерезки симпатических волокон (Физиология человека…1996).
Гистомеханический механизм связан с активной миогенной реакцией в ответ на растяжение гладкомышечных клеток при изменении трансмурального давления: при повышении внутрисосудистого давления гладкая мускулатура сокращается, а при снижении - расслабляется. Длительно поддерживаемое сокращение сосуда в ответ на растяжение его давлением – компонент миогенного тонуса. Миогенную реакцию рассматривают как переходный процесс, предшествующий установлению нового уровня миогенного тонуса после изменения трансмурального давления (Родионов И.М. и др., 2001). Возможность избыточности повышения миогенного тонуса сдерживается гистометаболическими и кислородозависимыми механизмами. Миогенная ауторегуляция (эффект Бейлиса) способствует стабилизации кровоснабжения мышц (в коже этот эффект также присутствует выражен слабо), так как при повышении давления объемная скорость кровотока не меняется или возрастает несущественно. Механизм этой реакции обусловлен активацией чувствительности к растяжению ионных каналов в клетках гладкой мускулатуры и не зависит от нейрогенных влияний, сохраняясь даже после перерезки симпатических волокон (Физиология человека…1996).
Кислородозависимый механизм основан на способности гладкомышечных клеток расслабляться при гипоксии даже без метаболических вазодилататоров, в том числе при усиленной физической работе и возникающей при этом относительной гипоксии на фоне активации потребления кислорода. Повышение рО2 тканей имеет обратный эффект.
Гистометаболический механизм обусловлен локальными факторами метаболической природы, осуществляющих прямое влияние на гладкомышечные клетки и эндотелиоциты. Так как сосуды располагаются в интерстициальном пространстве тканей, то на них экстравазально влияет химический состав среды. Последний отражает баланс кровоснабжения и метаболизма ткани, что составляет основу метаболической ауторегуляции периферического кровообращения по принципу биологической обратной связи [194]. К факторам среды относится газовый состав (рСО2), ионы К+, Са+2,Mg+2, Na+, рН среды, её осмолярность, свободные биологически активные вещества (гистамин, серотонин, катехоламины, аденозин, ацетилхолин и др.). В физиологических условиях увеличение рСО2 , К+ , Н+, аденозина, осмолярности тканей конечностей снижает тонус артериол и расширяет сосуды, например, в скелетных мышцах при физической работе. До сих пор не ясно, какие вещества в наибольшей степени определяют характер и степень метаболических реакций кровотока. Поэтому тонус артериол определяется их интегральным влиянием и оценка метаболической регуляции осуществляется комплексно по результирующему эффекту с помощью пробы реактивной гиперемии. Следует подчеркнуть, что среди множества локальных химических факторов имеются вещества, влияющие только в патологических условиях, например, гистамин или кинины, вызывающие вазодилатацию и повышение проницаемости при аллергических реакциях, болевых синдромах, повреждении тканей. В условиях физиологической нормы они не принимают клинически значимого участия в регуляции кровообращения, а и их роль при патологических процессах во-многом адаптивная, способствующая кровоснабжению и трофике пораженных тканей. Морман Д., Хеллер Л. (2000) приводят один из вероятных механизмов влияния метаболической регуляции – через АТФ-чувствительные калиевые каналы гладкомышечных клеток: недостаток кровоснабжения тканей ® снижение уровня АТФ тканей® открытие АТФ-зависимых К+каналов®гиперполяризация мембран ® закрытие электроуправляемых Са+2 каналов®снижение концентрации свободного Са+2 в цитоплазме гладкой мускулатуры®снижение тонической сократительной активности миоцитов®расширение сосудов®увеличение кровотока.
Среди химических факторов, регулирующих состояние сосудов, особая роль принадлежит физиологически активным пептидам. Влияние на сердечно-сосудистую систему – одна из граней их воздействия как системы универсальных регуляторов физиологических функций всех структур организма и гомеостаза в целом. По химической структуре они включают олигопептиды (кинины, эндотелин и др.), белки (цитомедины; цитокины - ростковые пептидные факторы, интерлейкины, интерфероны, факторы некроза опухоли, колониестимулирующие факторы, хемокины и др.), низкомолекулярные соединения. Пептиды могут влиять на периферические сосуды, модулируя регуляторные механизмы ЦНС, путём пептидергической иннервации сосудистых стенок (котрансмиттеры в нервных терминалях), паракринной регуляции (эндотелиальные факторы и др.), гормональных эффектов благодаря циркуляции в потоке крови. Вследствие этого отчасти размывается чёткое разделение границ нервной, гормональной и метаболической регуляции сосудов, действующих в рамках единого нейроиммунноэндокринного интегративного аппарата (Owman С., 1990). Особенность пептидергической регуляции гомеостаза – способность к быстрому синтезу и освобождению соответствующих пептидов с высокой биологической активностью в нужное время и в нужном месте по правилу «что – где – когда» (Ашмарин И.П., Обухова М.Ф., 1986; Хавинсон В.Х. и др., 2002).
В связи с этим следует упомянуть о роли дисперсной (диффузной) эндокринной системы или APUD- системы, содержащей пептидо- и аминопродуцирующие клетки. Они имеют паранейрональное происхождение из эктодермы нервного гребня, а также эндодермы и мезодермы. Многие пептиды содержатся не только в нервной системе, но и в апудоцитах – вазоконстрикторы (нейропептид Y) и вазодилататоры (вещество Р; вазоактивный интестинальный пептид; кальцитонин- ген- родственный пептид и др.); они участвуют в местной регуляции тканей. Апудоциты и нейроны, содержащие те же пептидные регуляторы, объединяются в единую диффузную нейроэндокриную систему (ДНЭС). APUD-система имеет клиническую значимость в основном для внутренних органов.
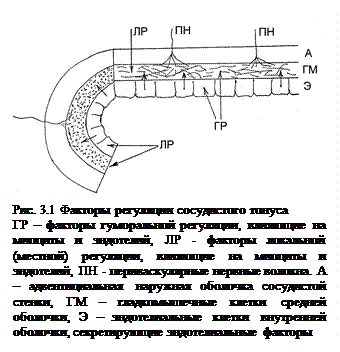
Участие эндотелия в регуляции сосудов. Мощный компонент гистометаболической регуляции – система эндотелиальных клеток, осуществляющая влияния интравазально путем паракринной регуляции. По Burnstock G. (1993), активно поддерживающему концепцию двойного регуляторного контроля (dual regulation) сосудистой стенки, состояние сосудистого тонуса в каждом конкретном сосудистом ложе есть результат взаимодействия в основном двух систем – нервной и эндотелиальной, т.к. многие локальные метаболиты, биофизические факторы, гуморальные вещества опосредуют свое влияние через эндотелий благодаря наличию специфических рецепторов на его мембране. Нарушения их баланса в сторону преобладания одного из них может служить основой расстройств сосудистой регуляции.
Дата: 2019-02-02, просмотров: 502.