Лазерная допплеровская флоуметрия МИкроциркуляции крови
Руководство для врачей
Под редакцией
д.м.н. А.И. Крупаткина, к.т.н. В.В. Сидорова

Москва: ОАО «Издательство «Медицина», 2005
СОДЕРЖАНИЕ
Предисловие............................................................................................................... 3
Список сокращений.................................................................................................. 5
РАЗДЕЛ 1
МЕТОДИЧЕСКИЕ АСПЕКТЫ ДИАГНОСТИКИ СОСТОЯНИЯ
МИКРОЦИРКУЛЯЦИИ КРОВИ. – Крупаткин А.И., Сидоров В.В........................... 6
Глава 1. Метод лазерной допплеровской флоуметрии............................................ 6
1.1. Физические основы метода ЛДФ....................................................................... 6
1.2. Диагностическое значение ритмов колебаний кровотока в микроциркуляторном русле 14
Литература................................................................................................................... 24
Глава 2. Морфологические особенности сосудистого русла.................................. 26
2.1. Общие сведения о морфологии сосудистого русла......................................... 26
2.2. Сосудистая система кожи и подлежащих тканей............................................. 32
Литература................................................................................................................... 34
Глава 3. Физилогические основы функционирования и регуляции тканевого сосудистого русла...................................................................................................................................... 36
3.1. Регуляция сосудистого тонуса........................................................................... 37
3.1.1. Тонус кровеносных сосудов.......................................................................................................... 37
3.1.2. Механизмы регуляции тонуса сосудов...................................................................................... 39
3.2. Физиологические основы функционирования периваскулярной иннервации.. 56
3.3. Регуляция нутритивного русла и транскапиллярного обмена.......................... 68
3.4. Влияние реактивности стенок сосудов на результирующий эффект регулярных влияний 74
3.5. Особенности регуляции разных звеньев сосудистого русла и тканей конечностей 77
Литература................................................................................................................... 80
Глава 4. Диагностика функционального состояния микроциркуляции крови методом ЛДФ 83
4.1. Диагностические характеристики базального кровотока................................... 84
4.2. Диагностика микрососудистого тонуса.............................................................. 89
4.3. Функциональные пробы....................................................................................... 91
4.3.1. Дыхательная проба.......................................................................................................................... 91
4.3.2 Постуральная (ортостатическая) проба..................................................................................... 94
4.3.3. Холодовая проба.............................................................................................................................. 97
4.3.4. Тепловая проба. Н.К. Чемерис, Г.М.Пискунова........................................................................ 102
4.3.5. Окклюзионная проба Н.К. Чемерис, Г.М.Пискунова............................................................... 107
4.3.6. Фармакологическая проба с ацетилхолином Н.К. Чемерис, Г.М.Пискунова.................. 111
4.3.7. Электростимуляционная проба.................................................................................................... 116
4.4. Рекомендации для проведения функциональной диагностики регуляции микроциркуляторного русла............................................................................................................................. 119
Литература................................................................................................................... 122
ПРЕДИСЛОВИЕ
В книге обобщены результаты исследований состояния микроциркуляции крови методом лазерной допплеровской флоуметрии (ЛДФ).
Современный рынок медицинской аппаратуры предлагает пытливому клиницисту, желающему иметь в своем распоряжении полноценные сведения о состоянии тканевой микроциркуляции, крайне ограниченный выбор средств. Эта ограниченность обусловлена, с одной стороны, жесткими требованиями к неинвазивности и безвредности проведения исследований у человека, а с другой – необходимостью получения максимальной информации о тех нарушениях регуляторных механизмов, которые подлежат коррекции. С этих позиций использование метода ЛДФ со спектральным анализом колебаний кровотока является одним из наиболее целесообразных подходов.
Обладая высокой чувствительностью к изменениям микрогемодинамической ситуации в сосудистом русле, метод ЛДФ имеет неоспоримое преимущество перед другими методиками исследования микроциркуляции оценивать состояние функционирования механизмов управления кровотоком. Ежегодно только в русскоязычной литературе публикуется более 100, а в мировой – более 500 работ, выполненных с применением этого метода. В то же время до сих пор нет современного руководства, обобщающего последние достижения в этой области. Основные англоязычные монографии опубликованы более 10 – 15 лет назад еще до применения характеристик колебательных процессов для диагностики состояния микроциркуляторного русла и предлагают ограниченный набор подходов к оценке базального кровотока.
Предлагаемая читателю монография является первым русскоязычным руководством, где систематизированы основные сведения о лазерной допплеровской флоуметрии и ее клиническом применении как в условиях физиологического покоя, так и при функциональных нагрузках. В данном издании подробно рассмотрены собственные и представленные в мировой литературе диагностические подходы для исследования микроциркуляции, основанные на медленных колебаниях кровотока. Известно, что контроль нервной и гуморальной систем за состоянием микроциркуляции крови осуществляется через феномен медленных колебаний, несущих диагностическую информацию о внутренней организации микрокровотока. В последнее десятилетие несколькими исследовательскими коллективами, в основном европейскими, проведен цикл исследований, направленных на выяснение природы осцилляций кровотока, и подтвердивших правильность представленных в книге диагностических методик.
Содержание данной книги является результатом коллективного труда российских исследователей. Монография включает общую часть, освещающую методические аспекты, их анатомо-физиологическое обоснование, и частный раздел, где рассматриваются особенности использования метода при конкретных нозологических формах. Результаты исследований получены с применением комплекса отечественной аппаратуры, лазерных анализаторов микроциркуляции крови серии ЛАКК.
Руководство ориентировано как на врачей функциональной диагностики, так и клиницистов всех специальностей, научных работников, занимающимися проблемами оценки тканевой микроциркуляции.
Авторы
www.lazma.ru
Список принятых сокращений
А – амплитуда колебаний кровотока
АВА – артериоло-венулярный анастамоз
АД – альвеолярная десна
АДГ – антидиуретический гормон
АХ – ацетилхолин
АЧС – амплитудно-частотный спектр колебаний кровотока
БПФ – быстрое преобразование Фурье
ВИП – вазоактивный интестинальный пептид
ГТМ – гемодинамический тип микроциркуляции
ДП – дыхательная проба
ЖЕЛ – жизненная емкость легких
КА – катехоламины
КБМС – метод конъюктивальной биомикроскопии
КГРП – кальцитонин-ген-родственный пептид
КРБС – комплексный регионарный болевой синдром
КТ – компьютерная томография
ЛДФ – лазерная допплеровская флоуметрия
М – постоянная составляющая перфузии
МД – маргинальная десна
МЛТ – магнитно-лазерная терапия
МТ – миогенный тонус
МЦР – микроциркуляторное русло
НY – нейропептид Y
НА – норадреналин
НП – нитропруссид натрия
НТ – нейрогенный тонус
ОП – окклюзионная проба
ПАПН – полный анатомический перерыв смешанного нерва
ПД – прикрепленная десна
ПК – пальцевой кровоток
ПМ – показатель микроциркуляции
ПП – постуральная проба
Пф.ед. – перфузионные единицы
ПШ – показатель шунтирования
РК – резерв кровотока
РНР – резерв нейромедиаторной регуляции
СВР – симпатический вазомоторный рефлекс
ТМЕ – типовая (типичная) микроциркуляторная единица
ФЖЕЛ – форсированная жизненная емкость легких
ФЭО – функциональный элемент органа
ХОБЛ – хроническая обструктивная болезнь легких
ХП – холодовая пробы
ЭЗКТ – эндотелиально-зависимый компонент сосудистого тонуса
ЭИ – эндогенная интоксикация
l – длина волны зондирующего излучения
s – среднеквадратическое отклонение колебаний перфузии
n – показатель преломления излучения в ткани
Nэр – количество эритроцитов в зондируемом объеме
V – скорость эритроцитов
Vср – средняя скорость эритроцитов в зондируемом объеме
Δf – допплеровский сдвиг частоты
ΔПМ (t) – переменная составляющая перфузии
РАЗДЕЛ I
Глава 1
Формирование ЛДФ-сигнала
В методе ЛДФ выходной сигнал непрерывно регистрируется в течение времени исследований, и диагностика состояния микроциркуляции крови основывается на анализе графической записи изменений перфузии, которая называется ЛДФ-граммой.
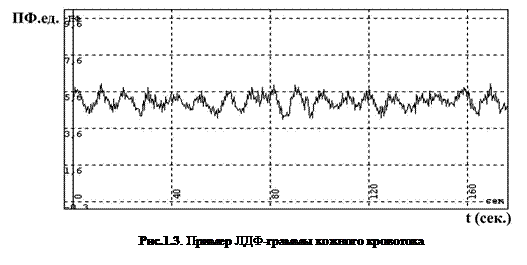
На рис.1.3 представлена характерная ЛДФ-грамма кожного кровотока на мониторе компьютера. Ось ОХ – это время записи (t) в секундах, ось OY – показатель микроциркуляции ПМ в относительных перфузионных единицах (пф.ед.).
ЛДФ-сигнал имеет постоянную и переменную от времени составляющие, поэтому показатель микроциркуляции (перфузии) можно представить следующим выражением:
ПМ ( t) = М + δПМ ( t), (1.2)
где: М – постоянная составляющая перфузии и δПМ ( t) – переменная составляющая перфузии.
Постоянная составляющая М - это средняя перфузия в микроциркуляторном русле за определенный промежуток времени исследований или за выбранный временной интервал анализа ЛДФ-граммы. Именно постоянная составляющая перфузии М является тем параметром, который сравнивают, когда диагностика основана только на анализе базального кровотока или в ходе исследований оцениваются реакции микроциркуляторного русла на функциональные пробы. Так как перфузия является динамической характеристикой и определяется выражением (1) в единицу времени, то для получения числового значения определяют среднюю величину перфузии в заданном временном интервале:
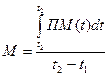 (1.3)
(1.3)
где: t2 – t1 – интервал усреднения. Временной интервал усреднения определяется частотой передачи информации в компьютер для последующей обработки.
Переменная составляющая ЛДФ-сигнала δПМ ( t) обусловлена факторами, влияющими на постоянство потока крови в микроциркуляторном русле, то есть связана с обстоятельствами, изменяющими величину скорости Vср и концентрацию Nэр эритроцитов. Характер изменения величины δПМ ( t) определяется вариациями во времени как просветами сосудов, их внутренними диаметрами, которые контролируются активными механизмами, так и пассивными факторами в системе микроциркуляции (Schmid-Schonbein H.et.al., 1992).
Колебания перфузии регистрируются в виде сложного, непериодического процесса. Многие авторы отмечали, что режимы хаотических колебаний в физиологических системах более оптимальны для их существования, чем периодические (Трубецков Д.И., 2004). Исследования динамических процессов у здоровых индивидуумов свидетельствует о том, что наблюдаемый «хаос» присущ самой природе динамического процесса в организме. Та или иная степень хаотичности, характеризующая режим функционирования здорового индивидуума, может изменяться вследствие патологии в ту или иную сторону (Анищенко В.С., 2002). Любая биологическая система должна быть колебательной для того, чтобы она могла сохраниться и не погибнуть. Неэлектрические колебания проявляются в виде временных изменений концентрации химических веществ и механических колебаний. Поддержание незатухающих колебаний осуществляется в результате присутствия регуляторных факторов и механизмов обратной связи (Флейшман А.Н., 1999).
Активные факторы контроля микроциркуляции (факторы, непосредственно воздействующие на систему микроциркуляции) – это эндотелиальный, миогенный и нейрогенный механизмы регуляции просвета сосудов, тонуса сосудов. Эти факторы контроля регуляции модулируют поток крови со стороны сосудистой стенки и реализуются через ее мышечный компонент.
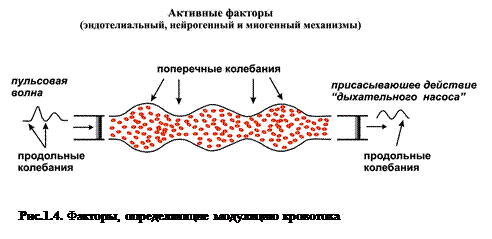
Пассивные факторы (факторы, вызывающие колебания кровотока вне системы микроциркуляции) – это пульсовая волна со стороны артерий и присасывающее действие «дыхательного насоса» со стороны вен. Эти колебания проникают с кровотоком в зондируемую область, так как микроциркуляторное русло, являющееся составной частью системы кровообращения, топографически расположено между артериями и венами.
Влияние активных и пассивных факторов на поток крови приводит к изменению скорости и концентрации потока эритроцитов. Эти изменения вызывают модуляцию перфузии, определяемую выражением (1.1), регистрируются в виде сложного колебательного процесса (рис.1.3).
Активные механизмы создают поперечные колебания (рис.1.4) кровотока в результате чередования сокращения и расслабления мышц сосудов (сменяющие друг друга эпизоды вазоконстрикции и вазодилатации). Пассивные факторы организуют продольные колебания кровотока, выражающие в периодическом изменении объема крови в сосуде. В артериолах характер изменения объема определяется пульсовой волной, в венулах – рабочим ритмом «дыхательного насоса».
В переменной составляющей δПМ ( t) содержится ценная информация о модуляции кровотока. Ее расшифровка, анализ и интерпретация позволяет диагностировать состояние сосудистого тонуса и механизмов регуляции кровотоком в микроциркуляторном русле. Если постоянная составляющая ЛДФ-сигнала М характеризует величину перфузии, то δПМ ( t) – механизмы контроля за перфузией.
Таким образом, для диагностики патофизиологического состояния микроциркуляторного русла следует анализировать обе составляющие, причем величина М является дополнительным, справочным параметром.
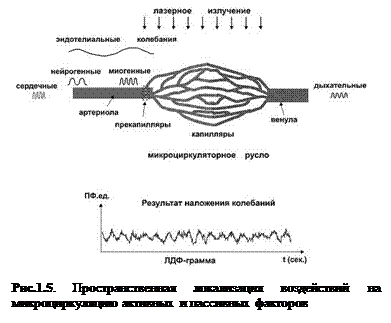
Исполнительным объектом или «мишенью» активных факторов контроля является мышечный компонент сосудистой стенки. Пассивные факторы также влияют на сосудистую стенку посредством колебаний кровотока. На рис.1.5 схематично показана пространственная локализация воздействий на мышцы сосудистой стенки активных факторов. В физиологических условиях мишенью нейрогенной регуляции являются артериолы и артериоло-венулярные анастомозы, миогенная регуляция в чистом виде локализована на прекапиллярах и сфинктерах, эндотелиальная регуляция диаметра сосудов затрагивает преимущественно прекапиллярное звено (артерии, артериолы, прекапилляры). В капиллярах регистрируются миогенные и пульсовые колебания, проникающие с кровотоком при движении через прекапилляры (Meyer M.F. et.al. 2003). Регистрируемый в ЛДФ-грамме колебательный процесс является результатом наложения колебаний, обусловленных активными и пассивными факторами.
Вариабельность ЛДФ-сигнала
Регистрируемые в ходе исследований ЛДФ-граммы могут отличаться у разных пациентов на одной области исследований в силу индивидуальных особенностей микроциркуляторного русла, у одного и того же пациента - в разное время суток, в различные дни и недели (Сидоров В.В. и др., 2003).
Вариабельность ЛДФ-сигнала обусловлена пространственной неоднородностью распределения кровеносных сосудов тестируемой области и временной изменчивостью перфузии ткани.
Пространственная гетерогенность
В работе Braverman I.M., (1990) представлены данные по анатомической пространственной неоднородности распределения кровеносных сосудов в дерме, полученные экспериментальным путем в локальном объеме ткани с проведением компьютерной реконструкции анатомии кровеносных сосудов кожи. Картина васкуляризации дермы представляет собой пространственные зоны с насыщенным содержанием артериол и венул, расположенных друг от друга на расстоянии от 1,5 до 7 мм. Эти зоны соединены между собой одним или несколькими сосудами («vascular bridges»).
Указанные зоны окружены участками ткани, где отсутствуют артериолы и венулы. Характерный диаметр таких участков составляет от 0,3 до 0,6 мм. Эти данные по пространственной гетерогенности объясняют микро-ливедо, сетчатую синеватую окраску кожи или красную сетку при гиперемии.
При лазерном зондировании и приеме отраженного сигнала световодным зондом, имеющим «входное окно» диаметром около 1 мм наличие указанной сосудистой организации дермы может привести к нескольким ситуациям, когда световодный зонд может быть случайно установлен на следующие васкулярные зоны:
– зону с большим числом артериол и венул;
– периферическую область указанной выше зоны с артериолами и венулами. Это область с преобладанием венулярных сосудов;
– участок дермы, где отсутствуют артериолы и венулы.
Из-за пространственной анатомической неоднородности распределения микрососудов в дерме ЛДФ-сигнал может быть высоким, средним или низким. Его величина может составлять 100, 75 или 25% от наибольшего значения (Tenland T., 1982).
Временная вариабельность
Временная изменчивость кровотока обусловлена адаптационными способностями микроциркуляторного русла. Изучение временных вариаций проводилось (Tenland T., 1982) на различных областях: лоб, предплечье, кончики пальца, дорсальная поверхность кожи. ЛДФ-грамма регистрировалась в течение 20 минут, среднее значение перфузии определялось последовательно каждые 30 сек. Разброс относительных величин ЛДФ-сигнала составил от 4 до 11% на предплечье и от 8 до 19% на лбу. Отмечается, что в области кожи, богатой артериоло-венулярными анастомозами (кончике пальца), разброс величины ЛДФ-сигнала меньше, чем на ткани с меньшим числом шунтов. Значительная вариабельность отмечалась также при исследованиях в течение 4 дней, день за днем, в одно и то же время суток на указанных областях. Величины сигналов отличались в несколько раз.
Функционирование эндотелиального, нейрогенного и миогенного механизмов контроля микроциркуляции, их активность или период «молчания» определяются рядом субъективных и внешних факторов. Так, например, в зависимости от температуры окружающей среды при исследованиях на волярной поверхности пальца здорового человека при 18°С обнаруживается преимущественно активная вазоконстрикция, обусловленная нейрогенной регуляцией, она незначительно проявляется в диапазоне 21-24°С и отсутствует при 27°С. (Schmid-Schonbein H.et.al., 1992).
Литература
1. Анищенко В.С. Знакомство с нелинейной динамикой, М. 2002.
2. Исимару А. Распространение и рассеяние волн в случайно-неоднородных средах, Т. 1, Мир, М., 1981.
3. Коняева Т.И., Красников Г.В., Танканаг А.В., Пискунова Г.М., Сидоров В.В., Чемерис Н.К. Оценка чувствительности показателей микроциркуляции к оксиду азота и ацетилхолину. //Материалы международной конференции «Гемореология и микроциркуляция» , Ярославль, 2003, стр. 133.
4. Крупаткин А.И. Клиническая нейроангиофизиология конечностей (периваскулярная иннервация и нервная трофика). - М.: Научный мир,2003.-328с.
5. Крупаткин А.И., Сидоров В.В., Меркулов М.В. и др. Функциональная оценка периваскулярной иннервации конечностей с помощью лазерной допплеровской флоуметрии. Пособие для врачей. М., 2004.- 26с.
6. Микроциркуляция в кардиологии, под ред. В.И. Маколкина, изд.«Визарт», М., 2004.
7. Сидоров В.В., Ронкин М.А., Максименко И.М., Щербанина В.Ю., Уколов И.А. Физические основы метода лазерной допплеровской флоуметрии и его применение в неврологической практике.// Биомедицинские технологии и радиоэлектроника, 2003, №12, стр. 26-35.
8. Трубецков Д.И. Введение в синергетику. Хаос и структуры, М.,2002.
9. Флейшман А.Н. Медленные колебания гемодинамики, Новосибирск, «Наука» 1998.
10. Фолков Б., Нил Э. Кровообращение. М., 1976.
11. Almond N. Laser Doppler flowmetry: Theory and practice, Laser Doppler. – London, Los Angeles, Nicosia, Med-Orion Publishing Company, 1994, p. 17 – 31.
12. Anderson R.R., Parrish J.A., The optics of human skin. //J. Invest. Dermatol., 1981,v.77, p.13.
13. Bollinger A., Yanar A., Hoffmann U., Franzeck U. K. Is High-Frequency Flux Motion due to Respiration or to Vasomotion Activity? // Progress in Applied Microcirculation. Basel, Karger, 1993, vol. 20, p 52-58.
14. Borgos J. Principles of instrumentation: Calibration and technical issues. Laser Doppler. – London, Los Angeles, Nicosia, Med-Orion Publishing Company, 1994, p. 3 – 16.
15. Braverman I.M., Keh A. and Goldminz D. Correlation of laser Doppler wave patterns with underlying microvascular anatomy. //J. Invest. Dermatol., 1990, v.95, p.283,
16. Chambers R., Zweifach B.W. Functional activity of the blood capillary bed, with special reference to visceral tissue. // Ann NY Acad Sci., 1944, v. 46, pp. 683-694.
17. Fagrell B. Problems using laser Doppler on the skin in clinical practice, Laser Doppler. – London, Los Angeles, Nicosia, Med-Orion Publishing Company, 1994.
18. Kvandal P., Stefanovska A., Veber M., Kvernmo H.D.,Kirkeboen K.A. Regulation of human cutaneous circulation evaluated by laser Doppler flowmetry, iontophoresis, and spectral analysis: importance of nitric oxide and prostangladines. // Microvascular Research 2003, v.65, pp. 160-171.
19. Kvernmo H.D., Stefanovska A., Kirkeboen K.A., Kvernebo K. Oscillations in the Numan Cutaneous Blood Perfusion Signal Modified by Endothelium-Dependent and Endothelium –Independent Vasodilators. // Microvascular Research, 1999, v.57, pp.298-309.
20. Mayer M.F., Rose C.J., Hulsmann J.-O., Schatz h., Pfonl M. Impaired 0.1 – Hz vasomotion assessed by laser Doppler anemometry as an early index of peripheral sympathetic neuropathy in diabetes. //Microvascular Research, 2003, v.65, pp. 88-95.
21. Nakata A., Takata S., Yuasa T. et al. Spectral analysis of heart rate, arterial pressure and muscle sympathetic nerve activity in normal humans // Am. J. Physiol.- 1998.- v.274.- pp. H1211- H1217.
22. Rosenbaum M., Race D. Frequency-response characteristics of vascular resistance vessels// Am.J.Physiol.-1968.-v.215.-pp.1397-1402.
23. Schmid – Schonbein H., Zied S., Rutten W. and Heidtmann H. Active and passive modulation of cutaneous red cell flux as measured by Laser Doppler anemometry. //VASA , 1992, v.34, Suppl. p. 38-47.
24. Stefanovska A., Bracic M. Physics of the human cardiovascular system. // Contemporary Physics, 1999,v. 40, N 1, p.31-35.
25. Schmid – Schonbein H., Ziege S., Grebe R., Blazek V., Spielmann R., Linzenich F. Synergetic Interpretation of Patterned Vasomotor Activity in Microvascular Perfusion : Descrete Effects of Myogenic and Neurogenic Vasoconstriction as well as Arterial and Venous Pressure Fluctuations.// Int J. Microcir. 1997; 17, pp. 346-359.
26. Tenland T. On Laser Doppler Flowmetry. Methods and Microvascular Application, Printed in Sweden by VTT-Gafiska, Vimmerby, 1982.
Глава 2
Структура венозной стенки
Среднее давление в венозном русле низкое: от 15-20 мм рт. ст. в посткапиллярах до 10 и менее мм рт. ст. в крупных венах; для сравнения в артериолах - 35-70 мм рт. ст., а в русле прекапиллярных распределителей - 30-35 мм рт. ст. Поэтому стенка вен тоньше, имеет менее развитую внутреннюю и среднюю оболочки, особенно по содержанию эластических элементов. В то же время противодействие пассивным, особенно экстравазальным факторам внешнего сдавления, а также силе тяжести, особенно на нижних конечностях, обусловливает необходимость развитой гладкой мускулатуры, в том числе в наружной оболочке. Адвентициальный слой вен шире, чем у артерий, причем vasa vasorum кровоснабжают все три оболочки вен; мышечные слои имеют как циркулярное, так и чаще продольное направление; последние противодействуют внешним силам и вазоконстрикторному эффекту циркулярных мышц. Гидростатическому давлению противостоит клапанный аппарат, в том числе на уровне венул.
Традиционно выделяют вены мышечного типа и безмышечные вены. Вены безмышечного типа характерны для костей конечностей. Их стенки плотно сращены со стенками костной полости и не спадаются, в связи с чем кровь легко оттекает в крупные вены.
Среди вен мышечного типа выделяют вены со слабым развитием мышечных элементов (средние и мелкие вены, сопровождающие артерии мышечного типа, в основном верхних конечностей) и с сильным развитием мышечных элементов (в основном, более крупные вены нижних конечностей). В первых развит циркулярный мышечный слой в средней оболочке, а во вторых мышечные элементы имеются во всех трех слоях, причем преобладает их продольное направление.
Тем самым, тонкостенность вен, низкие упруго-эластические свойства, преобладание роли продольных мышечных слоев обусловливают большую, чем у артериальных сосудов зависимость от пассивного растяжения кровью и наружного сдавления, низкий базальный тонус и относительную дилатацию в покое. В диагностическом аспекте, например, при анализе рефлекторных нейрогенных влияний трудно количественно учесть и нивелировать in vivo пассивные механизмы регуляции тонуса. Поэтому в некоторых случаях выбор в качестве объекта клинической диагностики венозных сосудов менее «удачен» по сравнению с артериальным звеном.
Шунтирующие сосуды
В основном они регулируют кровоток и сосудистое давление сегмента конечности, перераспределяя кровенаполнение тканей, участвуют в мобилизации депонированной крови, в процессах терморегуляции. Для этого шунтирующим сосудам необходима способность к сильной констрикции и дилатации, а значит, и сосудистая стенка с развитым мышечным компонентом. Особенность артерило-венулярных анастомозов – исключительная зависимость тонуса их артериолярных отделов от нейросинаптической адренергической регуляции. В конечностях артериоло-венулярные анастомозы расположены преимущественно в коже акральных дистальных зон (подушечки пальцев кисти и стопы, зоны тенара и гипотенара, ногтевые ложа). По гистологической структуре это анастомозы I типа (с эпителиально-подобными мышечными элементами артерий)- простые однолинейные или сложно-разветвленные; имеют как артериальную, так и венозную части. Их внутренняя и наружная оболочки сходны по структуре с артерией (рисунок 2.1). В средней оболочке артериальной части представлены наружные циркулярные и внутренние продольные гладкомышечные пучки; в венозной части выражены циркулярные пучки, а продольные трансформированы в эпителиоидные элементы. Некоторые авторы называют артериальную часть анастомоза «афферентной артерией» (Гистология…1963).
Структура капилляров
Капилляры - это обменные микрососуды, в связи с чем их стенка максимально истончена для оптимального функционирования. Она состоит из двух оболочек - внутренней эндотелиальной и наружной адвентициальной, между которыми расположена базальная мембрана в виде белково-липидно-мукополисахаридного комплекса толщиной 300-350 ангстрем. В коже и мышцах капилляры построены по соматическому типу (Чернух А.М и др.,1984). Их эндотелий непрерывен с малым числом пор в отличие от фенестрированной структуры висцеральных капилляров, например, кишечника. Одна крупная пора приходится на 3 х 104 мелких пор (Козлов В.И. и др.,1994).
В капиллярах нет гладкомышечных клеток и они не сокращаются. Однако ряд авторов считают, что функция сократимости присуща эндотелиальным клеткам в связи с наличием микрофибрилл цитоплазмы и необходима для оптимального транскапиллярного обмена (транспорта веществ, регуляции размеров пор). Доказано наличие сократительного аппарата эндотелиальных клеток, включающего белки актин и миозин, а также связанные с ними ферментные системы регуляции. При этом сокращение осуществляется по Са+2- зависимому пути, что приводит к открытию межклеточных пространств и порообразованию (Dull O.R.,Garcia G.N., 2002).
В адвентиции находятся клетки Руже (перициты), а снаружи капилляров много рыхлой соединительной ткани с клеточными элементами (макрофаги, фибробласты, тучные, жировые клетки и др.).
В поперечно-полосатых мышцах и нервах представлены узкие капилляры диаметром 4,5 – 7 мкм, сопоставимые с размерами клеток крови, а в коже более широкие (7 – 11 мкм) в виде петель с артериальными (шириной около 7,6 мкм) и венозными (шириной около 9,1 мкм) браншами. В соответствии с гемодинамическими потребностями тканей в коже их около 40 на мм2 , а в скелетных мышцах – 1400 на 1 мм2.. Однако в состоянии физиологического покоя конечностей до 50% капилляров не функционируют и представляют собой плазматические капилляры без клеток крови (Чернух А.М. и др.,1984). Синаптическая иннервация капилляров отсутствует, но в перикапиллярном пространстве имеются свободные нервные окончания, паракринно бессинаптически выделяющие нейропептиды и другие вещества, способные влиять на транскапиллярный обмен и соседние клетки тканей (собственно трофическая функция нервов). Для осуществления последней особенно важна локальная антидромная деятельность сенсорных волокон.
Глава 3
Тонус кровеносных сосудов
Сосудистый тонус (tonus (лат.) – напряжение) – это «общее сокращение сосуда» (Морман Д., Хеллер Л., 2000); «непрерывное, протекающее без утомления тоническое сокращение сосудов» (Парин В.В., Меерсон Ф.З., 1965); «сумма сил, противодействующих растягивающему усилию артериального давления» (Хаютин В.М., 1964, 1977). Величина сосудистого тонуса обусловлена результирующим влиянием как минимум трех факторов – трансмурального внутрисосудистого давления, упруго-эластическими свойствами структур сосудистой стенки и степенью сокращения их гладкой мускулатуры. Если первый отчасти придается сосудистому ложу конечностей извне, второй обусловлен морфогенетически, то третий наиболее изменчив и подвержен регулирующим воздействиям. Поэтому, как справедливо отмечают Морман Д., Хеллер Л. (2000), «понятие сосудистый тонус отдела организма может использоваться как показатель уровня активности отдельных гладкомышечных клеток данной области», хотя и подчеркивают, что «эта связь является статистическим понятием, так как редко бывает, что все клетки сосуда или все сосуды в определенной области функционируют абсолютно идентично». Удачно определение сосудистого тонуса Берштейна С.А. с соавт. (1984) как состояния «длительно поддерживаемого возбуждения гладкомышечных клеток, которое проявляется в соответствующем уровне их сократительной активности и не сопровождается развитием утомления». Следует также привести определение спазма сосуда как длительного сокращения, препятствующего нормальной работе органа.
Выделяют миогенный (по нашему мнению его иногда не корректно отождествляют с базальным) и нейрогенный (вазомоторный) компоненты сосудистого тонуса. Миогенный компонент – это «та часть сокращения гладкой мускулатуры сосудов, которая не зависит от вазоконстрикторных симпатических импульсов» (Парин В.В., Меерсон Ф.З., 1965); благодаря базальному миогенному компоненту артериолы остаются частично суженными даже после устранения всех внешних воздействий.
Природа базального тонуса окончательно не ясна. Её связывают с активностью гладкомышечных клеток-пейсмекеров, способных к спонтанной деполяризации, в артериолах, прекапиллярах, сфинктерах. Это обусловливает миогенную автоматию сосудистых гладких мышц с фазными сокращениями (Meyer J.U., et al., 1988). Существует ли эндогенная спонтанная активность в артериях, до сих пор неясно. Golenhofen K. (1976) выделяет три типа гладкомышечных клеток сосудистой стенки : 1-большинство клеток имеет ритмическую активность и не отличается по свойствам возбуждения и проведения (например, гладкая мускулатура воротной вены крысы) , 2- часть гладкомышечных клеток генерирует возбуждение, а часть обладает только функцией проведения, 3- большинство гладкомышечных клеток активируются нейрогенно и в покое пейсмекерная активность не проявляется (например, в крупных артериях); в то же время при уменьшении проведения К+ можно «заставить» клетки генерировать потенциал действия, например, in vitro введением в экспериментальную среду тетраэтиламмония. Есть гипотезы, что в этих сосудах базальный тонус обусловлен наличием открытых кальциевых каналов.
На миогенный тонус могут влиять внесинаптические факторы гормональной и местной гуморальной регуляции, в том числе нейропептиды, эндотелиальные метаболиты, растяжение циркулирующей кровью и др. Однако, с точки зрения пейсмекерного механизма они представляют собой внешние влияния на гладкую мускулатуру и не являются причинными факторами базального тонуса. Базальный тонус- это тот биологический ноль, от которого ведут отсчёт вазоконстрикторные или вазодилататорные воздействия, возникающие миогенными или нейрогенными путями. Даже в условиях физиологического покоя на гладкую мускулатуру влияют постоянно секретируемые эндотелиальные и другие факторы, в связи с чем понятие базального тонуса смазывается. Поэтому в клинике при оценке факторов, влияющих на гладкую мускулатуру сосудов миогенным путём, физиологически более корректно применять термин «миогенный тонус».
Нейрогенный компонент связан с поступлением вазоконстрикторных импульсов по постганглионарным адренергическим симпатическим волокнам. В покое за счёт спонтанной симпатической активности частотой в среднем 1-3 импульса в секунду тоническая вазоконстрикторная иннервация гладкой мускулатуры сосудов поддерживается всегда. Известно, что при низкой частоте симпатических импульсов нервная регуляция обеспечивает нейрогенные осцилляции кровотока. Источник тонической активности преганглионарных нейронов (ПН) неясен, но предположительно находится в надсегментарных структурах, в том числе бульбарных. Тоническую активность нервных центров в условиях физиологического покоя следует отличать от фазической рефлекторной в ответ на афферентные влияния. Вследствие возможности их независимых изменений разделение этих параметров принципиально для клинической диагностики. Существует не всеми разделяемое мнение, что бульбарный вазомоторный центр играет основную роль в поддержании тонической активности ПН и исходного нейрогенного тонуса, а спинальный – в реализации его фазической рефлекторной регуляции.
Выделяют понятие «тонуса покоя» как результирующей величины миогенного и нейрогенного компонентов в физиологических условиях. В остром периоде полной денервации сосудов периферическое сопротивление в покое определяется только миогенным тонусом и содержанием катехоламинов (преимущественно, адреналина) сыворотки крови. По мере развития денервационной гиперчувствительности повышается восприимчивость денервированных сосудов к циркулирующим катехоламинам. В количественном выражении тонус покоя имеет смешанную миогенную и нейрогенную природу. Традиционные попытки раздельной оценки одного из них сводились к устранению другого. Например, устранить нейрогенный компонент возможно при полной десимпатизации конечности или фармакологически с помощью больших доз ганглиоблокаторов в эксперименте. При этом сосудистое сопротивление конечности снижалось на величину вазомоторного тонуса. Эти подходы к изолированной оценке нейрогенного компонента не применимы для повседневной клинической практики. Поэтому для анализа нейрогенного и миогенного тонуса сосудов создана новая оригинальная методология на основе лазерной допплеровской флоуметрии. (Крупаткин А.И., 2003; Крупаткин и др., 2004). До сих пор в физиологии и клинической практике раздельная неинвазивная оценка влияния нейрогенных и миогенных факторов на микрогемодинамику была невозможна.
Регуляторы роста сосудов
Агонисты
Рецепторы
Эндотелиоцит
Миоцит
Для регуляции сосудов кожи важное значение имеют циркулирующие катехоламины – норадреналин (НА) и адреналин, представляющие гормональный компонент общей симпато-адреналовой системы организма. При этом если медиаторный невральный компонент представлен НА симпатических терминалей, то гормональный – секретом мозго-вого слоя надпочечников - в основном адреналином (80%), а также НА (20%); секретирующие их клетки гомологичны постганглионарным симпатическим нейронам. Если НА как нейротрансмиттер влияет через синапс и a1 - адренорецепторы постсинаптической мембраны, то гормоны мозгового слоя надпочечников – на внесинаптические специфические рецепторы сосудов (a2, b2), являясь их дистантными раздражителями. Есть мнение, неразделяемое всеми исследователями, что катехоламины крови не инактивируются путем обратного захвата в симпатических терминалях в отличие от нейрогенного НА.
Различают a и b- адренорецепторы, участвующие в регуляции гладкой мускулатуры сосудов. При классификации адренорецепторов учитывают их чувствительность к агонистам и антагонистам, идентификацию по радиолигандам, а не только функцию и локализацию. Постсинаптические b- рецепторы сосудов конечностей – это в основном b2 – рецепторы. Различают также пресинаптические b - рецепторы или b-аутоадренорецепторы, облегчающие освобождение НА. Для симпатической периваскулярной иннервации предполагается, что это b1-рецепторы.
Среди постсинаптических a-адренорецепторов сосудов выделяют a1 – адренорецепторы ( расположены вблизи нервных терминалей и участвуют в нервно-синаптической регуляции сосудистого тонуса) и a2-адренорецепторы (подвергаются основном действию циркулирующих катехоламинов, хотя могут располагаться и вблизи синаптическихокончаний). Следует упомянуть мнение, что в сосудах человека большинство a- адренорецепторов представляют смешанную популяцию a1 и a2- рецепторов (Сергеев П.В. и др., 2000). Пресинаптические a2-рецепторы или a- аутоадренорецепторы являются тормозными и уменьшают выделение норадреналина из нервных терминалей. Постсинаптические b2-рецепторы при возбуждении снижают сосудистый тонус, а постсинаптические a1- и a2- рецепторы повышают сосудистый тонус, вызывая вазоконстрикцию.
Важная особенность адренорецепторов сосудов состоит в различии их отношения к иннервации: b-рецепторы и частично a2 –рецепторы не иннервируются, в связи с чем могут возбуждаться преимущественно катехоламинами крови, а a1-рецепторы – как НА симпатических адренергических нервных терминалей, так и в патологических условиях катехоламинами крови, например, при денервации сосудов. Кроме того a- адренорецепторы и b1- адренорецепторы проявляют одинаковое сродство к адреналину и НА. Поэтому a- адренергические эффекты определяются плотностью a1 и a2 –адренорецепторов в тканях. b2- адренорецепторы имеют большее сродство к адреналину, чем к НА. В целом, указанные особенности свидетельствуют о возможности неоднозначных результатов нейрососудистых исследований с использованием рефлекторных вазоконстрикторных проб и фармакологических тестов с введением экзогенных катехоламинов в кровь. a1- адренорецепторы доступны только для НА как медиатора симпатических терминалей, а на a2- адренорецепторы может влиять как экзогенный НА, так и определённое количество нейротрансмиттера НА, диффундирующего к a2- рецепторам до момента его инактивации. a1 и a2 –рецепторы по-разному опосредуют влияние на тонус миоцитов сосудов, причём возбуждение a2-рецепторов не приводит к генерации потенциала действия.
Особенности действия катехоламинов мозгового слоя надпочечников на сосуды конечностей представлены в табл. 3.2.
В физиологических условиях при сохранной симпатической иннервации влияние катехоламинов крови на величину сосудистого тонуса клинически не значимо. Существуют отдельные гладкие мышцы с высокой плотностью иннервации (ресничные мышцы или мышцы семенных протоков), обладающие только нервно-мышечной регуляцией; на них не влияют катехоламины крови. В случаях воздействия циркулирующих КА на сосудистую стенку их влияние больше выражено на те участки, которые слабоснабжены периферической иннервацией, например, среднюю оболочку артерий. Чаще этот эффект возможен на уровне крупных артерий эластического типа из-за большой ширины синаптической щели и большого расстояния диффузии медиатора между нервной терминалью и гладкомышечной клеткой. В целом, основной эффект циркулирующих КА надпочечников в физиологических условиях – не столько сосудистый, сколько обменно-метаболический через b-рецепторы органов и тканей: расширение бронхов, увеличение силы сокращения скелетных мышц, активация процессов гликогенолиза в печени и др. Как справедливо отмечают Морман Д. И Хеллер Л. (2000) «функциональное значение … b-рецепторов сосудов не ясно, поскольку освобождение адреналина из надпочечников происходит при увеличении активности симпатического отдела, когда артериолы претерпевают одновременную прямую нейрогенную вазоконстрикцию». Регулирующая роль циркулирующих катехоламинов проявляется в стрессовых условиях (интенсивная физическая работа, геморрагический шок и др.), т.к. в норме их содержание в крови не высоко, чтобы изменить деятельность сосудов. Совершенно иная ситуация возникает в условиях денервации и дефиците неврального пула НА, например, после травм нервов конечностей. Возникает состояние денервационной гиперчувствительности вегетативных тканей-эффекторов, в том числе мышечносодержащих сосудов, к циркулирующим адреналину и НА. Это является проявлением адаптации вегетативных эффекторов к активности иннервирующих их постганглионарных симпатических нейронов - когда иннервация снижается, возрастает чувствительность ткани (Физиология человека…1996). Характерно, что этот эффект проявляется во всех гладкомышечных сосудах, в том числе на уровне приносящего микрососудистого звена.
Таблица 3.2
Конечностей
| Представитель катехоламинов | Рецептор | Действие | Примечание |
| Норадреналин | a2 | Вазоконстрикция | Представляет теоретический интерес в физиологических условиях, т.к.низкое содержание в крови не позволяет конкурировать с нейрогенным пулом |
| Адреналин | a2 | Вазоконстрикция | При высоких концентрациях в крови (сильный стресс, кровотечение) |
| b2 | Вазодилатация | При низких концентрациях в крови (эмоциональное возбуждение, физическая работа). Реакция проявляется в скелетных мышцах, где преобладают b2-адренорецепторы сосудов, в связи с чем возможно возрастание кровотока мышц и снижение в коже. В сосудах кожи преобладают a-адренорецеп-торы и роль b-рецепторов клинически не значима |
И тканей конечностей
Различия нервной и других видов регуляции микрососудистого русла представлены выше (см. таблицу 3.7). Следует отметить, что артериоло-венулярные анастомозы находятся под преимущественным влиянием симпатической вазоконстрикторной иннервации. Поэтому диаметр анастомозов может меняться от закрытия до максимальной вазодилатации под влиянием незначительного изменения симпатической активности. В сосудах сопротивления и прекапиллярных сфинктерах доля миогенного тонуса выше; поэтому в неакральных участках кожи конечностей, где мало анастомозов, десимпатизация приводит к меньшему приросту кровотока, чем при максимально возможной вазодилатации (Кохан Е.П. и др., 1997).
Клинический интерес представляют различия иннервации артериального и венозного звеньев сосудистого русла конечностей. Хотя преимущественная резистивная функция принадлежит артериальному звену, вены наряду с аккумулирующей функцией и участием в возврате крови к сердцу также обладают резистивным компонентом, поддерживая капиллярное давление, и способны отвечать на нейрогенные воздействия. Ввиду большой роли пассивно-эластического компонента стенок вен (спадение их в венах скелетных мышц при снижении внутрисосудистого давления менее 6-9 мм рт.ст. (Фолков Б., Нил Э., 1976), подверженность внешнему сдавлению) различают их пассивные и активные реакции. Пассивные реакции связаны с депонированием крови без непосредственной активной функции гладкой мускулатуры вен, а активные – с констрикцией или дилатацией гладкой мускулатуры, в том числе нейрогенного характера. В то же время венозная рефлекторная реакция неоднозначна (констрикция или дилатация), наступает позднее (по латентному периоду), держится более длительно и дольше достигает максимума (Ткаченко Б.И., 1979). Однако, хотя по сравнению с артериальным резистивным звеном воспроизводимость нейрогенной констрикции вен снижена, но чувствительность вен к симпатическим влияниям высока, а по относительному значению среди других видов активной регуляции тонуса вен симпатические нейрогенные влияния доминируют.
Способность к эндотелий-зависимой вазодилатации также отличается у артерий и вен. В венозных сосудах снижена реакция на АцХ по сравнению с артериями, т.к. в их эндотелии мало М-холинорецепторов, хотя чувствительность к нитратам такая же или превышает артериальную. АцХ активирует образование NO только в артериях, а брадикинин – в артериях и венах (Ignarro L.J., 1989). Эндотелий вен вырабатывает больше эндотелина, чем у артерий, а гистамин вместо расслабления вызывает in vitro эндотелий-зависимое сокращение в v.saphena (Luscher T.E., 1989). Создается впечатление, что эндотелий компенсирует недостаток нейрогенной констриктивной иннервации вен, но вопросы нейроэндотелиальных взаимосвязей вен мало изучены. Как справедливо отмечает Ткаченко Б.И. (1979), «ёмкостная функция сосудов является более сложной для исследования, анализа и интерпретации, поскольку их суммарный ответ определяется участием различных отделов сосудистого русла, а также активными и пассивными механизмами реакций вен на применённый стимул». Следует отметить, что ЛДФ-сигнал при исследовании кожи практически не содержит информации от мышечно-содержащих вен и ограничен в основном информацией о кровотоке по безмышечным венулам. Сравнительная оценка регуляторных механизмов артерий и вен представлена в табл. 3.8.
При анализе данных ЛДФ кожи следует учитывать различия регуляции сосудов кожи и скелетных мышц. В скелетных мышцах кровоток в покое более уравновешен метаболическими потребностями, чем в коже. Возрастание метаболической активности, появление сосудорасширяющих метаболитов вызывает значительное увеличение кровотока за счет снижения тонуса артериол, который в покое выше, чем в коже. Среди вазоактивных метаболитов наибольшую роль играют внеклеточные ионы калия, снижение рО2 тканей, а также повышение осмотического давления внеклеточной жидкости; ионы водорода и рСО2 менее значимы. Повышение активности симпатических адренергических волокон способно привести к ишемии мышц, возрастанию содержания сосудорасширяющих метаболитов, которые нивелируют нейрогенные вазоспастические влияния и ограничивают снижение кровотока. Уменьшение симпатической адренергической активности лишь умеренно увеличивает кровоток, т.к. высок базальный тонус артериол скелетных мышц.
Таблица 3.8
Глава 4
Тестируемая область
Метод ЛДФ не имеет ограничений на выбор тестируемой области, так как световодный зонд может быть установлен практически на любой участок поверхности кожи в зависимости от задач исследования перфузии.
Для оценки общего состояния микроциркуляции или сердечно-сосудистой системы в целом рекомендуется проводить исследования в зоне Захарьина-Геда для сердца на предплечье (Бранько В.В. и др., 1999), расположенной по срединной линии на 4 см выше основания шиловидных отростков локтевой и лучевой костей. Выбор этой области обусловлен тем, что она бедна артериоло-венулярными анастомозами, поэтому в большей степени отражает кровоток в нутритивном русле. При исследованиях в положении лежа на спине или сидя, рука должна находится на уровне сердца. В ходе диагностики, проводимой по единой методике, положение испытуемых должно быть одинаковым.
Ввиду пространственной неоднородности распределения микрососудов и индивидуальных особенностей испытуемых рекомендуется уточнять тестируемый участок кожи вокруг указанной зоны Захарьина-Геда, находя область с наивысшей перфузией, которой соответствует зона с наибольшим числом артериол и венул.
Аналогичные подходы могут быть рекомендованы при выборе других тестируемых областей.
Если необходимо исследовать нейрогенную регуляцию сосудов, то наилучшим объектом служит кожа подушечки 2-ого пальца кисти и 1 пальца стопы, наиболее богатая вегетативными и сенсорными нервными волокнами. При этом область исследования находится ниже уровня сердца.
Условия исследований
Исследования рекомендуется проводить при одинаковой температуре в помещении около 21-24°С. В течение 15 минут до начала диагностики пациент должен находиться в спокойном состоянии, тестируемая область не должен быть прикрыта.
Перед исследованиями испытуемый не должен принимать пищу или напитки, изменяющее состояние микроциркуляции, не курить.
Желательно проводить диагностику в одинаковое время.
Этапы диагностики
Диагностика состояния микроциркуляции крови осуществляется, как правило, в два этапа. На первом этапе исследуется базальный кровоток, второй этап – это проведение функциональных нагрузок на микроциркуляторное русло. Обработка зарегистрированных данных проводится с помощью программного обеспечения.
Функциональные пробы
При ЛДФ исследованиях системы гемомикроциркуляции кожи в клинике для выявления адаптационных резервов системы микроциркуляции, оценки состояния механизмов регуляции тканевого кровотока, а также общего функционального состояния микроциркуляторного русла применяют функциональные пробы. Флоуметрия, дополненная функциональными пробами, позволяет получить характеристики, отражающие не только факт системного и органного нарушения микроциркуляции, но и более детально проследить его патогенез.
К традиционно используемым функциональным пробам, относят следующие:
1. Дыхательная проба (проба с задержкой дыхания) и другие вегетативные вазоконстрикторные пробы.
2. Постуральная проба.
3. Холодовая проба.
4. Тепловая проба.
5. Окклюзионная проба.
6. Фармакологическая (ионофоретическая) проба.
7. Электростимуляционная проба.
Дыхательная проба
Вазомоторный рефлекс, запускаемый быстрым и глубоким вдохом вызывает констрикцию артериол и кратковременное уменьшение кожного кровотока у большинства людей. При проведении дыхательной пробы регистрируют фоновую величину перфузии кровотока, а затем реакцию перфузии в ходе 15-секундной задержки дыхания на высоте глубокого вдоха. При этом на практике достаточно определить среднюю величину степени спада кривой не более, чем для двух вдохов с интервалом 1-2 минуты. Стандартизация глубины вдоха с помощью спирометрии не повышает эффективность диагностики, в связи с чем факт глубокого вдоха достаточен для трактовки результатов (Du Buf-Vereijken et al.,1997).
Впервые вышеупомянутый рефлекс детально описали B.Bolton с соавторами в 1936 году, показавшие также, что вазоконстрикторный ответ зависит от интактности симпатической периферической иннервации - он отсутствовал в пальцах конечности после денервации и десимпатизации. В то же время вазоконстрикторный ответ сохранялся при полной манжеточной окклюзии кровотока верхней конечности, т.е. сохранность перфузии не играет основной роли в его появлении (Bolton B.et al, 1936). При изучении природы этого рефлекса было показано, что афферентная стимуляция возникает при растяжении грудной клетки на глубоком вдохе. Но в ряде работ указывалось на преимущественную роль растяжения грудных вен как инициирующего фактора, т.к. рефлекс вызывался без выраженного растяжения грудной клетки (De Lalla, 1948). Gilliatt R.W. c соавторами (Gilliatt R.W. et al., 1948) наблюдали его у больных с параплегией и полным нарушением функции проводимости спинного мозга выше уровня расположения сегментов симпатической иннервации верхних конечностей. Поэтому высказывались мнения, что рефлекс не связан с гипотензией на вдохе и с вовлечением барорефлекторной цепи каротидного синуса. Предполагалось, что это чисто спинальный рефлекс, а афферентные волокна входят в спинной мозг преимущественно в зоне верхнегрудных сегментов. Но полностью детали афферентных и эфферентных путей рефлекса не ясны до сих пор.
Рефлекс вызывает значительное снижение кровотока. Плетизмографическими исследованиями кистей рук продемонстрировано уменьшение его на 80% и более, а при капилляроскопии ногтевого ложа отмечено быстрое и полное прекращение капиллярного кровотока (Mulinos M.G., Shulman I.,1939). Когда кровоток конечности прекращали манжеточной окклюзией плечевой артерии, то последующий глубокий вдох вызывал временное быстрое ускорение капиллярного кровотока, видимо, за счет изгнания крови при констрикции более проксимальных артериол. В настоящее время инспираторный дыхательный сосудистый ответ (the inspiratory gasp vascular response – IGVR) чаще измеряют в коже ладонной поверхности пальцев кисти и подошвенной поверхности пальцев стопы в ходе ЛДФ-исследований (Khan F. et al., 1991; Netten P.M. et al., 1996).Эти зоны кожи богаты анастомозами и часто используются для оценки нейрососудистой функции у больных с диабетом (Wilson S.B. et al., 1992; Abbot N.C. et al., 1993), болезнью Рейно (Wollersheim H. et al., 1991), эритромелалгией (Littleford R.C. et al., 1999), лепрой (Abbot N.C. et al., 1993), при нарушениях иннервации конечностей и после трансплантации (Крупаткин А.И., 2003; Крупаткин А.И., Сидоров В.В., Меркулов М.В.и др., 2004). Отдельные авторы применяют с этой же целью фотоплетизмографию (Barron S.A. et al.,1993).
Определен ряд факторов, которые могут влиять на величину снижения кровотока в ходе дыхательной пробы – кожная температура (Oberle J. et al., 1988), возраст, наследственные факторы (Lau Y.T. et al., 1995; du Buf-Vereijken et al., 1997). Согласно данным (Mayrovitz H.N. et al., 2002) уровень уменьшения перфузии при дыхательной пробе мало зависит от наличия или отсутствия артериоло-венулярных анастомозов кожи, в связи с чем кожу как тыла, так и ладонной поверхности пальцев можно использовать для оценки вегето-сосудистой регуляции. С возрастом проявляется тенденция к менее выраженной реакции уменьшения перфузии при проведении дыхательной пробы (Khan F. et al.,1992).
 Дыхательная проба не только проста в применении, но и высокоинформативна (рис. 4.6). В участках кожи с высокой плотностью симпатической иннервации (акральные зоны конечностей, особенно пальцы кисти) она положительна у всех здоровых лиц.
Дыхательная проба не только проста в применении, но и высокоинформативна (рис. 4.6). В участках кожи с высокой плотностью симпатической иннервации (акральные зоны конечностей, особенно пальцы кисти) она положительна у всех здоровых лиц.
В чём особенности трактовки результатов вазоконстрикторных тестов, в том числе дыхательной пробы? Реакция сосуда на активацию адренергических волокон зависит как от влияний со стороны симпатической иннервации, так и от реактивности сосудистой стенки. Поэтому величина снижения кровотока при дыхательной пробе отражает результирующую этих двух процессов, которые трудно оценить изолированно. Например, при исходном спазме приносящих микрососудов или венозном застое с включением венуло-артериолярных механизмов отмечена более низкая реакция на дыхательную пробу. В связи с вышеизложенным физиологическую трактовку результатов ЛДФ для оценки функции симпатической периваскулярной иннервации целесообразно осуществлять по двум параметрам – исходному нейрогенному тонусу в покое и относительной величине снижения ПМ при дыхательной пробе. Нормирование необходимо для сглаживания влияния исходного состояния сосуда на показатели вазоконстрикторной функциональной пробы. Амплитуду спада при дыхательной пробе можно оценивать по формуле:
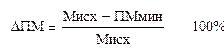 (4.2)
(4.2)
где ПМмин. – минимальная величина ПМ при дыхательной пробе, а Мисх. – исходная величина ПМ. Величина DПМ зависит от состояния вегетативной регуляции. Ранее сообщалось, что норматив DПМ для пальцев кисти составляет 32,8%, но эта величина характерна для лиц, ведущих активный образ жизни и спортсменов. Для основной популяции норматив DПМ кожи подушечки 2-ого пальца – 40%, а 5-ого пальца – 52%.
Основные варианты нарушений амплитуды симпатического вазомоторного рефлекса, диагностируемые с помощью ЛДФ, представлены в таблице 4.1.
DПМ при дыхательной пробе отражает симпатическую регуляцию, ограниченную преимущественно нейро-сосудистым синапсом. При застарелой денервации и дефиците симпатических волокон следует учитывать появление денервационной гиперчувствительности сосудов с появлением рецепторов во внесинаптических пространствах, на которые могут влиять минимальные концентрации циркулирующих катехоламинов. В этом случае показатель DПМ снижается, хотя исходный нейрогенный тонус повышен. Соответственно, при полной симпатической денервации сосудов рефлекторные симпатические вазоконстрикторные пробы ЛДФ могут быть отрицательными, а попытки вызвать вазодилатацию с помощью симпатических блокад безуспешными.
Варианты расстройств амплитуды симпатической
Холодовая проба
Холодовая проба – это один из распространенных тестов, используемых для функциональной оценки микрососудистого русла. Возможны два варианта пробы – охлаждение большой площади поверхности кожи или локальное тестирование.
Первый подход обозначает как холодовой прессорный тест (в англоязычной литературе – cold pressor test) и осуществляется в форме погружения кисти или стопы в ванну с холодной водой. Обычно используют температуру воды 3 – 15°С. Время экспозиции (охлаждения) варьируют от нескольких минут до 30 минут и даже более в зависимости от целей исследования. Охлаждение и массивное раздражение терморецепторов в процессе выполнения холодового прессорного теста вызывает мощную симпатическую активацию, что приводит к констрикции мышечно-содержащих сосудов (артерий, артериол, артериоло-венулярных анастамозов –АВА), к сопутствующему повышению артериального давления, умеренному увеличению содержания катехоламинов плазмы крови, но без изменения частоты сердечных сокращений (Lafleche et fl.,1998; Weise et fl., 1993). Повышение симпатической активности за счет раздражения терморецепторов кожи приводит к вазоконстрикции на симметричных участках контралатеральной конечности, которые используют как объект для исследования изменения нейрогенного и других видов регуляторных механизмов микрососудистого русла в процессе рефлекторной симпатической активации. Встречаются сопутствующие изменения ригидности стенок более крупных магистральных артерий с уменьшением растяжимости сосудистой стенки по данным эхолокации, но у здоровых лиц на верхней конечности это наблюдалось преимущественно на лучевой артерии (зона богатого вегетативными волокнами срединного нерва), плечевой артерии (Boutouyrie et.al., 1994; Joannides et al., 1995). Известно, что чем выше пульсовое давление, тем более выражены пульсовые изменения диаметра магистральных сосудов. В ходе выполнения холодового прессорного теста увеличение пульсового давления сочетается с уменьшением относительно нормы пульсового диаметра сосудов.
Второй подход связан с созданием локальной гиперемии кожи и подлежащих тканей в зоне ее контакта с охлаждающим предметом небольшой площади, низкая температура которого поддерживается в течение необходимого периода времени. Этот подход может быть реализован с помощью блока «ЛАКК-ТЕСТ», имеющего холодовой пробник. Целесообразность локального тестировании обусловлена клиническими потребностями, так как отдельные пациенты, особенно после травм конечностей или на фоне болевых нейро-сосудистых синдромов не переносят массивное длительное охлаждение. Хотя при локальном холодовом тестировании менее выражены общие реакции рефлекторного симпатического ответа, но оно как и холодовой прессорный тест эффективно для изучения локальных резервов температурной регуляции микроциркуляции и для оценки реакции холодовой вазодилатиции.
Тепловая проба
Н.К. Чемерис, Г.М. Пискунова
Традиционно термопроба проводится путем нагревания области исследования до 40-45˚С в течение нескольких минут, при этом оцениваются резервные возможности микроциркуляторного русла по увеличению кровотока во время реактивной тепловой гиперемии.
Реакция на локальное нагревание кожи волосистой зоны обусловлена по меньшей мере двумя независимыми контурами регуляции – нейрогенными рефлексами и местными факторами. Согласно последним исследованиям, в развитии гиперемии при локальном нагревании рефлексы симпатической нервной системы практически не участвуют. Значительную роль в этом случае играет аксон-рефлекс с участием сенсорных нервных волокон, который, очевидно, является первичным механизмом вазодилатации. Дальнейшая вазодилатация развивается благодаря рилизингу эндотелием оксида азота (NO). Включение того или иного контура регуляции происходит в соответствии с терморегуляционными свойствами организма, что и определяет дилатацию сосудов кожи в течение всех стадий гиперемии. В частности большое значение имеет длительность и скорость нагрева, а также максимальная температура нагрева. Показано, что при высокой скорости нагрева и (или) значениях температуры выше болевого порога (42˚С), и, в особенности, если процедура сопровождается болевыми ощущениями, активизируются другие механизмы вазодилатации, обусловленные, предположительно, высвобождением ряда вазоактивных пептидов (Fromy B. et. al., 2000).
Методика проведения пробы
Обычно нагрев исследуемой поверхности кожи при проведении тепловой пробы осуществляется ступенчато до 42 – 45˚С. Время достижения заданной температуры при этом составляет от 60 до 90 секунд (Козлов В.И. и др. 2000). Недостатком такого подхода является отсутствие возможности контролировать профиль роста температуры. Кроме того, высокая скорость нагрева – до 10˚С в минуту - не позволяет исследовать динамику переходного процесса и проводить надежный анализ температурной зависимости низкочастотных колебаний, которые являются наиболее диагностически информативными. Методические трудности такого рода можно разрешить, проводя тепловую пробу ступенчато, – несколько раз с нагревом до разных температур. Но при таком варианте пробы процедура исследования становится неоправданно длительной.
Указанные недостатки можно устранить при использовании блока ЛАКК-ТЕСТ, в котором предусмотрен режим линейного нагрева со скоростью 2˚С в минуту в температурных границах от 32 до 45˚С. Такая модификация тепловой пробы позволяет в условиях одного эксперимента исследовать реакцию системы микроциркуляции на нагревание в широком температурном диапазоне (Коняева Т.Н. и др., 2002).
Рекомендуемая продолжительность записи – не менее 10 минут. В этом случае возможен качественный анализ низкочастотных колебаний, являющиеся наиболее информативными в оценке активных механизмов регуляции гемоваскулярного гомеостаза.
Окклюзионная проба
Н.К. Чемерис, Г.М. Пискунова
Окклюзионная проба (ОП) реализуется путем пережатия на 1 - 3 мин соответствующего участка конечности манжетой тонометра таким образом, чтобы вызвать остановку кровотока и соответственно ишемию в исследуемой области. После прекращения окклюзии кровоток восстанавливается и развивается реактивная постокклюзионная гиперемия, которая проявляется в увеличении показателя микроциркуляции до величины, превышающей исходный уровень ПМ с последующим спадом до исходного уровня.
Физиологическая роль компрессионной пробы проявляется в прекращении поступления крови в плечевую артерию и соответственно в изменении кровенаполнения в тканях. В большинстве случаев кровенаполнение уменьшается, происходит отток крови из сосудов микроциркуляции. В момент декомпрессии кровоток в артерии восстанавливается и развивается реактивная гиперемия с максимальным заполнением кровью сосудов микроциркуляции. Изменение кровенаполнения от его минимальных значений во время компрессии до максимальных во время реактивной гиперемии характеризует весь диапазон возможностей изменения кровенаполнения.
При проведении данной пробы оценивается уровень «биологического нуля» (показатель микроциркуляции в отсутствие артериального притока) и изучаются резервные возможности микроциркуляторного русла по приросту показателя микроциркуляции во время реактивной постокклюзионной гиперемии.
Согласно экспериментальным исследованиям постокклюзионная реактивная гиперемия является нейрогенной реакцией, реализующаяся преимущественно через высвобождение нейропептида КГРП (кокальцигенина) и нейронального оксида азота, секретируемых афферентными ноцицептивными С-волокнами. Эти факторы индуцируют синтез NO эндотелием, который, в свою очередь, воздействуя на гладкую мускулатуру сосудов, вызывает вазодилатацию (Fromy B. et. al., 2000, 2002).
Методика проведения пробы
При исследовании испытуемые находятся в положении сидя или лежа (предплечье – на уровне сердца) ЛДФ-зонд фиксируется над выбранной точкой наружной поверхности предплечья вблизи лучезапястного сустава. Манжета тонометра фиксируется на соответствующем плече. Проба проводится по следующей схеме: 1-я минута – регистрация исходного уровня кровотока, затем, не прерывая записи, 3-минутная окклюзия (в манжете быстро нагнетается и поддерживается давление 220-250 мм рт. ст.), по истечении которой воздух из манжеты быстро выпускается, и в течение последующих 6 минут регистрируется реакция ПМ в ходе восстановления кровотока.
Методика проведения пробы
Для ионофоретического введения веществ и одновременной регистрации параметров кровотока используется ионофоретический пробник блока «ЛАКК-ТЕСТ», к которому подводятся растворы апплицируемых веществ. Пробник фиксируется на наружной поверхности предплечья вблизи лучезапястного сустава. Электрод противоположной полярности фиксируется на запястье другой руки. Испытуемые при исследовании могут находиться в положении сидя или лежа.
Аппликацию АХ и НП осуществляют последовательно на различных участках поверхности кожи со схожей плотностью сосудистой сети, на расстоянии не менее 5 см друг от друга.
Для каждого испытуемого регистрируются контрольная 10-минутная запись без пробы и две 10-минутные записи с ионофоретическим введением АХ и НП.
Рекомендуется проведение ионофореза при силе тока не более 50 мкА, так как ток большей силы, особенно при длительном ионофорезе (более 2мин.), сам является эффективным раздражителем, вызывающим гиперемию. Действующие агенты: АХ (ацетилхолин-хлорид) и НП (нитропруссид натрия) применяются в виде водных растворов различных концентраций: 1%, 0,1%, 0,01% (Коняева Т.Н. и др., 2002).
Представленные ниже данные получены на группе практически здоровых нормотензивных некурящих девушек-студенток возраста 18-23 лет. Фаза менструального цикла не учитывалась.
 Обычно данная проба проводится по следующей схеме: регистрация исходного уровня кровотока ® регистрация кровотока при действии ионофоретического тока в течение 1 ‑ 3 мин ® последующая регистрация динамики перфузии. Концентрация растворов используемых фармакоагентов – 1%, величина тока 50 – 200 мкА.
Обычно данная проба проводится по следующей схеме: регистрация исходного уровня кровотока ® регистрация кровотока при действии ионофоретического тока в течение 1 ‑ 3 мин ® последующая регистрация динамики перфузии. Концентрация растворов используемых фармакоагентов – 1%, величина тока 50 – 200 мкА.
Типичная динамика ПМ в ходе проведения пробы при этих условиях показана на рис. 4.19.
Для действия АХ характерно: быстрое нарастание ПМ в ходе проведения ионофоретической пробы, сохранение тенденции увеличения ПМ в течение примерно 1 мин после прекращения действия ионофореза, после этого следует медленное восстановление ПМ. Действия НП характеризуется более плавным нарастанием ПМ в ходе ионофореза, продолжающимся и после прекращения действия тока (в нашем случае в пределах 7 мин.). В норме максимальное значение ПМ при действии АХ, как правило, выше либо незначительно меньше чем для НП.
Наблюдаемое различие в динамике реакции микроциркуляторного русла на АХ и НП объясняется биохимическими особенностями действия этих агентов. Известно, что действие ацетилхолина вызывает активацию ферментных систем, локализованных в эндотелии, что, в конечном счете, приводит к высвобождению оксида азота эндотелиоцитами. NO, в свою очередь, воздействует на гладкомышечные клетки сосудов. Ацетилхолин не способен накапливаться в ткани и быстро разрушается ацетилхолинэстеразой, что подтверждается относительно быстрым снижением уровня ПМ после прекращения действия ионофореза. Фармакодинимика нитропруссида натрия более медленная – эффект обусловлен наличием нитрозогруппы, отщепляющейся с образованием NO под действием восстановителей типа тиолов. Действие сохраняется в течение нескольких минут после прекращения аппликации.
При анализе результатов данной пробы оцениваются прежде всего максимальные значения ПМ реакции. Реакция на НП отражает релаксацию сосудов, вызванную непосредственным действии оксида азота на гладкую мускулатуру. АХ используется, чтобы продемонстрировать вазодилатацию, опосредованную эндотелием, что позволяет использовать этот тест для оценки функционального состояния эндотелия (конкретно – способности синтезировать факторы релаксации). Эндотелиальная дисфункция проявляется в снижении выраженности реакции на АХ: максимальное значение ПМ в этом случае меньше, чем в случае реакции на НП и пропорционально степени дисфункции. Данная функциональная проба используется для оценки степени эндотелиальной дисфункции, например, при таких патологических состояниях как сахарный диабет, эссенциальная артериальная гипертензия, гиперхолестеролэмия, атеросклероз.
Для анализа участия активных механизмов (миогенной, нейрогенной и эндотелиальной природы), проявляющихся в низкочастотных (0,007 – 0,1 Гц) составляющих колебаний перфузии и представляющих наибольший интерес, необходимо увеличить время развития реакции, в связи с чем, предлагается следующая схема пробы: 1 мин. – регистрация исходного уровня кровотока, следующие 9мин. – регистрация кровотока при действием ионофореза. При указанных выше параметрах ионофореза (ток 50 мкА, концентрация растворов 1%) наблюдается максимальная вазодилатация, что приводит к практически полному подавлению анализируемых колебаний. В связи с этим, по-нашему мнению, наиболее целесообразно использовать более низкие токи и (или) концентрации.
На рис. 4.20 представлена зависимость ПМ от времени при ионофорезе АХ (0,01 и 1%) и НП (1%) при значении тока 5 мкА. Следует отметить, что ПМ зависит как от силы тока ионофореза, так и от концентрации растворов действующих веществ.

Максимальные значения ПМ при ионофорезе 1% АХ и НП значительно отличаются (28 пф.ед. для 1% АХ и 5 пф.ед. для 1% НП). Эффект АХ в концентрации 0.01% сравним с таковым для 1% раствора НП (ПМ возрастает в 1,5 и 2 раза соответственно), что свидетельствует о более высокой чувствительности системы микроциркуляции кожи к АХ по сравнению с НП. На рис. 4.21 представлены амплитудно-частотные спектры (АЧС) при ионофорезе АХ (0,01 и 1%) и НП (1%) при значении тока 5 мкА.
При ионофорезе 0,01% раствора АХ наибольшая амплитуда колебаний приходится на диапазон эндотелиальной активности (0,47 пф.ед.), что, по-видимому, обусловлено природой действующего агента: АХ относится к веществам, вызывающим вазодилатацию по эндотелий-зависимому механизму, поэтому при минимальной концентрации АХ наличие пика в диапазоне эндотелиальной активности говорит об усилении активности эндотелиальных клеток под действием АХ. Небольшое увеличение амплитуды пика в диапазоне кардиоритма до 0,16 пф.ед. и диапазоне респираторной активности (0,2 пф.ед.) свидетельствует о начале процесса вазодилатации.

При увеличении концентрации раствора (1%) эффект АХ возрастает. Усиливающаяся секреция оксида азота эндотелием приводит к увеличению амплитуды в диапазонах эндотелиальной и нейрогенной активности (0,8 пф.ед.). Пик в диапазоне миогенной активности (0,68 пф.ед.) свидетельствует об усилении вазомоторной активности гладкомышечных клеток стенок сосудов. Проявлением более глубокой степени вазодилатации (по сравнению с 0,01% раствором) является наличие выраженного пика в диапазоне кардиоритма (0,7 пф.ед.). Амплитуда колебаний в диапазоне респираторного ритма также возрастает (0,3 пф.ед.), что указывает на закономерное увеличение кровенаполнения венулярного звена в зависимости от степени вазодилатации сосудов.
В отличие от действия АХ, ионофоретическая аппликация НП проявляется в значительном увеличении амплитуды колебаний в миогенном диапазоне (0,75 пф.ед.). Также наблюдается незначительное увеличение амплитуда в нейрогенном диапазоне (0,36 пф.ед.). Амплитуда колебаний в диапазоне эндотелиальной активности в случае НП, оказывается ниже соответствующего значения в контроле (0,1 пф.ед.). Наблюдаемые изменения в спектре, по-видимому, можно объяснить прямым вазодилатирующим действием НП: являясь экзогенным донором оксида азота, он непосредственно воздействует на гладкомышечные клетки, не вовлекая в процесс сосудистый эндотелий и нейрогенные механизмы регуляции.
Таким образом, фармакологическая (ионофоретическая) проба с применением АХ и НП является весьма эффективным методом диагностики состояния эндотелия, позволяя обнаруживать и количественно оценивать степень эндотелиальной дисфункции, которая служит основой развития многих патологических состояний кардио-васкулярной системы.
Электростимуляционная проба
Сенсорная пептидергическая иннервация является неотъемлемым компонентом периваскулярной иннервации. Для функционального тестирования сенсорных пептидергических периваскулярных волокон наиболее эффективно исследование их локальной эффекторной функции путем перкутанной антидромной электростимуляции ноцицептивных капсаицин-чувствительных С- афферентов. Электростимуляция сенсорных терминалей способна вызвать антидромную вазодилатацию кожи как в эксперименте у млекопитающих, так и у человека, причём эффект вазодилатации можно количественно оценить по уровню прироста перфузии при регистрации ЛДФ-грамм (Крупаткин А.И., 2002). Поскольку электростимуляция осуществляется чрезкожно, то она способна активировать и другие нервные волокна, а не только сенсорные. В связи с этим важен правильный выбор параметров стимуляции. Для электростимуляции С - афферентов используется импульсы тока частотой 2 Гц и длительностью импульса 0,5 мсек. Для электростимуляции применяется электростимуляционный электрод блока «ЛАКК-ТЕСТ». Регистрацию ЛДФ-граммы проводят в зоне электростимуляции или на расстоянии до 1 см от стимулирующего электрода. Это соответствует размеру рецепторных полей С-волокон, которые для кожи конечностей человека чаще не превышают 2 см. Сила тока подбирается индивидуально, не доводя 0,5 мА до порога боли. Обычно для пальцев кисти она не превышает 9 – 10 мА. После одноминутной электростимуляции её прекращают, но продолжают запись ЛДФ. Общий вид ЛДФ-граммы представлен на рис. 4.22. Предлагается оценивать следующие показатели - время от начала электростимуляции до начала подъема кривой (Т1), общее время подъема кривой от его начала до момента спада (Т2). Целесообразно рассчитывать степень прироста ПМ (DПМс в %) по формуле:
 (4.3)
(4.3)
где ПМмакс. – максимальная величина ПМ при электростимуляционном тесте, Мисх. – исходное значение ПМ.
В коже пальцев в отличие от кожи предплечья у многих обследуемых после первоначального подъёма ЛДФ-граммы может наблюдаться её спад с последующим повторным возрастанием перфузии, что придает ЛДФ-записи двухфазный (иногда многофазный) характер. Вероятно, это обусловлено периодическим преобладанием симпатической вазоконстрикции, вызванной электростимуляцией, особенно в акральных зонах, где этот тип нервной регуляции главенствует. В этих случаях для расчёта DПМс целесообразно учитывать повышение перфузии первой дилатационной волны. Норматив для кожи предплечья по внутренней поверхности DПМс – 42%, для кожи  подушечки II пальца – 36%, V пальца – 26%.
подушечки II пальца – 36%, V пальца – 26%.
Поскольку блокатором функции С-афферентов служит капсаицин, угнетение DПМс под влиянием его локальных аппликаций подтверждает диагностическую специфичность электростимуляционного теста. При исследованиях использовали настойку стручкового перца (фирма Ай-Си-Эн, Россия), содержащую 1% раствор капсаицина в 90% спирте. Смазывали кожу ладонной поверхности предплечья 6 раз в сутки каждые 3 часа в течение 3 суток у 15 здоровых добровольцев. Тестировали кожу до и на 4 сутки после обработки в трех стандартных точках, каждая на расстоянии 1 см от стимулирующего электрода. Дыхательную пробу проводили до и после электростимуляции через 20 секунд после нормализации уровня ПМ. Результаты представлены в таблице 4.5.
Таблица 4.5
Рекомендации для проведения функциональной диагностики регуляции микроциркуляторного русла
1. При оценке микроциркуляции в конкретной области исследований первоначальным этапом является подбор контрольной группы для получения ориентиров, необходимых для сопоставления их с данными конкретного пациента. Для примера приведена таблица 4.6 усредненных значений параметров базального кровотока кожи подушечки 2-ого пальца кисти здоровых лиц от 16 до 75 лет (n = 32). Разброс значений составлял 15%.
Таблица 4.6
лазерная допплеровская флоуметрия МИкроциркуляции крови
Руководство для врачей
Под редакцией
д.м.н. А.И. Крупаткина, к.т.н. В.В. Сидорова

Москва: ОАО «Издательство «Медицина», 2005
СОДЕРЖАНИЕ
Предисловие............................................................................................................... 3
Список сокращений.................................................................................................. 5
РАЗДЕЛ 1
МЕТОДИЧЕСКИЕ АСПЕКТЫ ДИАГНОСТИКИ СОСТОЯНИЯ
МИКРОЦИРКУЛЯЦИИ КРОВИ. – Крупаткин А.И., Сидоров В.В........................... 6
Глава 1. Метод лазерной допплеровской флоуметрии............................................ 6
1.1. Физические основы метода ЛДФ....................................................................... 6
1.2. Диагностическое значение ритмов колебаний кровотока в микроциркуляторном русле 14
Литература................................................................................................................... 24
Глава 2. Морфологические особенности сосудистого русла.................................. 26
2.1. Общие сведения о морфологии сосудистого русла......................................... 26
2.2. Сосудистая система кожи и подлежащих тканей............................................. 32
Литература................................................................................................................... 34
Глава 3. Физилогические основы функционирования и регуляции тканевого сосудистого русла...................................................................................................................................... 36
3.1. Регуляция сосудистого тонуса........................................................................... 37
3.1.1. Тонус кровеносных сосудов.......................................................................................................... 37
3.1.2. Механизмы регуляции тонуса сосудов...................................................................................... 39
3.2. Физиологические основы функционирования периваскулярной иннервации.. 56
3.3. Регуляция нутритивного русла и транскапиллярного обмена.......................... 68
3.4. Влияние реактивности стенок сосудов на результирующий эффект регулярных влияний 74
3.5. Особенности регуляции разных звеньев сосудистого русла и тканей конечностей 77
Литература................................................................................................................... 80
Глава 4. Диагностика функционального состояния микроциркуляции крови методом ЛДФ 83
4.1. Диагностические характеристики базального кровотока................................... 84
4.2. Диагностика микрососудистого тонуса.............................................................. 89
4.3. Функциональные пробы....................................................................................... 91
4.3.1. Дыхательная проба.......................................................................................................................... 91
4.3.2 Постуральная (ортостатическая) проба..................................................................................... 94
4.3.3. Холодовая проба.............................................................................................................................. 97
4.3.4. Тепловая проба. Н.К. Чемерис, Г.М.Пискунова........................................................................ 102
4.3.5. Окклюзионная проба Н.К. Чемерис, Г.М.Пискунова............................................................... 107
4.3.6. Фармакологическая проба с ацетилхолином Н.К. Чемерис, Г.М.Пискунова.................. 111
4.3.7. Электростимуляционная проба.................................................................................................... 116
4.4. Рекомендации для проведения функциональной диагностики регуляции микроциркуляторного русла............................................................................................................................. 119
Литература................................................................................................................... 122
ПРЕДИСЛОВИЕ
В книге обобщены результаты исследований состояния микроциркуляции крови методом лазерной допплеровской флоуметрии (ЛДФ).
Современный рынок медицинской аппаратуры предлагает пытливому клиницисту, желающему иметь в своем распоряжении полноценные сведения о состоянии тканевой микроциркуляции, крайне ограниченный выбор средств. Эта ограниченность обусловлена, с одной стороны, жесткими требованиями к неинвазивности и безвредности проведения исследований у человека, а с другой – необходимостью получения максимальной информации о тех нарушениях регуляторных механизмов, которые подлежат коррекции. С этих позиций использование метода ЛДФ со спектральным анализом колебаний кровотока является одним из наиболее целесообразных подходов.
Обладая высокой чувствительностью к изменениям микрогемодинамической ситуации в сосудистом русле, метод ЛДФ имеет неоспоримое преимущество перед другими методиками исследования микроциркуляции оценивать состояние функционирования механизмов управления кровотоком. Ежегодно только в русскоязычной литературе публикуется более 100, а в мировой – более 500 работ, выполненных с применением этого метода. В то же время до сих пор нет современного руководства, обобщающего последние достижения в этой области. Основные англоязычные монографии опубликованы более 10 – 15 лет назад еще до применения характеристик колебательных процессов для диагностики состояния микроциркуляторного русла и предлагают ограниченный набор подходов к оценке базального кровотока.
Предлагаемая читателю монография является первым русскоязычным руководством, где систематизированы основные сведения о лазерной допплеровской флоуметрии и ее клиническом применении как в условиях физиологического покоя, так и при функциональных нагрузках. В данном издании подробно рассмотрены собственные и представленные в мировой литературе диагностические подходы для исследования микроциркуляции, основанные на медленных колебаниях кровотока. Известно, что контроль нервной и гуморальной систем за состоянием микроциркуляции крови осуществляется через феномен медленных колебаний, несущих диагностическую информацию о внутренней организации микрокровотока. В последнее десятилетие несколькими исследовательскими коллективами, в основном европейскими, проведен цикл исследований, направленных на выяснение природы осцилляций кровотока, и подтвердивших правильность представленных в книге диагностических методик.
Содержание данной книги является результатом коллективного труда российских исследователей. Монография включает общую часть, освещающую методические аспекты, их анатомо-физиологическое обоснование, и частный раздел, где рассматриваются особенности использования метода при конкретных нозологических формах. Результаты исследований получены с применением комплекса отечественной аппаратуры, лазерных анализаторов микроциркуляции крови серии ЛАКК.
Руководство ориентировано как на врачей функциональной диагностики, так и клиницистов всех специальностей, научных работников, занимающимися проблемами оценки тканевой микроциркуляции.
Авторы
www.lazma.ru
Список принятых сокращений
А – амплитуда колебаний кровотока
АВА – артериоло-венулярный анастамоз
АД – альвеолярная десна
АДГ – антидиуретический гормон
АХ – ацетилхолин
АЧС – амплитудно-частотный спектр колебаний кровотока
БПФ – быстрое преобразование Фурье
ВИП – вазоактивный интестинальный пептид
ГТМ – гемодинамический тип микроциркуляции
ДП – дыхательная проба
ЖЕЛ – жизненная емкость легких
КА – катехоламины
КБМС – метод конъюктивальной биомикроскопии
КГРП – кальцитонин-ген-родственный пептид
КРБС – комплексный регионарный болевой синдром
КТ – компьютерная томография
ЛДФ – лазерная допплеровская флоуметрия
М – постоянная составляющая перфузии
МД – маргинальная десна
МЛТ – магнитно-лазерная терапия
МТ – миогенный тонус
МЦР – микроциркуляторное русло
НY – нейропептид Y
НА – норадреналин
НП – нитропруссид натрия
НТ – нейрогенный тонус
ОП – окклюзионная проба
ПАПН – полный анатомический перерыв смешанного нерва
ПД – прикрепленная десна
ПК – пальцевой кровоток
ПМ – показатель микроциркуляции
ПП – постуральная проба
Пф.ед. – перфузионные единицы
ПШ – показатель шунтирования
РК – резерв кровотока
РНР – резерв нейромедиаторной регуляции
СВР – симпатический вазомоторный рефлекс
ТМЕ – типовая (типичная) микроциркуляторная единица
ФЖЕЛ – форсированная жизненная емкость легких
ФЭО – функциональный элемент органа
ХОБЛ – хроническая обструктивная болезнь легких
ХП – холодовая пробы
ЭЗКТ – эндотелиально-зависимый компонент сосудистого тонуса
ЭИ – эндогенная интоксикация
l – длина волны зондирующего излучения
s – среднеквадратическое отклонение колебаний перфузии
n – показатель преломления излучения в ткани
Nэр – количество эритроцитов в зондируемом объеме
V – скорость эритроцитов
Vср – средняя скорость эритроцитов в зондируемом объеме
Δf – допплеровский сдвиг частоты
ΔПМ (t) – переменная составляющая перфузии
РАЗДЕЛ I
Дата: 2019-02-02, просмотров: 710.