| Аналитическая группа | Групповой реагент | Анионы |
| I | BaCl2 | B(OH)4-, SiO32-, CO32-, PO43-, AsO33-, AsO43-, SO42-, SO32-, S2O32-, F-, C2O42-, CrO42- |
| II | AgNO3 | S2-, Cl-, Br-, I-, IO3-, SCN- |
| III | Нет | NO3-, NO2-, CH3COO- |
Классификация анионов, основанная на их
Окислительно-восстановительных свойствах
| Группа | Анионы | Групповой реагент |
| I Окислители | BrO3-, AsO43-, 1NO3-, 2NO2- | Раствор KI в сернокислой среде |
| II Восстановители | S2-, SO32-, S2O32-, AsO33- | Раствор I2 в KI |
| S2-, SO32-, S2O32-, AsO33-, 2NO2-, 3C2O42-, 4Сl-, I-, Br-, CN-, SCN- | Раствор KMnO4 в сернокислой среде | |
| III Индифферентные | SO42-, CO32-, PO43-, CH3COO-, B4O72-, BO2- | Отсутствует |
1 Нитрат-ион NO3- в слабо кислой среде практически не реагирует с иодидом калия KI.
2 Нитрит-ион NO2- относят к I или II группе.
3 Оксалат-ион C2O42- заметно обесцвечивает раствор перманганата калия только при нагревании.
4 Хлорид-ион Сl- в обычных условиях медленно реагирует с раствором перманганата калия.
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Рассчитайте полную константу устойчивости β и полную константу нестойкости Кн тетраммина цинка [Zn(NH3)4]2+ в водном растворе при 30 0C и ионной силе раствора Ic = 2, если логарифмы ступенчатых констант устойчивости в тех же условиях равны: lgβ1 = 2,37, lgβ2 = 2,44, lgβ3 = 2,50, lgβ4 = 2,15.
Решение:
Полная константа устойчивости β равна произведению ступенчатых констант устойчивости β = β1β2β3β4. Очевидно, что lgβ = lgβ1 + lgβ2 + lgβ3 + lgβ4 = 2,37 + 2,44 + 2,50 + 2,15 = 9,46, откуда β = 109,46 = 2,88 ∙ 109.
Полная константа нестойкости Кн комплекса есть величина, обратная константе его устойчивости: Кн = 1/ β = 10-9,46 = 3,5 ∙ 10-10.
Задача 2
Рассчитайте истинные термодинамические константы устойчивости β и нестойкости Кн комплексного аниона [Co(NCS)4]2- в водном растворе, если равновесные активности ионов равны: a([Co(NCS)4]2-) = 0,003, a(Co2+) = 0,080, a(NCS-) = 0,523.
Решение:
В растворе комплексный анион диссоциирует:
[Co(NCS)4]2- = Co2+ + 4NCS-
Истинная термодинамическая константа устойчивости
β = 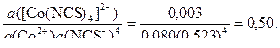
Истинная термодинамическая константа нестойкости Кн = 1/β = 1/0,50 = 2. Комплекс в водных растворах неустойчив и равновесие существенно смещено вправо – в сторону его диссоциации.
Задачи для самостоятельной работы
1.Вычислите истинные термодинамические константы устойчивости β и нестойкости Н комплексного катиона [Co(NH3)6]3+ в водном растворе, если равновесные активности реагентов в этом растворе равны: а( [Co(NH3)6]3+ )= 0,10
а(Co3+) = 1,5*10-6 ,а(NH3) = 9,0*10-6. Ответ: β = 1,3 1035, KH =7,7*10-36.
2.Рассчитайте концентрационные константы устойчивости и нестойкости комплексного аниона [PbI4]2-, если в водном 1,0 моль/л растворе комплекса K2[PbI4] равновесные концентрации ионов свинца(II) и иодид-ионов равны: [Pb2+] = 0,054 моль/л, [I-] = 0,216 моль/л. Ответ: lgβ =3,93, β = 8,51*103; KH = 1,18*10-4.
3.Рассчитайте полную константу устойчивости β и полную константу нестойкости Н комплексного катиона [Cd(NH3)4]2+ в водном растворе при 30 °с и ионной силе раствора, равной 2, если логарифмы ступенчатых констант устойчивости lgβ1, = 2,65, lgβ2 =2,10, lgβ3 = 1,44 и lgβ4 =0,93. Ответ: lgβ =7,12, β =1,32*107, KH= 7,58*10-8.
4.Найдите ступенчатую константу устойчивости β1 и ступенчатую константу нестойкости KH,1 для равновесия (1) в водном растворе, если логарифм ступенчатой константы устойчивости для равновесия (2) равен lgβ2 = 3,32, а логарифм полной константы устойчивости, соответствующей равновесию (3), равен lgβ = 7,23 (ионную силу раствора принять равной нулю, температура близка к комнатной).
[Ag(NH3)2]+ = [Ag(NH3 )]+ + NH3 (1)
[Ag(NH3)]+ = Ag+ + NH3 (2)
[Ag(NH3)2]+ =Ag+ + 2NH3 (3)
Ответ : lgβ1 =3,91, β1 = 8,13*103, KH,1 = 1,23*10-4.
5.Определите равновесные концентрации ионов железа(III) и цианид-ионов CN- в водном 1,0 моль/л растворе феррицианида калия K3[Fe(CN)6]. Логарифм концентрационной константы устойчивости комплексного феррицинид-иона [Fe(CN)6]3- равен lgβ = 43,9. Ответ: [Fe3+] =1,1*10-7 моль/л, [CN-] = 6,6* 10-7 моль/л.
6.Рассчитайте равновесные концентрации ионов железа(III) и фторид-ионов F- в водном растворе, содержащем комплекс K3[FeF6] с концентрацией 0,1 моль/л. Логарифм концентрационной константы устойчивости комплексного аниона [FeF6]3- равен lgβ = 16,10. Ответ: [Fe3+] = 7,76*10-4 моль/л, [F-] = 4,66*10-3 моль/л.
7.Рассчитайте степень диссоциации a комплексного аниона [Ag(SO4)]- и равновесные концентрации ионов [Ag+], [SO42-], [[Ag(SO4)]-] в водном растворе, в котором исходная концентрация указанного комплексного аниона равна c([Ag(SO4)]-) = 0,1 моль/л. Логарифм концентрационной константы устойчивости комплексного аниона равен lgβ = 0,31 (ионная сила Ic = 2, температура близка к комнатной). Ответ: α= 0,85, [Ag+] = 0,085 моль/л, [SO42-] = 0,085 моль/л, [[Ag(SO4)]- ]= 0,015 моль/л.
8.Рассчитайте равновесную концентрацию ионов висмута(III) в растворе комплекса K3[BiI6] с концентрацией 0,100 моль/л, содержащем йодид калия KI с концентрацией 0,100 моль/л. Логарифм константы устойчивости комплексного аниона [BiI6]3- равен lgβ= 19,1. Ответ: [Bi3+] = 7,9*10-15 моль/л.
9.Покажите, во сколько раз уменьшится равновесная концентрация ионов серебра(I) в 0,10 моль/л растворе комплекса K[Ag(CN)2], если к этому раствору прибавить цианид калия KCN до концентрации c(KCN) = 0,10 моль/л. Логарифм концентрационной константы устойчивости комплексного аниона [Ag(CN)2]- равен lgβ = 20,55. Ответ: уменьшится ~ в 1,5*1013 раз.
10.Выясните, образуется ли осадок сульфата бария BaSO4, если к водному 0,20 моль/л раствору этилендиаминтетраацетатного комплекса бария Na2[BaY], где Y4- — этилендиаминтетраацетат-ион, прибавить равный объем водного 0,20 моль/л раствора серной кислоты H2SO4. Логарифм концентрационной константы устойчивости комплексного аниона [BaY]2- равен lgβ = 7,78. Произведение растворимости сульфата бария
КS˚( BaSO4) = 1,1*10-10. Ответ: осадок образуется, так как c(Ba2+)c(SO42-) > КS˚(BaSO4).
11.Покажите, образуется ли осадок сульфата свинца PbSO4, если, как и в предыдущем примере, к водному 0,20 моль/л раствору эдта-го комплекса свинца Na2[BaY] прибавить равный объем 0,20 моль/л водного раствора серной кислоты. Логарифм концентрационной константы устойчивости комплексного аниона [BaY]2- равен lgβ = 18,04. Произведение растворимости сульфата свинца КS˚ ( PbSO4) = 1,6-10-8. Ответ: осадок не образуется, так как c(Pb2+)c(SO42-) < КS˚(PbSO4).
12.Определите, какой объем водного 0,30 моль/л раствора аммиака потребуется для растворения 66,4 мг хромата серебра(I) Ag2CrO4 по реакции:
Ag2CrO4 + 4NH3 = [Ag(NH3)2]2CrO4.
Ответ: ~2,67 мл.
Контрольные вопросы и задания по теме занятия
1. В чем заключаются основные положения координационной теории А.Вернера (металл-комплексообразователь, лиганды, внутренняя сфера, внешняя сфера)?
2. Что называют координационным числом?
3. Что называют дентатностью лигандов? Приведите примеры моно, - би, - три и гексадентатных лиганд?
4. Какие свойства комплексные соединения проявляют при первичной и вторичной диссоциации?
5. Что называют константой ступенчатого комплексообразования и что называют полной константой образования комплекса (полной константой устойчивости)?
6. Что называют ступенчатой константой нестойкости и что называют полной константой нестойкости комплекса?
7.Какие величины используют на практике вместо констант устойчивости и констант нестойкости?
8. Какие факторы влияют на значения констант устойчивости и нестойкости?
9.Какие факторы влияют на комплексообразование в растворах?
10. Где в аналитике используются реакции комплексообразования? Приведите примеры:
· осаждение катионов и анионов из растворов
· растворение осадков
· разделение ионов
· открытие ионов по изменению окраски раствора вследствие образования окрашенных комплексов
· определение подлинности лекарственных препаратов
· маскирование ионов
· изменение окислительно-восстановительных потенциалов редокс-пар
· концентрирование веществ
· определение катионов люминесцентным методом
· фиксирование точки эквивалентности в титриметрическом анализе.
Основная литература:
Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. Для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. Шк., 2008. – 423 – 449 ; 179 – 219 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 408 – 419 с.
2. Основы аналитической химии. Практическое руководство. Учеб. Пособие для вузов [Текст] / Под ред. Ю.А. Золотова - М.: Высш. Шк., 2001. – 72 – 87 с.
Тема 13
Дата: 2019-02-02, просмотров: 524.