К пятой аналитической группе относятся катионы Mg2+, Bi3+, Mn2+, Fe2+, Fe3+.
| Катион | Реагент | Наблюдения | Уравнение химической реакции |
| Mg2+ | Щёлочь или аммиак | Белый аморфный осадок | MgCl2+2NaOH = Mg(OH)2+2NaCl |
| Гидрофосфат натрия в присутствии аммиачного буфера | Белый мелкокристаллический осадок | MgCl2+NaHPO4+NH3 = NH4MgPO4+2NaCl | |
| 8- оксихинолин | Жёлто-зелёный кристаллический осадок | ||
| Хинализарин | Осадок синего цвета | ||
| Bi3+ | Щёлочь или аммиак | Белый осадок, при нагревании выпадает оксогидроксид висмута жёлтого цвета | Bi(NO3)3+3NaOH = Bi(OH)3+3NaNO3 Bi ( OH )3 = BiO ( OH )+ H 2 O При нагревании |
| Na2S | Чёрно-коричневый осадок, растворяется в разбавленной HNO 3 и FeCl 3 | 2Bi(NO3)3+3Na2S = Bi2S3+6NaNO3 Bi2S3+8HNO3 = 2Bi(NO3)3+2NO+2S+4H2O Bi2S3+ 6FeCl3 = 2BiCl3+6FeCl2+3S | |
| Йодиды | Осадок черного цвета, растворяется в избытке йодидов, образуя раствор жёлто-оранжевого цвета | BiCl3+3KI = BiI3+3KCl BiI3+KI = K[BiI4] | |
| Соединения олова (II) | Образуется металлический висмут чёрного цвета | 3Sn(OH)2+12NaOH+2Bi(NO3)3 = 3Na2[Sn(OH)6]+ 2Bi+6NaNO3 | |
| Mn2+ | Щёлочь или аммиак | Осадок белого цвета, на воздухе постепенно превращается в оксогидроксид чёрно-коричневого цвета | MnCl2+2NaOH = Mn(OH)2+2NaCl Mn(OH)2+O2 = MnO(OH)2 |
| С окислителями | Обесцвечивание перманганатов | 2KMnO4+10KCl+8H2SO4 = 2MnSO4+6K2SO4+5Cl2+8H2O | |
| С сульфидами | Осадок розовато-телесного цвета | MnCl2 + Na2S = MnS+2NaCl | |
| Fe2+ | Щёлочь или аммиак | Белого или светло-зелёного цвета, на воздухе окисляется до гидроксида железа ( III ) красно-бурого цвета | FeCl2+2NaOH = Fe(OH)2+2NaCl 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 |
| K3[Fe(CN)6] | Образование турнбулевой сини | 3FeCl2+ 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+6KCl | |
| С сульфидами | Чёрный осадок | FeCl2 + Na2S = FeS+2NaCl | |
| Fe3+ | Щёлочь или аммиак | Осадок красно-бурого цвета | FeCl3+3NaOH = Fe(OH)3+3NaCl |
| K4[Fe(CN)6] | Образование берлинской лазури | 4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 + 12KCl | |
| К CNS | Раствор кроваво-красного цвета | FeCl3+3 К CNS = Fe(CNS)3+3KCl | |
| С сульфидами | Осадок чёрного цвета | 2 FeCl 3 +3 Na2S = Fe 2 S 3 + 6 NaCl |
Контрольные вопросы и задания по теме занятия
1. Какие катионы относятся к четвертой аналитической группе? Какой их групповой реагент?
2. Какие катионы относятся к пятой аналитической группе? Какой их групповой реагент?
3. Как протекают качественные реакции катионов четвертой аналитической группы?
4. Как протекают качественные реакции катионов четвертой аналитической группы?
Основная литература:
1. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. Для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. Шк., 2008. – 328 – 334; 372 – 401 с.
Дополнительная литература:
1. Основы аналитической химии. Практическое руководство. Учеб. Пособие для вузов [Текст] / Под ред. Ю.А. Золотова - М.: Высш. Шк., 2001. – 36 – 62 с.
Модуль 2. Редокс-равновесия, равновесия комлексообразования, применение органических реагентов в химическом анализе.
Тема 10
Oкислительно-восстановительные равновесия
и их роль в аналитической химии
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Тест-контроль № 2
5. Лабораторная работа № 8 “Качественные реакции катионов VI аналитической группы: Cu 2+ , Cd 2+ , Co 2+ , Ni 2+ “
5. Подведение итогов занятия
УЧЕБНЫЕ ЭЛЕМЕНЫ ТЕМЫ
Многие реакции, используемые в аналитике, являются окислительно-восстановительными и используются как в качественном, так и в количественном анализе.
Например:
2 FeCl 3 + SnCl 2 = 2 FeCl 2 + SnCl 4
или в ионной форме:
2 Fe 3+ + Sn 2+ = 2 Fe 2+ + Sn 4+ .
Здесь в роли окислителя выступают ионы трехвалентного железа Fe3+, а в роли восстановителя – ионы двухвалентного олова Sn2+ (в действительности, разумеется, ионы железа (III) и олова (II) присутствуют в растворе в форме комплексов).
Соответствующие полуреакции можно записать в виде:
2Fe3+ + 2e = 2Fe2+
Sn2+ - 2e = Sn4+.
В данной окислительно-восстановительной реакции участвуют два электрона. Здесь имеются две редокс-пары Fe3+ │Fe2+ и Sn4+│Sn2+, каждая из которых содержит окисленную форму (Fe3+ , Sn4+) и восстановленную форму (Fe2+, Sn2+). При написании окисленная и восстановленная формы разделяются вертикальной чертой.
Редокс-пара – это система из окисленной и восстановленной форм данного вещества, в которой окисленная форма (окислитель) является акцептором электронов и восстанавливается, принимая электроны, а восстановленная форма выступает в роли донора электронов и окисляется, отдавая электроны.
В любой окислительно-восстановительной реакции участвуют две редокс-пары.
Существуют такие вещества, которые в одних реакциях могут быть окислителями, а в других – восстановителями, в зависимости от природы партнера-реагента и условий протекания окислительно-восстановительной реакции. Такие вещества иногда называют редокс-амфотерными. Примером могут служить пероксид водорода Н2О2, нитрит-ион NO22- и некоторые другие.
Окислительно-восстановительные потенциалы редокс-пар
(редокс-потенциалы, электродные
окислительно-восстановительные потенциалы).
Если в окислительно-восстановительной реакции не участвуют ионы водорода, то в общем случае реальный условный окислительно-восстановительный потенциал Е редокс-пары описывается уравнением Нернста (1):
RT a( окисл )

 Е = Е 0 + ln (1)
Е = Е 0 + ln (1)
nF a (восст)
где Е0 – стандартный окислительно-восстановительный потенциал данной редокс-пары; n – число электронов, участвующих в окислительно-восстановительной реакции; R = 8,314 Дж*моль-1*К-1- универсальная газовая постоянная; F – число Фарадея – также универсальная постоянная, равная 96485 ≈ 96500 Кл/моль; Т – температура в Кельвинах (К), при которой протекает данный окислительно-восстановительный процесс; а(окисл) и а(восст) – активность окисленной и восстановленной форм соответственно.
Например, для редокс-пары Fe3+│Fe2+(n =1) уравнение (1) переходит в уравнение:
RT a(Fe3+)

 Е = Е 0 Fe3+/Fe2+ + ln
Е = Е 0 Fe3+/Fe2+ + ln
F a ( Fe 2+ )
Если активность окисленной и восстановленной форм равна единице, т.е. обе формы находятся в стандартных состояниях а(окисл) = 1 и а(восст) = 1, то второе слагаемое в правой части уравнения (1) обращается в ноль (ln1=0) и тогда Е = Е0.
Таким образом, стандартный окислительно-восстановительный потенциал Е0 редокс–пары – это такой потенциал редокс-пары, когда все участники окислительно-восстановительной реакции находятся в стандартных состояниях, т.е. их активности равны единице.
Для многих редокс-пар стандартные окислительно-восстановительные потенциалы определены при комнатной температуре и приводятся в соответствующих справочниках.
На практике используют уравнение (2), в котором активности заменены на концентрации окисленной формы с(окисл) и восстановленной формы с(восст):
RT с(окисл)

 Е = Е0 + ln (2)
Е = Е0 + ln (2)
nF с(восст)
Если температура – комнатная (Т = 298,15К), то, переходя к десятичным логарифмам, уравнения (1) и (2) можно представить в форме (3) соответственно:
0,059 c (окисл)

 Е = Е0 + lg (3)
Е = Е0 + lg (3)
n c (восст)
Это уравнение справедливо:
1. Для сильноразбавленных растворов, когда
а(окисл.) = с(окисл.)
а(восст.) = с(восст.)
f(окисл.) ≈ 1 f(восст.) ≈ 1
2. Растворы не являются сильноразбавленными, но коэффициенты активности окисленной и восстановленной форм приблизительно одинаковы вследствие близости химической природы
f(окисл. Формы) ≈ f(восст. Формы)
Если в реакции участвуют ионы водорода, то они указываются в уравнении Нернста в степенях, соответствующих стехиометрическим коэффициентам.
Например,
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O
0,059 [MnO4-]·[H+]8

 Е = Е 0 + lg
Е = Е 0 + lg
n [Mn2+]
Cr2O72- + 14H+ + 6ē → 2Cr3+ + 7H2O
Чем больше окислительно-восстановительный потенциал данной редокс-пары, тем более сильным окислителем является окисленная форма этой редокс-пары. Чем меньше окислительно-восстановительный потенциал, тем более сильным восстановителем является восстановленная форма этой редокс-пары.
Уравнения (1-3) часто называют уравнением Петерса.
Направление протекания
окислительно-восстановительной реакции.
Потенциал окислительно-восстановительной реакции или ЭДС можно посчитать по формуле:
Е = Е1 – Е2,
где Е1 и Е2 – окислительно-восстановительные потенциалы двух редокс-пар и считается по уравнению Нернста.
Е1 – окислительно-восстановительный потенциал той редокс-пары, окисленная форма которой в записи уравнения ОВР выступает в роли исходного вещества-окислителя.
Е2 – окислительно-восстановительный потенциал той редокс-пары, восстановленная форма которой в записи уравнения ОВР выступает в роли исходного вещества-восстановителя.
По величине потенциала Е (ЭДС) можно определить направление протекания окислительно-восстановительной реакции.
 Потенциал реакции Е (ее ЭДС) связан с изменением энергии Гиббса ∆G:
Потенциал реакции Е (ее ЭДС) связан с изменением энергии Гиббса ∆G:
∆G = - nFE
А стандартный потенциал реакции (ее стандартная ЭДС) Е0 связан со стандартным изменением энергии Гиббса ∆G0:
∆G0 = - nFE0
Согласно второму закону термодинамики, если изменение энергии Гиббса при любой химической реакции меньше нуля ∆G < 0, то эта реакция протекает в прямом направлении. Если ∆G > 0, то реакция протекает в обратном направлении. Если ∆G = 0, то в системе устанавливается устойчивое химическое равновесие.
Так как n > 0, F > 0, то при
∆G < 0 потенциал реакции Е > 0
∆G > 0 потенциал реакции Е < 0
∆G = 0 потенциал реакции Е = 0
Аналогичные выводы справедливы и тогда, когда все реагенты находятся в стандартных условиях:
∆G0 < 0 потенциал реакции Е0 > 0
∆G0 > 0 потенциал реакции Е0 < 0
∆G0 = 0 потенциал реакции Е0 = 0
Таким образом, знание знака потенциала реакции позволяет сделать вывод о направлении протекания реакции в данных условиях.
Например, определим в каком направлении протекает реакция:
Fe2+ + Ce4+ = Fe3+ + Ce3+
n=1
при комнатной температуре, если все реагенты находятся в стандартных условиях
a(Fe2+) = 1 a(Ce4+) = 1
a(Fe3+) = 1 a(Ce3+) = 1
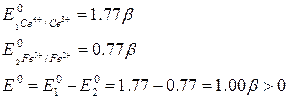
Следовательно, в заданных условиях реакция протекает в прямом направлении (в соответствии с записью уравнения реакции ионы Fe2+ окисляются ионами Ce4+)
Глубина протекания
Дата: 2019-02-02, просмотров: 547.