Любая реакция самопроизвольно протекает при постоянной температуре до тех пор, пока в системе установится состояние устойчивого химического равновесия. Этот закон распространяется и на окислительно-восстановительные реакции. Состояние устойчивого химического равновесия характеризуется константой равновесия К, которая связана со стандартным потенциалом реакции Е0.
Стандартное изменение энергии Гиббса ∆G0 связано со стандартным потенциалом реакции:
∆G0 = -nFE0
Из термодинамики известно, что
∆G0 = - RTlnKp (изотерма химической реакции)
- nFE0=- RTlnKp

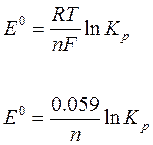
Таким образом, чем больше стандартный потенциал реакции, тем выше ее константа равновесия и тем больше глубина протекания реакции. Другими словами, глубина протекания окислительно-восстановительной реакции определяется разностью стандартных окислительно-восстановительных потенциалов редокс-пар, участвующих в реакции т.е. разностью Е0= Е10 – Е20.
Считается, что реакция идет практически до конца, если степень превращения исходных веществ реакции составляет не менее 99,99%.
ЭТАЛОНЫ РЕШЕНИЯ ЗАДАЧ
Задача 1
Рассчитайте реальный ОВ потенциал электрода, опущенного в раствор, в котором активности ионов MnO4- и Mn2+ одинаковы, pH = 1. Стандартный ОВ потенциал редокс-пары MnO4-, Н+ 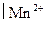 равен Е0 = 1,51 В при комнатной температуре.
равен Е0 = 1,51 В при комнатной температуре.
Решение:
В ОВ процессе (в полуреакции)
MnO4- + 5e- + 8Н+ = Mn2+ + 4H2O (n=5)
участвуют, в отличие от предыдущего примера, ионы водорода, поэтому реальный ОВ потенциал редокс-пары зависит от активности ионов водорода:
E = Е0 + (0,059/n)lg[a(MnO4-)a(Н+)8 / a(Mn2+)]. Согласно условию a(MnO4-) = a(Mn2+);
n = 5; a(Н+) = 10-pH = 10-1. Поэтому
Е0 = 1,51 + (0,059/5)lg(10-1)8 = 1,42 B
Задача 2
В каком направлении протекает реакция, приведенная в предыдущем примере, если концентрации реагентов изменены до с(HasO42-) = c(I-) = 0,1 моль/л, c(AsO2-) = c(I2) = 10-4 моль/л, рН = 1 (с(Н+) = 0,1 моль/л).
Решение:
По аналогии с предыдущим примером можно записать:
Е = 0,01 – (0,059/2)lg[10-4 · 10-4/ 10-1 · (10-1)2 · (10-1)3] = 0,069 B > 0.
Следовательно, в заданных условиях реакция протекает уже в прямом направлении.
Задача 3
Рассчитайте константу равновесия К реакции
Sn2+ + 2Ce4+ = Sn4+ + 2Ce3+
протекающей в водном растворе при комнатной температуре. Стандартные ОВ потенциалы редокс-пар Ce4+ 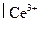 и Sn4+
и Sn4+ 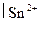 при комнатной температуре соответственно равны 1,77 и 0,15 В.
при комнатной температуре соответственно равны 1,77 и 0,15 В.
Решение:
Согласно уравнению (6.14») для десятичного логарифма константы равновесия имеем: lgK = nЕ0/0,059, где n – число электронов, принимающих участие в данной ОВ реакции, Е0 – стандартная ЭДС (стандартный потенциал) этой реакции, равная в данном случае Е0 = 1,77 – 0,15 = 1,62 В. Подставляя это значение Е0 в выражение для lgK и учитывая, что n = 2, получаем:
lgK = 2 ∙ 1,62/0,059 = 54,915, K = 8,2 ∙ 1053.
Задачи для самостоятельной работы
1.Рассчитайте ОВ потенциал редокс-пары Fe3+ | Fe2+ при комнатной температуре при следующих условиях: а) активности окисленной и восстановленной форм равны: a(Fe3+) == a(Fe2+); б) отношение активностей д(Fe3+):a(Fe2+) = 10; в) отношение активностей a(Fe3+):a(Fe2+) = 0,l. Стандартный ОВ потенциал данной редокс-пары при комнатной температуре равен Е° = 0,771 В. Ответ: 0,771; 0,830; 0,712 В.
2.Определите ОВ потенциал редокс-пары BrO3,H+ |Вг -, если концентрации с(ВrOз) = с(Вr - ) = с(Н+) = 0,01 моль/л, а стандартный ОВ потенциал этой редокс-пары при комнатной температуре Е° = 0,45 В. ОВ полуреакция может быть представлена в виде:
ВrО- + 6Н+ + 6e = Вг- + ЗН20
Коэффициенты активности ионов принять равными единице. Ответ: 1,33 В.
3.Рассчитайте ОВ потенциал редокс-пары IO3-,H+|I- в водном растворе, для которого pH = 2, а активности окисленной и восстановленной форм равны 1*10-4^ и 1*10-2 моль/л соответственно. Стандартный ОВ потенциал данной редокс- пары при комнатной температуре равен 1,08 В; число элекгронов, принимающих участие в ОВ процессе, равно п =6. Ответ: 0,94 В.
4.Как изменится ОВ потенциал электрода, погруженного в раствор, содержащий хлорат-ионы CLO3- и хлорид-ионы СL- при их одинаковых активностях, если pH этого раствора уменьшить от 5 до 1? Стандартный ОВ потенциал редокс- пары CLO3-,Н+ | CL- при комнатной температуре равен Е° =1,45 В; n=6. Ответ: потенциал возрастет на 0,24 В.
5.Рассчитайте ОВ потенциал редокс-пары Cr2O72-,H+ |Сг- в растворе, полученном при смешивании 100 мл раствора дихромата калия К2Сг207 с концентрацией с(К2Сг207) = 0,10 моль/л, 50 мл раствора хлорида хрома СгСL3 с концентрацией с(СгСL3) = 0,10 моль/л и 100 мл раствора серной кислоты H2SO4 с концентрацией c(H2S04) = 0,125 моль/л. Коэффициенты активности ионов принять равными единице. Стандартный ОВ потенциал редокс-пары Сг2072-,Н+ | Сг3+ при комнатной температуре равен Е° = 1,33 В; n = 6. Ответ: 1,21 В.
6.В 200 мл раствора серной кислоты с концентрацией 0,028 моль/л растворили 0,400 г сульфата железа(III) Fe2(S04)3 и 0,304 г сульфата железа(II) FeS04. Определите, чему равен ОВ потенциал редокс-пары Fe3+ | Fe2+ в полученном растворе с учетом ионной силы раствора (коэффициенты активности ионов не равны нулю). Стандартный ОВ потенциал указанной редокс-пары при комнатной температуре равен 0,771 В. Ответ: 0,74 В.
7.Реальный ОВ потенциал редокс-пары Sn4+ | Sn2+ при комнатной температуре равен 0,20 В. Рассчитайте, чему равно отношение активностей окисленной и восстановленной форм a(Sn4+)|a(Sn +) в данном растворе. Стандартный ОВ потенциал указанной редокс-пары при комнатной температуре равен Е° = 0,15 В. Ответ: 50.
8.При каком значении pH водного раствора реальный ОВ потенциал редокс пары BrO3-,H+ |Вг -, в кислой среде составляет Е = 1,28 В при комнатной температуре, если активности окисленной и восстановленной форм одинаковы a(Вг03-) = a(Вг-). Стандартный ОВ потенциал данной редокс-пары равен Е° = 1,45 В при комнатной температуре; n = 6. Ответ: 2,88.
9.Покажите, можно ли в стандартных состояниях веществ осуществить при комнатной температуре реакцию окисления хлорид-ионов СL- ионами церия(IV): Се4+ +СL- = Се3+ + 0,5СL2. Стандартные ОВ потенциалы редокс-пар Се4+ | Се3+ и СL2| СL равны соответственно Е° = 1,77 В и Е° = 1,36 В при комнатной температуре. Ответ: можно, так как ЭДС реакции положительна.
10.Покажите, при каком отношении активностей реагентов
[a(Fe3+)/a(Fe2+)]:[a(Ce4+)/a(Ce3+)] реакция
Fe2+ + Се4+ = Fe3+ + Се3+
будет протекать в обратном направлении при комнатной температуре. Стандартные ОВ потенциалы редокс-пар Fe3+| Fe2+ и Се4+| Се3+ равны соответственно 0,77 и 1,77 В при комнатной температуре. Ответ: [a(Fe3+)/a(Fe2+)]:[a(Ce4+)/a(Ce3+)] > 1017; при этом условия реальный ОВ потенциал редокс-пары Fe3+ | Fe2* будет больше реального ОВ потенциала редокс-пары Се4+| Се3+.
11.Рассчитайте константу равновесия реакции
МnО4 + 5Вг-+ 8H+ = Мп2+ + 2,5Вг2 + 4Н20
протекающей при комнатной температуре. Стандартные ОВ потенциалы редокс – пар MnO4,H+| Мn2+ и Вг2|Вr- — равны соответственно 1,51 и 1,087 В пред комнатной температуре. Ответ: 7* 1035.
12.Рассчитайте константу равновесия реакции
2I- +Н202 +2Н+ = I2 + 2Н20
при комнатной температуре. Стандартные ОВ потенциалы редокс-пар I2|I- и Н202,Н+ |Н20 равны при комнатной температуре 0,621 и 1,77 В соответственно. Ответ :1039.
Контрольные вопросы и задания по теме занятия
1.Что называют редокс-парой?
2. Что называют редокс-амфотерными веществами? Приведите примеры.
3. Каким образом можно определить окислительно-восстановительные потенциалы редокс-пар?
4. Что называют окислительно-восстановительным электродом? Какие существуют разновидности окислительно-восстановительных электродов?
5. Что называют условным (относительным) окислительно-восстановительным потенциалом редокс-пары? Ответ поясните на примере.
6. Каким уравнением описывается условный окислительно-восстановительный потенциал?
7. Что называют стандартным окислительно-восстановительным потенциалом?
8. Как можно рассчитать потенциал окислительно-восстановительной реакции (ЭДС)?
9. Каким образом можно по величине окислительно-восстановительного потенциала реакции (ЭДС) определить направление протекания реакции?
10. Какие факторы влияют на величину окислительно-восстановительного потенциала?
11. Как связана константа равновесия со стационарным потенциалом реакции? Как вывести эту зависимость?
12. Какие окислительно-восстановительные реакции используют для открытия катионов (Hg22+; Mn2+)?
13. Какие окислительно-восстановительные реакции используют для открытия анионов (BrO3-; AsO4-)?
14. Какие окислительно-восстановительные реакции используют в фармацевтическом анализе?
Основная литература:
1. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. Для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. Шк., 2008. – 146 – 171 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 562 – 563 с.
Тема 11
Дата: 2019-02-02, просмотров: 1786.